6.1 Rekapitulation Schulwissen
Dieses Thema wurde in der Schule mit hoher Wahrscheinlichkeit nicht behandelt.
6.2 Studienvorbereitung
Bei der Radikalischen Substitution hatten wir das Phänomen der Selektivität kennengelernt: Tertiäre H-Atome werden im ersten Kettenfortpflanzungsschritt leichter abstrahiert als sekundäre, und diese wiederum leichter als primäre. Die Ursache hierfür lag im +I-Effekt der gebundenen Alkylgruppen bzw. der Hyperkonjugation.
6.2.1 Die Allylstellung
Es gibt aber eine Konstellation bei organischen Verbindungen, die noch leichter von Radikalen angegriffen werden kann als tertiäre H-Atome. Nämlich C-Atome, die sich in direkter Nachbarschaft zu einer C=C-Doppelbindung befinden, in der sogenannten Allylstellung.
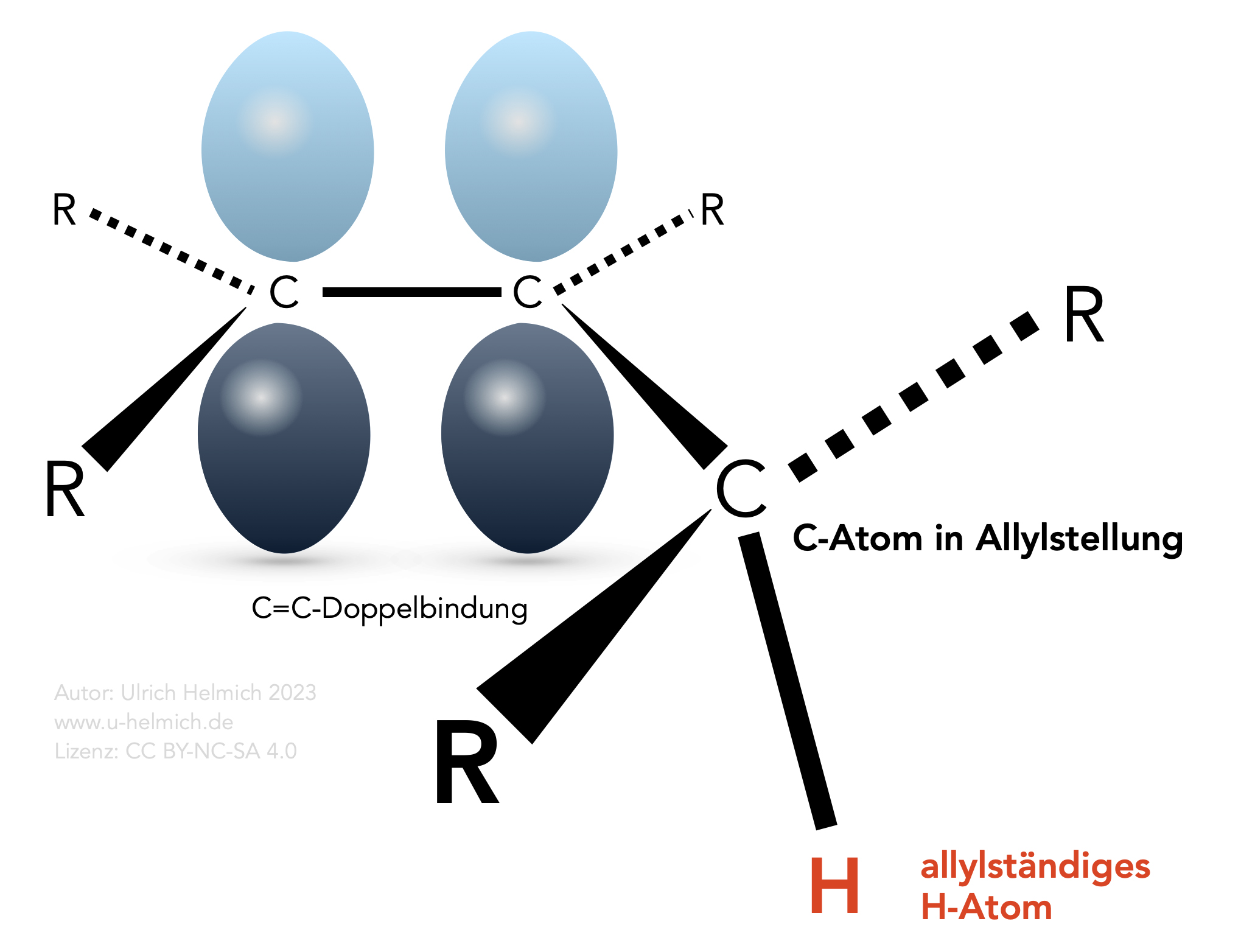
Die Allylstellung
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Als Allylstellung bezeichnet man die Position eines C-Atoms in direkter Nachbarschaft zu einer C=C-Doppelbindung. Außerdem muss dieses C-Atom mindestens ein H-Atom gebunden haben, das sogenannte allylständige H-Atom.
Dieses H-Atom kann nun besonders leicht abstrahiert werden, beispielsweise im Laufe einer Radikalischen Substitution.
Warum ist das so?
Dazu müssen wir uns einmal das Radikal näher anschauen, das sich durch das Entfernen des H-Atoms bildet:
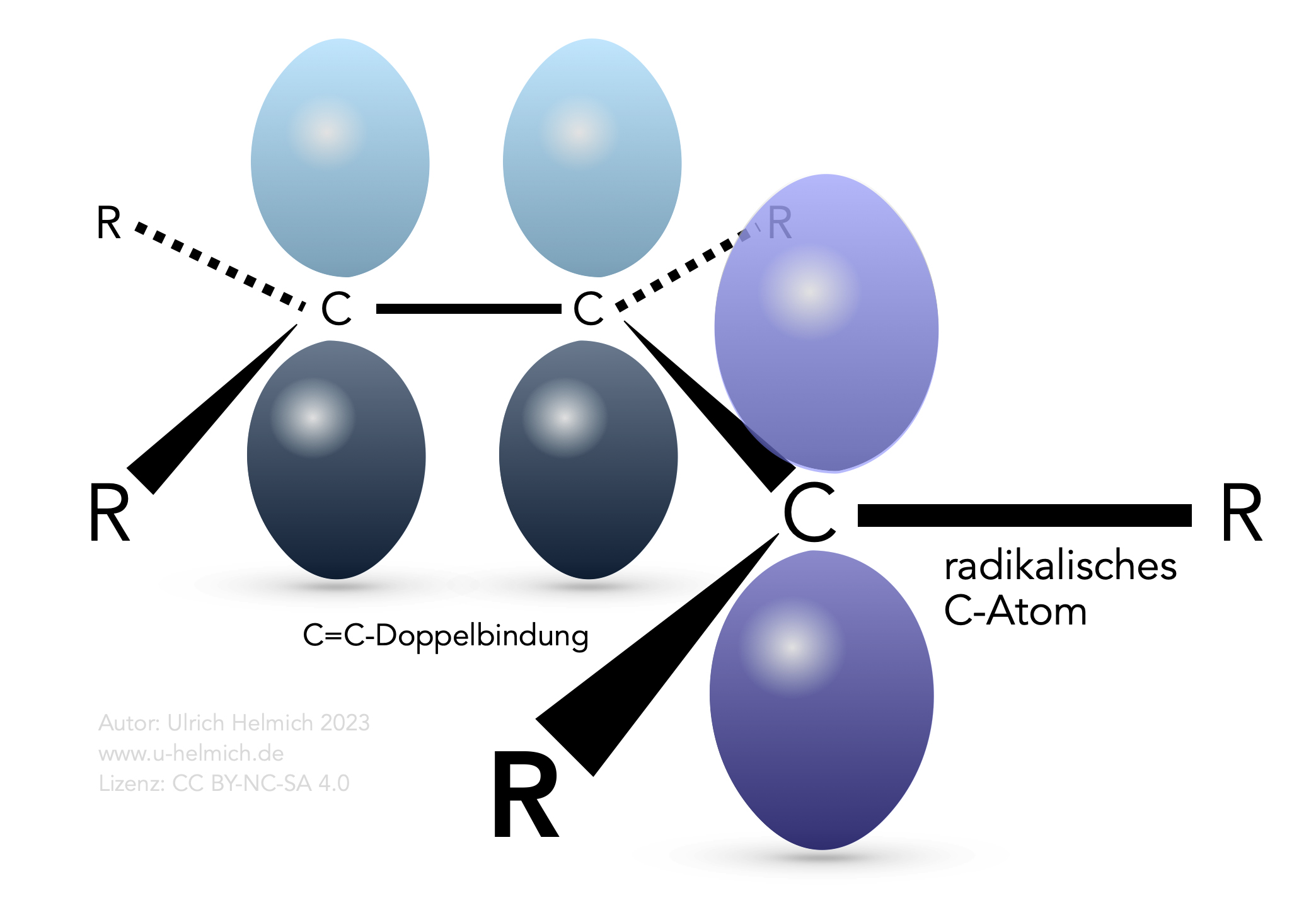
Ein C-Radikal in Allylstellung
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Das radikalische C-Atom ist sp2-hybridisiert, und die beiden benachbarten C-Atome der C=C-Doppelbindung sind ebenfalls sp2-hybridisiert.
Die drei pi-Elektronen der drei pz-Orbitale können sich nun frei in diesen drei Orbitalen aufhalten, es entsteht quasi eine Elektronenwolke mit drei pi-Elektronen, die sich über diese drei C-Atome erstreckt. Durch diese Delokalisierung der Elektronen wird die Elektronendichte in dem radikalischen pz-Orbital stark erhöht, was dann die Bildung dieses Radikals enorm erleichtert, noch stärker als bei der Bildung eines tertiären Alkyl-Radikals.
Auf dieser Seite wird die Allyl-Gruppe intensiver beleuchtet. Auch die Molekülorbitale der Allyl-Gruppe werden hier erläutert.
Das einfachste Alken mit einer solchen Allylstellung ist das Propen. Versetzt man Propen mit wenig Chlor oder Brom und belichtet das Stoffgemisch, findet eine Radikalische Substitution in Allylstellung statt. Ein anderer Reaktionsmechanismus, der in Anwesenheit von Radikalstartern ablaufen kann, ist die Radikalische Addition.
Fehlt das Licht und ist kein Radikalstarter zugegen, läuft stattdessen eine normale Elektrophile Addition des Halogens ab. Die beiden Additions-Reaktionen (radikalisch und elektrophil) werden vor allem bei höheren Halogen-Konzentrationen bevorzugt.
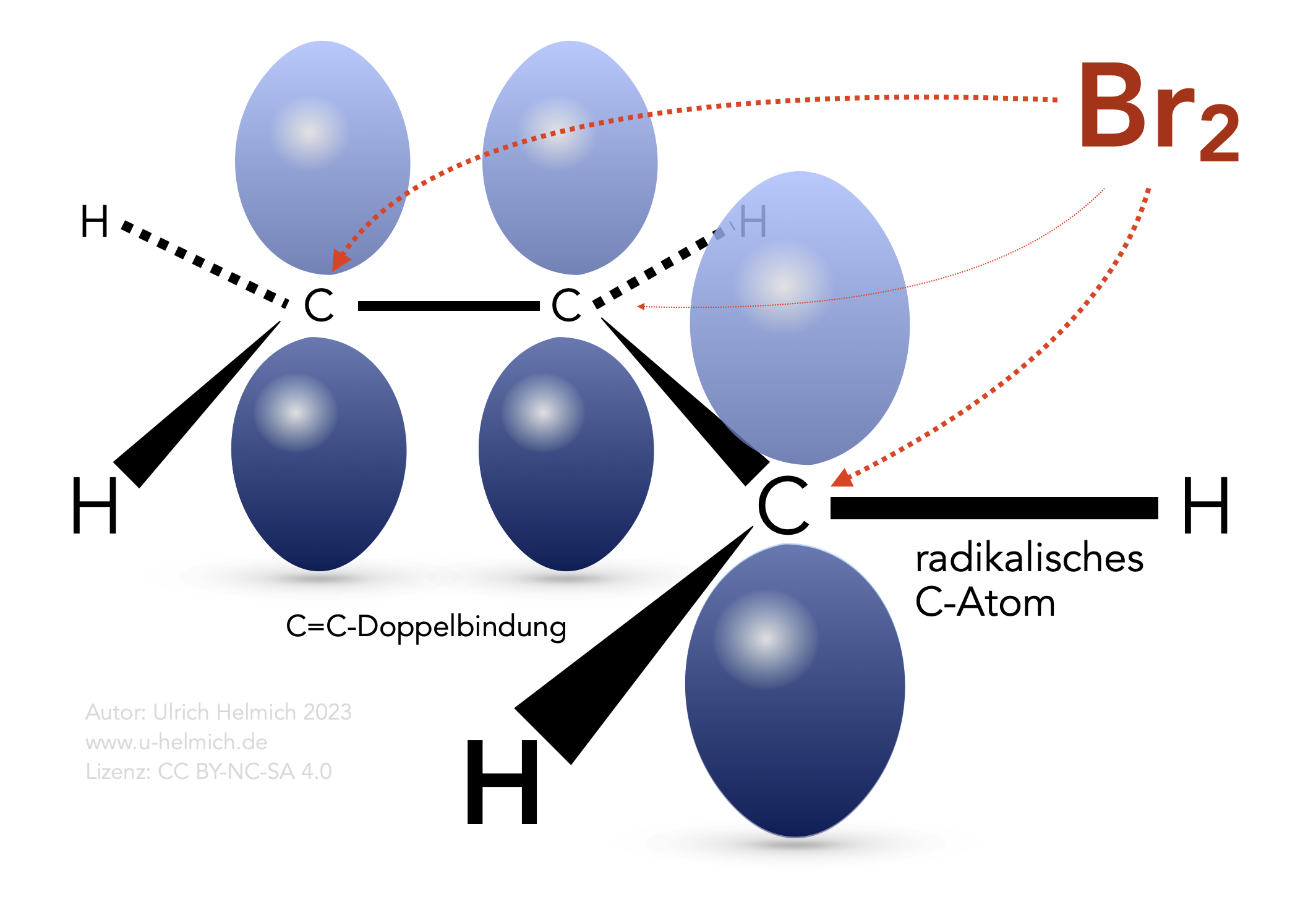
Das Halogen-Molekül kann zwei C-Atome angreifen
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Das Bild verdeutlicht, dass wir es im Grunde mit zwei Radikalen gleichzeitig zu tun haben. Das im zweiten Kettenfortpflanzungsschritt abstrahierte Brom-Atom kann sich gleich gut an das "vordere" wie an das "hintere" C-Atom des Systems aus C=C-Doppelbindung und Allyl-Radikal anlagern.
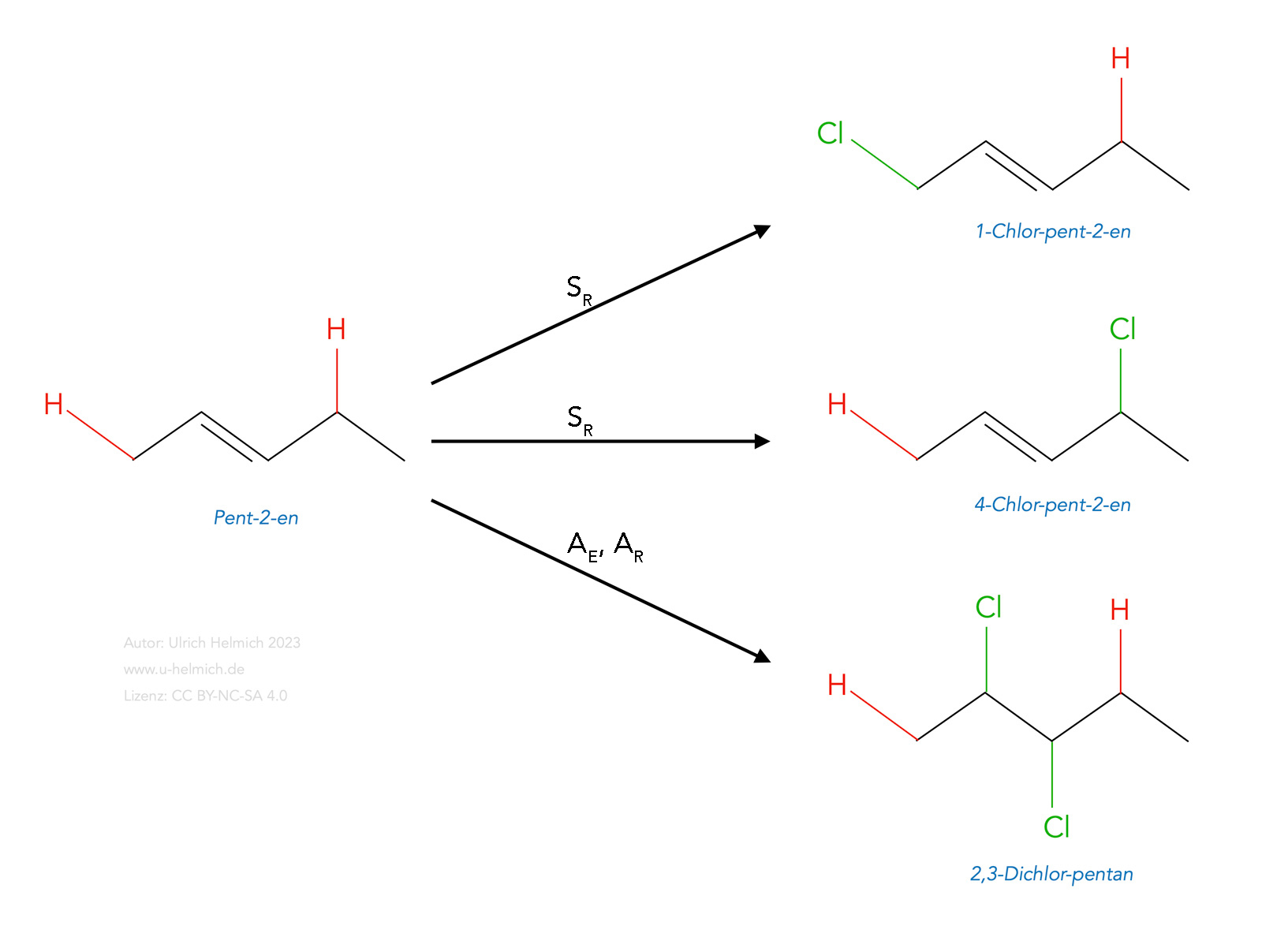
Chlorierung von Pent-2-en
Autor: Ulrich Helmich 01/2023, Lizenz: CC BY-NC-SA 4.0
Dieses Bild verdeutlicht noch einmal die verschiedenen Reaktionsmöglichkeiten eines Alkens. Das Pent-2-en hat zwei verschiedene allylständige H-Atome, die leicht substituiert werden können. Es sind zwei verschiedene Reaktionsprodukte der radikalischen Substitution (SR) möglich, nämlich 1-Chlor-pent-2-en und 4-Chlor-pent-2-en, je nachdem, welches der beiden H-Atome ersetzt wird. Und natürlich ist auch eine elektrophile oder radikalische Addition (AE bzw. AR) möglich, die dann zu 2,3-Dichlor-pentan führt.
6.3 Was sagt die Fachliteratur?
Im Buddrus/Schmidt gibt es auf Seite 93 einen eigenen Abschnitt über die radikalische Halogenierung von Alkenen in Allylstellung. Im Fox/Whitesell findet man zwar einige Ausführungen zu Allyl-Radikalen, aber nichts von Belang über die radikalische Halogenierung in Allylstellung.
Im Morrison/Boyd finden sich in Abschnitt 6B mehrere Sections (6B.6 bis 6B.11) über Allyl-Radikale, eine insgesamt sehr ausführliche Darstellung. Auch der Vollhardt/Schore behandelt das Allyl-Radikal sowie die Radikalische Halogenierung in Allylstellung im Abschnitt 14.2 sehr ausführlich. Im Clayden findet man im Register zwar die Stichworte "Allyl-Anion" und "Allyl-Kation", nicht jedoch "Allyl-Radikal".
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
Seitenanfang -
Weiter mit der Elektrophilen Addition an Alkene...