Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
- Eigenschaften ausgewählter Stoffklassen:
Löslichkeit,Schmelztemperatur, Siedetemperatur - intermolekulare Wechselwirkungen
*nach dem Kernlehrplan des Landes NRW 2022
Siedepunkte
Die folgende Graphik zeigt die Siedetemperatur der ersten zehn Alkanole:
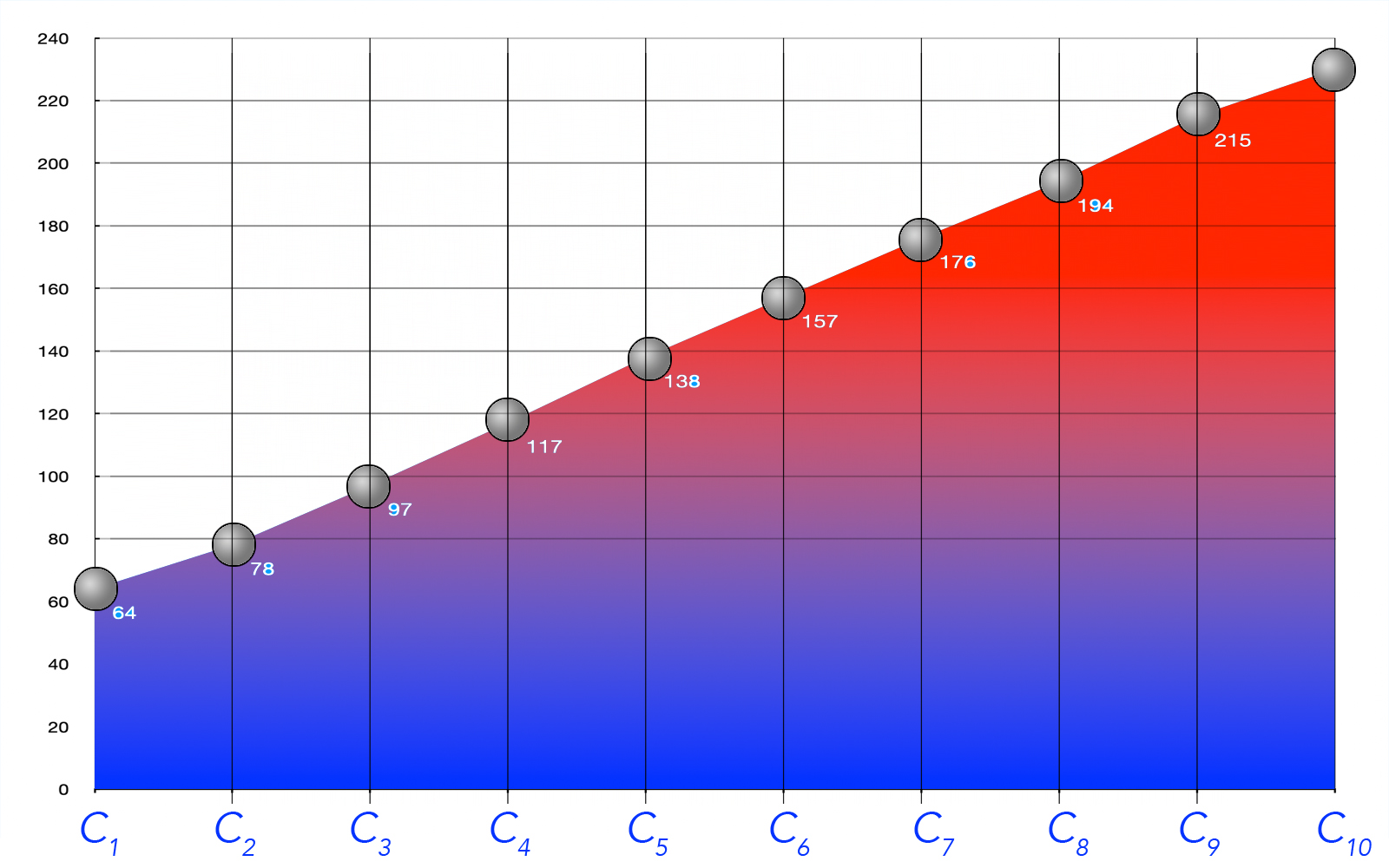
Siedepunkte der ersten 10 Alkanole
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Ähnlich wie bei den homologen Reihen der Alkane, Alkene und Alkine steigt die Siedetemperatur der Alkanole mit zunehmender Kettenlänge mehr oder weniger kontinuierlich an. Die Ursache hierfür sind die zunehmenden van-der-Waals-Kräfte (genauer: London-Kräfte).
Abgesehen davon haben die Alkanole wesentlich höhere Siedetemperaturen als vergleichbare Alkane oder Alkene. Zum Beispiel siedet n-Hexan bei 69 ºC, während Hexan-1-ol eine Siedetemperatur von 157 ºC hat. Ethanol hat einen Siedepunkt von ca. 78 ºC, während das Alkan Propan (ähnliche molare Masse) bei Raumtemperatur gasförmig ist.
Die relativ hohen Siedepunkt der Alkanole im Vergleich zu Alkanen und Alkenen erklären sich vor allem durch das Vorhandensein der OH-Gruppe. OH-Gruppen sind sowohl H-Brücken-Donatoren wie auch H-Brücken-Akzeptoren. Die Moleküle eines Alkohols bilden also untereinander relativ starke H-Brücken aus.
Auf dieser Vertiefungsseite wird näher auf die Siedetemperaturen der Alkanole und ihre Ursachen eingegangen.
Aufgabe 1
Pentan-1-ol hat eine Siedetemperatur von 138 ºC, Pentan-3-ol dagegen siedet bei 116,1 ºC. Finden Sie eine Erklärung für diesen Unterschied.
Hier geht es zur Lösung dieser Aufgabe.
Aufgabe 2
Carbonsäuren besitzen eine COOH-Gruppe als funktionelle Gruppe. Diese Carboxy-Gruppe besteht aus einem C-Atom, einem mit einer Doppelbindung gebundenem O-Atom und einer OH-Gruppe. Carbonsäuren haben allgemein einen wesentlich höheren Siedepunkt als vergleichbare Alkohole. Finden Sie eine Erklärung für diese Tatsache.
Hier geht es zur Lösung dieser Aufgabe.
Wasserlöslichkeit
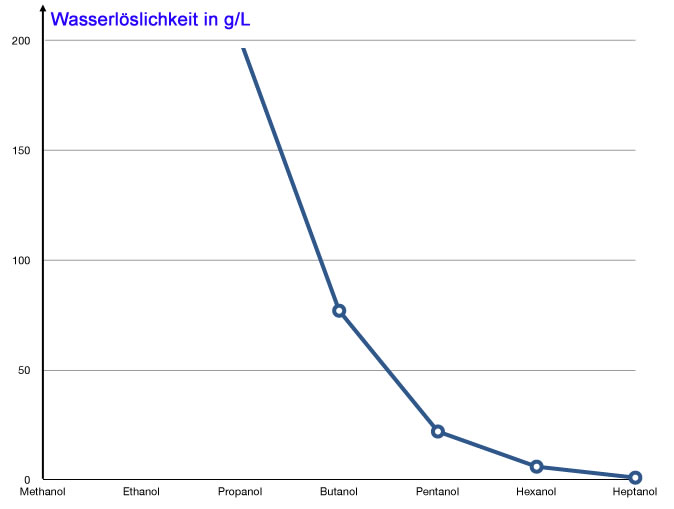
Graphische Darstellung der Wasserlöslichkeit von Alkanolen
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Methanol, Ethanol und Propanol sind unbegrenzt in Wasser löslich. Verantwortlich hierfür ist die OH-Gruppe der Alkohole, die mit den Wasser-Molekülen des Lösungsmittels H-Brücken bilden kann.
Bei Alkoholen mit vier, fünf oder noch mehr C-Atomen nimmt nämlich der Einfluss der Alkylkette immer mehr zu. Je mehr C-Atome die Alkylkette hat, desto mehr ähnelt der Alkohol einem Alkan. Bei Heptanol und Octanol schließlich ist die Wasserlöslichkeit kaum noch der Rede wert.
Hier finden Sie einen interessanten Demonstrationsversuch zur Löslichkeit verschiedener Alkanole in Wasser und Hexan.
Mehrwertige Alkohole
Bei mehrwertigen Alkoholen spielt die Anzahl der OH-Gruppen eine wichtige Rolle sowohl bei den Siedetemperaturen wie auch bei der Wasserlöslichkeit. Wir denken dabei einmal an das Kohlenhydrat Traubenzucker, auch als Glucose bezeichnet. Glucose ist im strengen Sinne zwar kein Alkohol, hat aber immerhin fünf OH-Gruppen an seinen sechs C-Atomen. Ein einwertiger Alkohol mit sechs C-Atomen hat einen hohen Siedepunkt, ist aber so gut wie nicht mehr wasserlöslich. Glucose dagegen mit ihren sechs C-Atomen ist fast unbegrenzt in Wasser löslich, und der Siedepunkt ist deutlich höher als bei Hexanol. Während Hexanol bei Raumtemperatur flüssig ist, ist Glucose ein Feststoff.
Hier gilt wieder die wichtige Beziehung zwischen Struktur und Eigenschaft: Je mehr OH-Gruppen ein Alkohol, desto mehr H-Brücken können sich zwischen den Molekülen bilden, und desto höher sind die Siedetemperaturen und die Wasserlöslichkeit.
Diese Seite wurde speziell für Studienanfänger der Fächer Chemie, Biologie und Medizin geschrieben. Hier finden Sie weitere Einzelheiten zu den physikalischen Eigenschaften der Alkohole.