Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
- funktionelle Gruppen verschiedener Stoffklassen und ihre Nachweise:
Hydroxy-Gruppe, Carbonyl-Gruppe, Carboxy-Gruppe und Ester-Gruppe - Elektronenpaarbindung:
Einfach- und Mehrfachbindungen,Molekülgeometrie (EPA-Modell) - Oxidationsreihe der Alkanole:
Oxidationszahlen
*nach dem Kernlehrplan des Landes NRW 2022
Oxidation und Reduktion
In dem YouTube-Video von Ramona Reinhart wird auf die Oxidationsprodukte der primären und sekundären Alkohole eingegangen.
Alkohole können leicht oxidiert und reduziert werden.
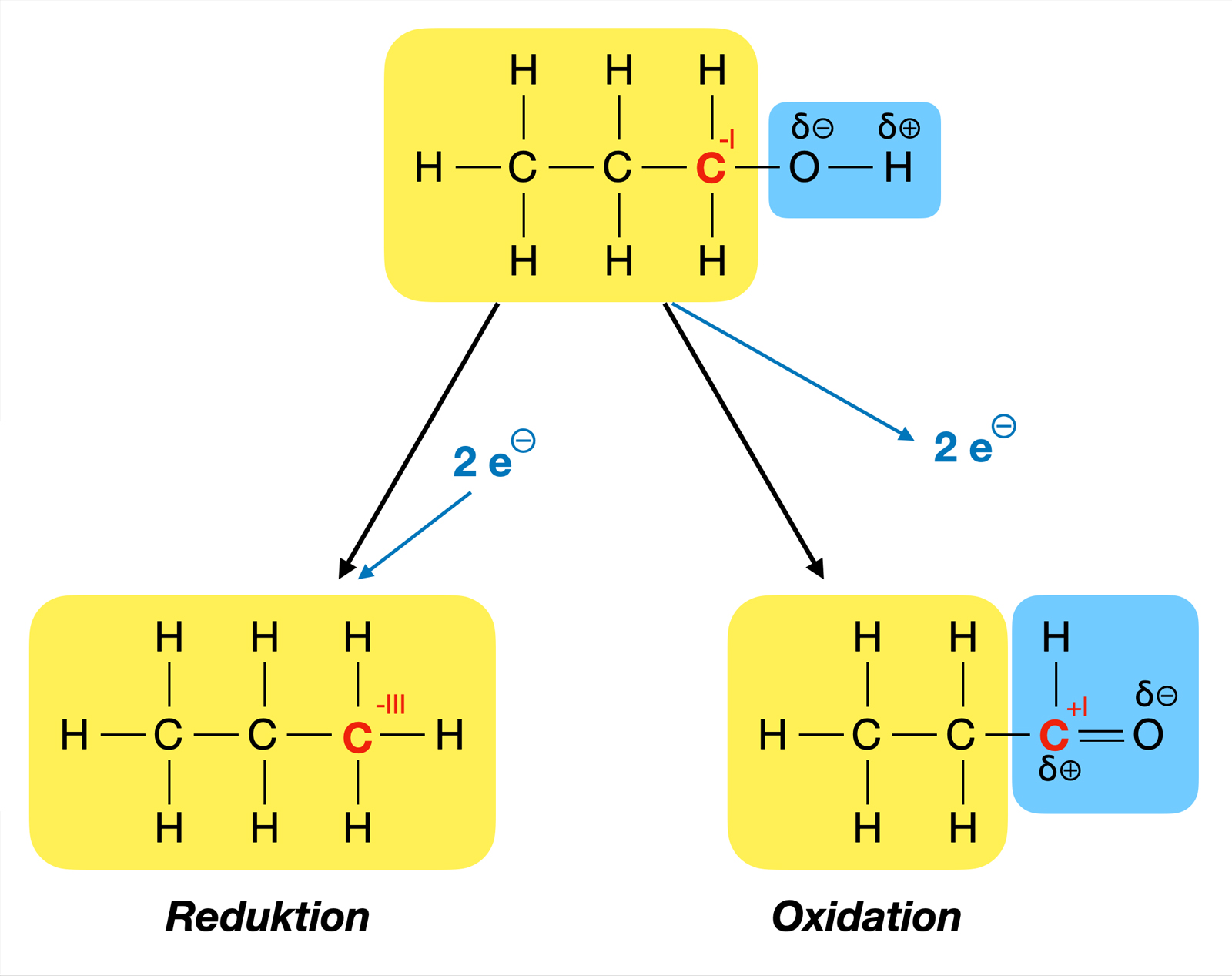
Oxidation und Reduktion eines primären Alkohols
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Ein Alkohol kann sowohl oxidiert wie auch reduziert werden. Bei der Oxidation entsteht aus einem primären Alkohol ein Aldehyd, aus einem sekundären Alkohol ein Keton. Tertiäre Alkohole können nur zu Wasser und Kohlendioxid oxidiert werden. Aus dem oben gezeigten Propan-1-ol entsteht durch Oxidation der Aldehyd Propanal. Aus der Hydroxy-Gruppe ist eine Aldehyd-Gruppe entstanden.
Bei der Reduktion eines Alkohols entsteht ein Alkan, aus dem oben gezeigten Propan-1-ol entsteht beispielsweise Propan. Aus der Hydroxy-Gruppe ist ein H-Atom entstanden.
Oxidation
In einem einfachen Schülerversuch erhitzt man ein Kupferblech und steckt es dann in eine Glas- oder Porzellanschale mit einem Alkohol.
Beim Erhitzen des Kupferblechs bildet sich Kupferoxid CuO. Das Kupfer liegt dann in Form zweiwertiger Kupfer-Kationen Cu2+ vor. Diese sind in der Lage, je zwei Elektronen aufzunehmen und so zu Kupfer-Atomen Cu zu werden.
In der Abbildung 1 sieht man gut, dass bei der Oxidation eines Alkohols zwei Elektronen freigesetzt werden. Diese beiden Elektronen werden bei der Reaktion von den Kupfer-Kationen aufgenommen.
Wo aber bleiben die beiden Wasserstoff-Atome, die bei der Oxidation des Alkohols abgegeben werden?
Das Kupferoxid CuO enthält nicht nur Kupfer-Kationen Cu2+, sondern auch Sauerstoff-Anionen O2-. Und diese Sauerstoff-Anionen reagieren nun mit je zwei Protonen aus dem Alkohol zu einem Wasser-Molekül.
Aufgabe 1
Stellen Sie die hier dargestellten Vorgänge der Oxidation eines Alkohols mit Hilfe von Kupfer am Beispiel des Ethanols übersichtlich und schematisch mit vollständigen Reaktionsgleichungen dar. Gehen Sie dabei besonders auf die relevanten Bindungselektronen in dem Ethanol-Molekül ein (C-H-Bindung der CH2-Gruppe und O-H-Bindung der OH-Gruppe).
Die Oxidationsreihe der Alkohole
Wie bereits im vorherigen Abschnitt über die Oxidation der Alkohole erwähnt, können primäre Alkohole zu Aldehyden oxidiert werden, sekundäre zu Ketonen. Schauen wir uns diese Reaktionen am Beispiel der beiden Propanol-Isomere näher an.
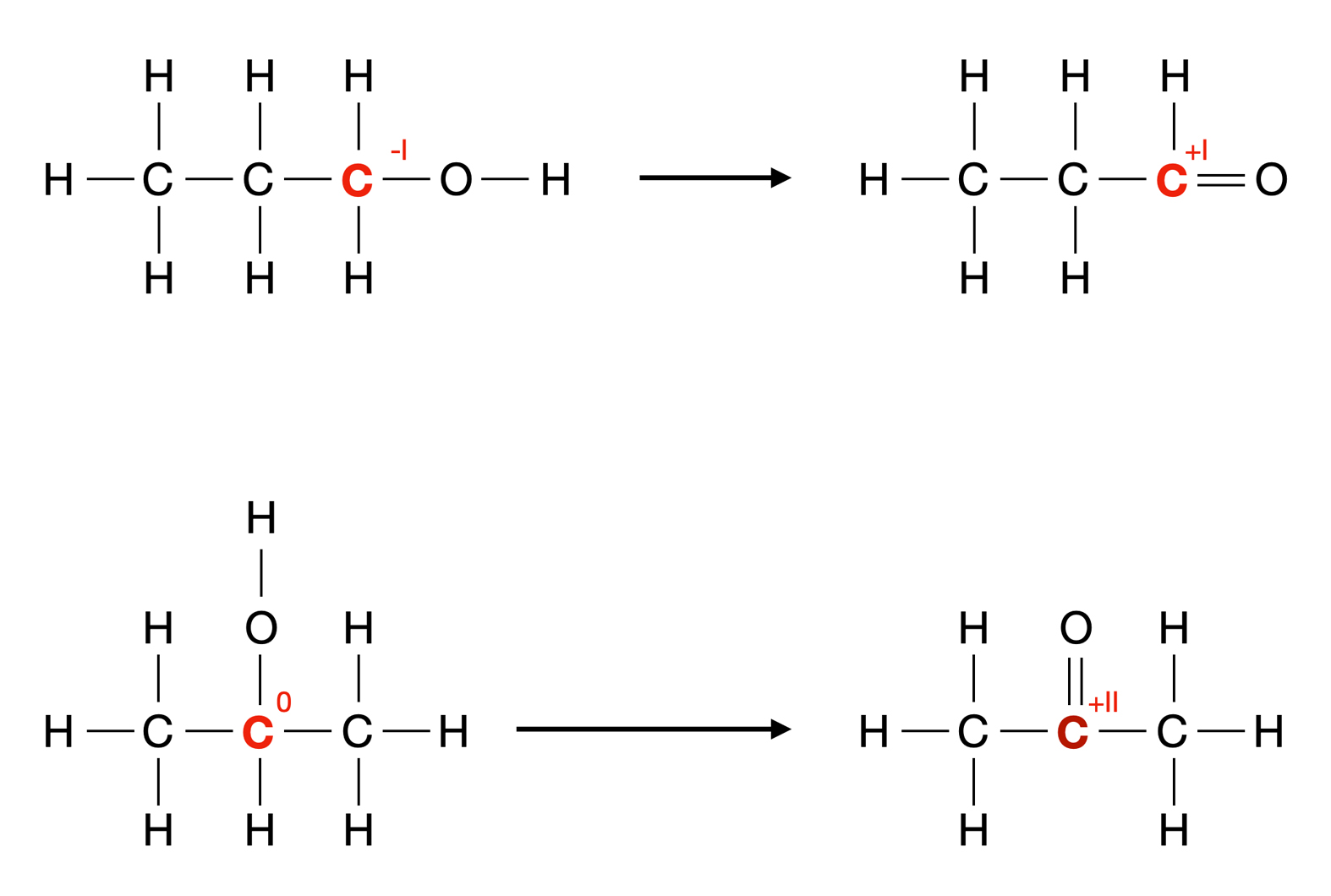
Oxidation eines primären und eines sekundären Alkohols
Autor: Ulrich Helmich 2ß22, Lizenz: Public domain
Oben im Bild sehen wir die Oxidation von Propan-1-ol zu Propanal, einem Vertreter der Aldehyde. Kennzeichnend für die Aldehyde ist die funktionelle Gruppe -CHO, die als Aldehyd-Gruppe bezeichnet wird.
Die Aldehyd-Gruppe wird als -CHO abgekürzt. Würde man sie mit -COH abkürzen, könnte man denken, dass eine OH-Gruppe in der Aldehyd-Gruppe vorkommt, was natürlich nicht der Fall ist. Also schreiben wir -CHO.
Die Oxidationszahl des entsprechenden C-Atoms ändert sich von -I auf +I. Bei der Oxidation werden also zwei Elektronen vom Alkohol abgegeben. Wenn Sie nicht wissen, was man unter einer Oxidationszahl versteht, lesen Sie sich den Kasten "Oxidationszahl" durch.
Unten im Bild sehen wir die Oxidation des Isomers Propan-2-ol zu Propanon, einem Keton. Bei Ketonen ist die Carbonyl-Gruppe -C=O die funktionelle Gruppe.
Auch Aldehyde besitzen in ihrer Aldehyd-Gruppe eine solche Carbonyl-Gruppe, hier ist die Carbonyl-Gruppe aber stets mit einem H-Atom verbunden. Bei Ketonen dagegen ist die Carbonyl-Gruppe mit zwei Alkyl-Resten verknüpft.
Der einfachste Vertreter der homologen Reihe der Ketone ist daher Propanon. Bei der Oxidation ändert sich die Oxidationszahl des C-Atoms von 0 auf +II, also ebenfalls um zwei Stufen. Bei der Oxidation werden also auch hier zwei Elektronen abgegeben.
Oxidationszahl
Die Oxidationszahl eines C-Atom ist eine rein formale Angabe, mit der man leicht überprüfen kann, ob ein C-Atom oxidiert oder reduziert wurde.
Zur Ermittlung der Oxidationszahl betrachtet man die Bindungselektronen der kovalenten Bindungen dieses C-Atoms. Ist das C-Atom mit einem elektronegativeren Atom verbunden (O, N etc.) dann werden die beiden Bindungselektronen diesem elektronegativeren Atom zugerechnet. Ist das C-Atom aber mit einem H-Atom oder einem anderen Atom verbunden, das eine geringere Elektronegativität besitzt als das C-Atom, dann werden die beiden Elektronen der kovalenten Bindung dem C-Atom zugerechnet.
Ist das C-Atom mit einen anderen C-Atom verknüpft, so werden die beiden Bindungselektronen gleichmäßig auf die beiden C-Atome aufgeteilt.
Betrachten wir nun das mittlere C-Atom des Propan-2-ol-Moleküls. Dieses C-Atom ist mit zwei weiteren C-Atomen verbunden, erhält also zwei Elektronen zugeschlagen, von jedem C-Atom eines. Dann ist dieses C-Atom mit einem elektropositiveren H-Atom verbunden, daher werden beide Bindungselektronen dem C-Atom zugerechnet. Jetzt hat dieses C-Atom - rein formal - vier Elektronen. Schließlich ist das C-Atom mit einem O-Atom verknüpft. Da dieses elektronegativer ist als das C-Atom, werden beide Bindungselektronen dem O-Atom zugeschlagen.
Rein formal besitzt das mittlere C-Atom des Propan-2-ol-Moleküls also vier Bindungselektronen. Genau so viele also, wie das C-Atom laut Periodensystem besitzen sollte. Die Oxidationszahl ist daher genau 0. Das C-Atom hat formal kein Elektron zu viel (negative Oxidationszahl) oder zu wenig (positive Oxidationszahl).
Die Oxidationszahl wird übrigens immer in römischen Ziffern angegeben.
Weitere Einzelheiten zu diesem Thema finden Sie auf dieser Seite im Chemie-Lexikon dieser Homepage.
Wieso spricht man hier von einer Oxidationsreihe?
Bei der Oxidation primärer Alkohole kann man von einer Oxidationsreihe sprechen, weil das Oxidationsprodukt Aldehyd weiter oxidiert werden kann, nämlich zu einer Carbonsäure.

Oxidationsreihe eines primären Alkohols
Autor: Ulrich Helmich 12/2024, Lizenz: Public domain
Dieses Bild zeigt die Oxidation von Propan-1-ol zu Propanal und dann weiter zu Propansäure. Bei jedem Oxidationsschritt werden formal zwei Elektronen abgegeben, mit denen dann andere Verbindungen reduziert werden können, zum Beispiel Cu2+-Ionen oder MnO4--Ionen (wie in Kaliumpermanganat, einem wichtigen Oxidationsmittel).
Die Ketone, die bei der Oxidation eines sekundären Alkohols entstehen, können nicht weiter oxidiert werden. Legt man es doch darauf an und verbrennt ein Keton, erhält man lediglich Kohlendioxid und Wasser, aber keine neue organische Verbindung.
Substitution und Eliminierung
Aus der Säure-Base-Chemie (Sekundarstufe I) kennen Sie sicherlich schon die Oxonium-Ionen H3O+. Diese entstehen, wenn sich ein Proton an eines der freien Elektronenpaare eines H2O-Moleküls setzt.
Auch Alkohole können mit ihrer OH-Gruppe eine solche Reaktion eingehen. Aus dem Alkohol R-OH wird dann ein Kation R-OH2+.
Dieses Kation ist allerdings recht instabil und kann die -OH2+-Gruppe leicht als Wasser-Molekül H2O abspalten. Hier sehen wir die Reaktion für den Alkohol Ethanol C2H5OH bzw. CH3-CH2-OH.
$CH_3-CH_2-OH_2^{+} \to CH_3CH_2^{+} + H_2O$
Die vom Proton mitgebrachte positive Ladung verbleibt nach der Abspaltung des Wasser-Moleküls beim Ethyl-Rest, es entsteht quasi eine Ethyl-Gruppe mit einem positiv geladenem C-Atom. Ein solches Kation wird auch als Carbenium-Ion bezeichnet.
Auch ein Carbenium-Ion ist ein recht instabiles Gebilde. Wie kann aus diesem instabilen Gebilde etwas Stabiles werden?
Bei einem Carbenium-Ion wie dem Ethyl-Kation gibt es dafür grundsätzlich zwei Möglichkeiten:
- Das Carbenium-Ion kann ein Proton abgeben. Damit verliert das Carbenium-Ion seine positive Ladung.
- Das Carbenium-Ion kann ein negatives Anion an das positive C-Atom anlagern. Dadurch wird die positive Ladung ausgeglichen und das Reaktionsprodukt ist elektrisch neutral.
Aufgabe 2
Formulieren Sie die folgenden Reaktionen mit Strukturformeln:
- Reaktion von Propan-1-ol mit einem Proton.
- Abspaltung eines H2O-Moleküls von dem Reaktionsprodukt aus 1.
- Abspaltung eines Protons aus dem Produkt von 2.
- Addition eines Brom-Anions an das Produkt aus 2.
Wenn Sie die Aufgabe bearbeitet oder sich zumindest den Lösungsvorschlag angeschaut haben, dann werden Sie auf zwei neue Fachbegriffe gestoßen sein: Eliminierung und Substitution.
Bei der Eliminierung wird die OH-Gruppe des Alkohols abgegeben und bildet zusammen mit einem H-Atom des Alkohols ein Wasser-Molekül. Das eine C-Atom gibt die OH-Gruppe ab, das andere C-Atom des Ethanols ein H-Atom. An jedem C-Atom bleibt durch die Spaltung einer kovalenten Bindung ein Bindungselektron zurück. Diese beiden zurückgebliebenen Bindungselektronen vereinigen sich nun zu einer neuen kovalenten Bindung. Es entsteht eine C=C-Doppelbindung. Aus dem Alkohol Propan-1-ol ist das Alken Propen geworden.
Bei der Substitution wird die OH-Gruppe des Alkohols abgegeben und durch ein anderes Atom oder eine Atomgruppierung ersetzt. In unserem Beispiel wurde die OH-Gruppe durch ein Brom-Atom ersetzt, es ist ein Halogenalkan entstanden, in unserem Fall das 1-Brompropan. Eine solche Ersetzung von Atomen oder Atomgruppen durch andere Atome oder Atomgruppen wird als Substitution bezeichnet.
Weiterführende Seiten
für Schüler der Qualifikationsphase
Speziell für Schüler der Qualifikationsphase geschriebene Seiten, auf denen dieser Reaktionsmechanismus ausführlich auf mehreren Seiten behandelt wird.
Speziell für Schüler der Qualifikationsphase geschriebene Seiten, auf denen dieser Reaktionsmechanismus ausführlich auf mehreren Seiten behandelt wird.
für Studienanfänger
Dieses Thema wird in der Studienvorbereitung "Organik" näher besprochen.
Auch dieses Thema wird in der Abteilung "Studienvorbereitung" behandelt.
Und auch dieses Thema, das bereits auf dieser Seite für die EF angerissen wurde, wird in der Studienvorbereitung vertieft.