Inhaltliche Schwerpunkte
Auf dieser Seite werden folgende inhaltliche Schwerpunkte* berücksichtigt:
- funktionelle Gruppen verschiedener Stoffklassen und ihre Nachweise:
Hydroxy-Gruppe,Carbonyl-Gruppe, Carboxy-Gruppe und Ester-Gruppe - Eigenschaften ausgewählter Stoffklassen:
Löslichkeit, Schmelztemperatur, Siedetemperatur - intermolekulare Wechselwirkungen
- Konstitutionsisomerie
*nach dem Kernlehrplan des Landes NRW 2022
Qualitative Analyse des Ethanols
1. Nachweis von Kohlenstoff und Wasserstoff
Mit einfachen Mitteln kann man herausbekommen, aus welchen Elementen Ethanol, der wichtigste Alkohol überhaupt, aufgebaut ist. Dazu verbrennt man etwas Brennspiritus in einer Porzellanschale und fängt die aufsteigenden gasförmigen Verbrennungsprodukte auf - eine Wasserstrahlpumpe sorgt für den entsprechenden Sog.
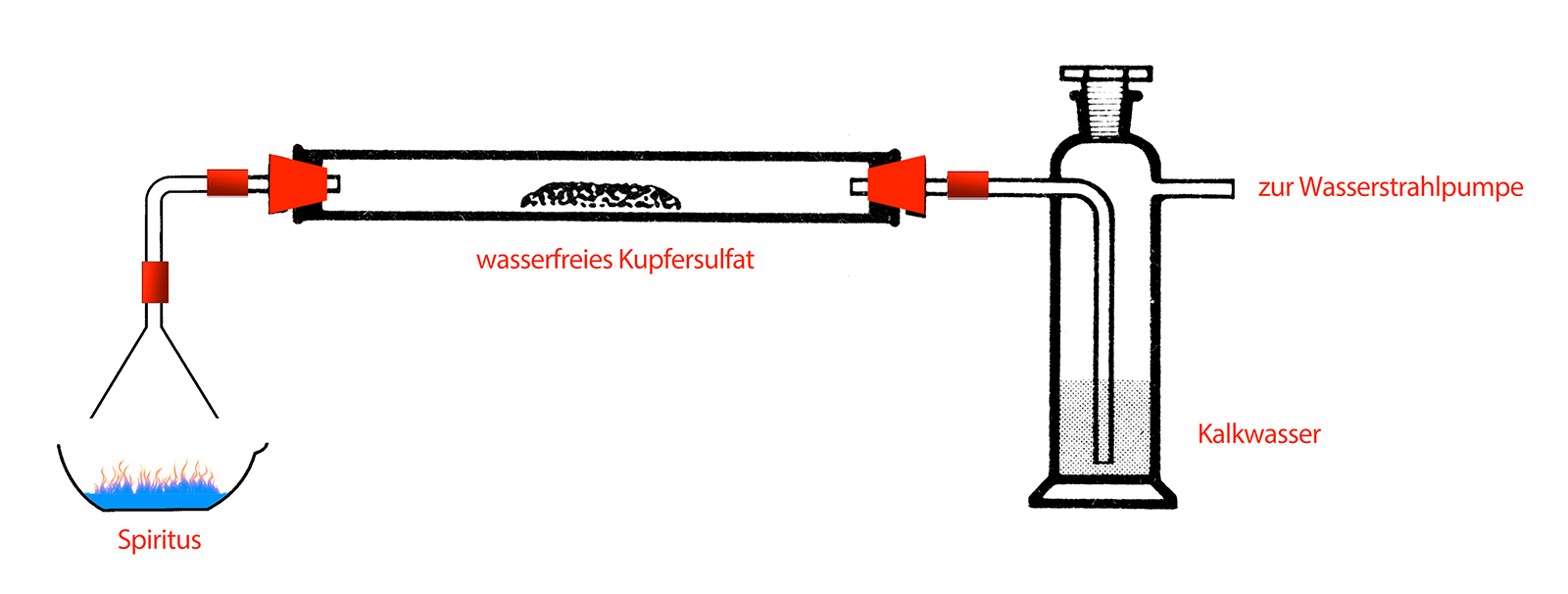
Qualitative Analyse von Spiritus
Autor: Ulrich Helmich 12/2024, Lizenz: Public domain
Die Verbrennungsprodukte werden zunächst über den Trichter (links) aufgefangen und in ein Verbrennungsrohr geleitet, in dem sich etwas wasserfreies Kupfersulfat befindet. An das Verbrennungsrohr ist eine Gaswaschflasche angeschlossen, in der sich Kalkwasser Ca(OH)2 befindet.
Man kann beobachten, dass sich das weiße Kupfersulfat blau färbt und dass sich das Kalkwasser trübt.
Die Blaufärbung des Kupfersulfats ist ein Nachweis für das Vorhandensein von Wasser, die Trübung des Kalkwassers ist ein Nachweis für das Verbrennungsprodukt Kohlendioxid. Wasser kann bei der Verbrennung nur entstehen, wenn der Brennstoff Wasserstoff enthält, und Kohlendioxid kann nur entstehen, wenn der Brennstoff Kohlenstoff enthält.
Wir haben mit diesem einfachen Versuch also nachgewiesen, dass Ethanol (Spiritus ist 96%iger Ethanol) Kohlenstoff und Wasserstoff enthält. Das genaue Verhältnis der beiden Elemente haben wir mit dieser einfachen Apparatur natürlich nicht ermitteln können, daher heißt es ja auch "qualitativer Nachweis" und nicht "quantitativer Nachweis".
Für einen solchen quantitativen Nachweis müsste man jetzt das weiße Kupfersulfat vorher genau wiegen, und statt Kalkwasser müsste man einen Feststoff verwenden, der CO2 absorbiert oder mit diesem reagiert und diesen Feststoff auch vorher wiegen. Und natürlich müsste man den Alkohol ebenfalls vorher wiegen. Außerdem müsste die Apparatur so aufgebaut sein, dass keine Verbrennungsprodukte nach außen entweichen können. Aus den Masse-Zunahmen von Kupfersulfat und dem CO2-Absorber könnte man dann das Atomzahlverhältnis C : H in dem Alkohol berechnen.
2. Nachweis von Sauerstoff
Man baut eine ähnliche Versuchsapparatur auf wie in dem oberen Bild, nur statt dem wasserfreien Kupfersulfat gibt man Magnesium-Späne in das Verbrennungsrohr. Die Gaswaschflasche mit dem Kalkwasser kann man weglassen, ebenso die Wasserstrahl-Pumpe.
Allerdings darf man hier den Alkohol nicht verbrennen, sondern muss ihn erhitzen und die Alkohol-Dämpfe durch das Verbrennungsrohr leiten. Dazu reicht ein Erlenmeyerkolben oder Rundkolben mit Ethanol, der über ein Glasrohr mit dem Verbrennungsrohr verbunden ist. Man erhitzt zunächst den Kolben mit dem Ethanol schwach, so dass Ethanol-Dämpfe das Verbrennungsrohr durchströmen und die dort noch enthaltene Luft verdrängen.
Wenn dann die Luft aus dem Verbrennungsrohr verdrängt ist, erhitzt man mit einem zweiten Brenner die Magnesiumspäne sehr stark, während man gleichzeitig den Kolben mit dem Alkohol weiter schwach erhitzt, so dass kontinuierlich Alkohol-Dämpfe durch das Verbrennungsrohr strömen.
Wenn man den Versuch richtig durchführt, kann man beobachten, wie sich auf den Magnesiumspänen eine weiße Schicht bildet.
Bei dieser weißen Schicht handelt es sich um Magnesiumoxid MgO. Da die Alkohol-Dämpfe die Luft aus dem Verbrennungsrohr verdrängt haben, kann der Sauerstoff nur aus dem Alkohol stammen. Damit haben wir nachgewiesen, dass Ethanol nicht nur Kohlenstoff und Wasserstoff enthält, sondern auch Sauerstoff.
3. Quantitative Analyse
Wie eine solche quantitative Analyse aussieht, hatten wir bereits unter Punkt 1 im Kleingedruckten besprochen. Das Ergebnis dieser sogenannten Elementaranalyse sieht dann so aus: Ein Ethanol-Molekül enthält zwei Kohlenstoff-Atome, sechs Wasserstoff-Atome und ein Sauerstoff-Atom. Daher ist die Verhältnisformel C2H6O.
Die Summenformel des Ethanols könnte dann ebenfalls C2H6O sein, aber vielleicht auch C4H12O2 oder C6H18O3 oder noch komplizierter. Um nun genau herauszufinden, welche Summenformel dieser Verhältnisformel entspricht, muss man die molare Masse des Ethanols bestimmen.
Versuch
Bestimmung der molaren Masse von Ethanol
Durchführung:
Zur Bestimmung der molaren Masse gibt man eine genauestens abgewogene Menge Ethanol in einen großen Rundkolben, der anschließend mit einem durchbohrten Stopfen verschlossen wird, in dem sich ein Glasrohr befindet, das mit einem leichtgängigen Kolbenprober verbunden ist. Der Rundkolben wird dann in die Hand genommen und mehrmals geschwenkt. Der Alkohol verdunstet und die Dämpfe gelangen in den Kolbenprober, dessen Kolben sich dann nach außen bewegt. Wenn kein weiterer Alkohol mehr verdunstet, wird das Volumen am Kolbenprober abgelesen.
Unter der vereinfachenden Annahme, dass ein Mol des Alkohols ein Volumen von 24 Litern besitzt, kann man nun ausrechnen, wie viel Mol Ethanol sich in dem Rundkolben befinden.
Beobachtungen (Beispiel):
Angenommen, man hat 0,1 g Alkohol eingewogen und liest am Kolbenprober ein Volumen von 35 ml ab.
Hätte man genau 24 ml abgelesen, dann wüsste man, dass sich genau 1 mmol Alkohol in dem Rundkolben befinden. Bei 35 ml Volumen hat man dann entsprechend 35/24 = 1,46 mmol Alkohol.
Wenn diese 1,46 mmol Alkohol eine Masse von 0,1 g haben, dann hat 1 mmol Alkohol eine Masse von 0,1/1,46 = 0,068 g und 1 mol dieses Alkohols hätte eine Masse von 68 g.
Aufgabe 1
Ethanol hat eine molare Masse von 46 g/mol.
Welches Volumen müsste man im Kolbenprober erwarten, wenn man 0,1 g Ethanol in den Rundkolben gibt?
Hier finden Sie die Lösung dieser Aufgabe.
Das Ergebnis einer solchen Molmassen-Bestimmung ist M(Ethanol) = 46 g/mol. Damit liegt die Summenformel nun fest: C2H6O.
4. Bestimmung der Strukturformel
Ein C-Atom ist stets vierbindig, ein H-Atom einbindig und ein O-Atom zweibindig. Es gibt also nicht allzu viele Möglichkeiten, wie sich die beiden C-Atome, die sechs H-Atome und das eine O-Atom miteinander verbinden können.
- Möglichkeit 1: H3C-CH2-OH
- Möglichkeit 2: H3C-O-CH3
Bei dem ersten Konstitutions-Isomer befindet sich das O-Atom in einer Hydroxy-Gruppe -OH, die an einem Ethyl-Rest hängt. Bei dem zweiten Konstitutions-Isomer steht das O-Atom zwischen zwei Methyl-Gruppen.
5. Nachweis der OH-Gruppe
Eine OH-Gruppe kann man mit einem einfachen Versuch nachweisen. Dazu benötigt man die Komplexverbindung Ammoniumcer(IV)-nitrat mit der Summenformel (NH4)2[Ce(NO3)6] und der folgenden Struktur:
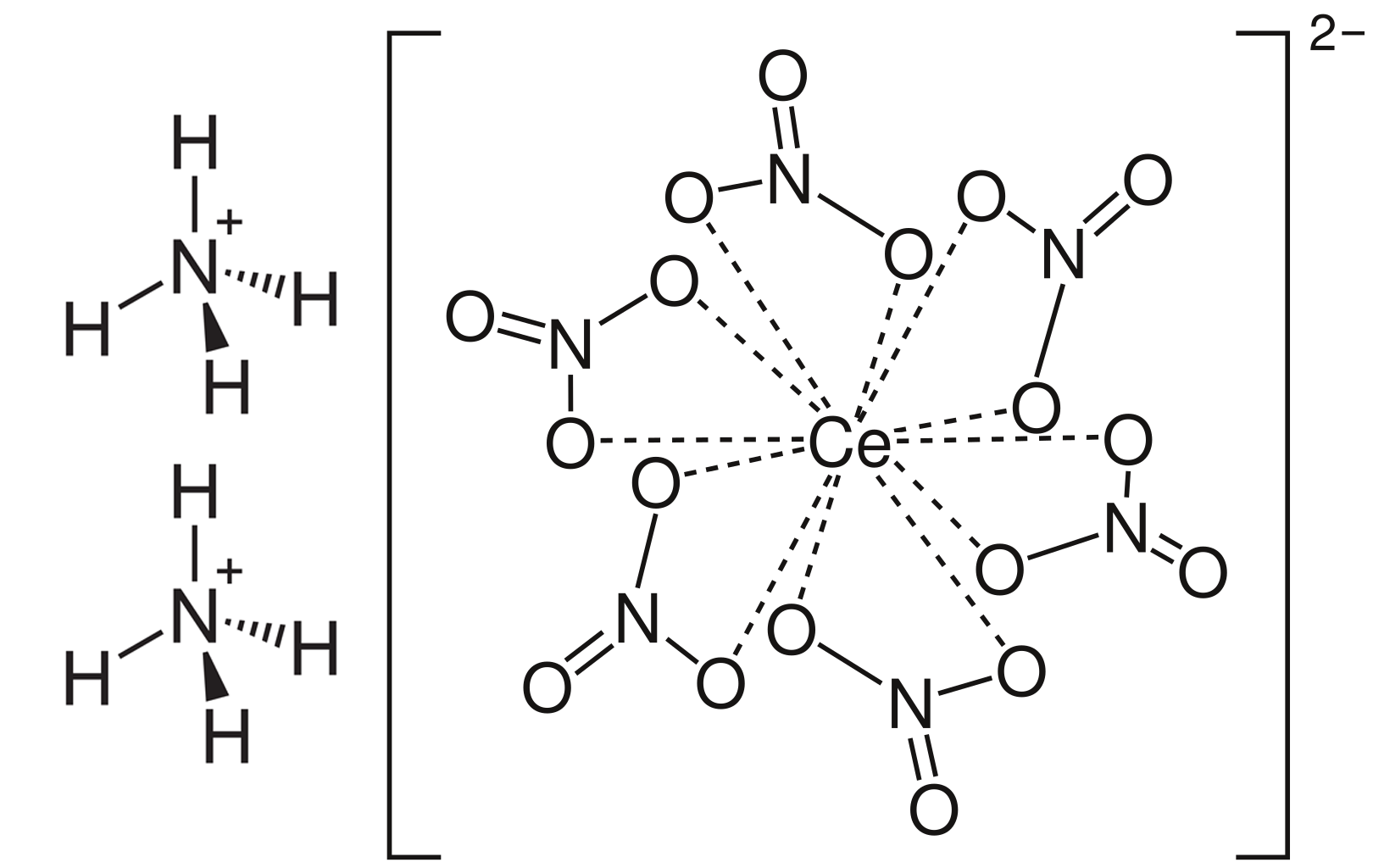
Ammoniumcer(IV)nitrat
Leyo, Public domain, via Wikimedia Commons
Auf den ersten Blick sieht man die komplexe Struktur dieser Verbindung. Wichtig ist hier das zentrale Cer-Atom, das von sechs Nitrat-Gruppen umgeben ist. Der ganze Komplex ist zweifach negativ geladen und tritt immer zusammen mit zwei Ammonium-Gruppen NH4+ auf, so dass die Gesamtverbindung elektrisch neutral ist.
Wenn man diese Komplexverbindung nun mit Ethanol zusammenbringt, so wird ein Teil der Nitrat-Gruppen um das Cer-Kation durch Ethanol-Moleküle ersetzt. Dabei ändert der Komplex seine Farbe von einem hellen Orange zu einem dunklen Rot.
Gibt man also eine Lösung dieses Komplexes in ein Reagenzglas mit Ethanol, so stellt sich eine dunkelrote Farbe ein. Ein Kontrollversuch mit Wasser liefert dagegen nur eine hellorange Färbung. Auch mit anderen Verbindungen, die OH-Gruppen enthalten, liefert das Nachweismittel Ammoniumcer(IV)nitrat eine dunkelrote Färbung.
Auf dieser Seite wird der Versuch genauer beschrieben.
Das Ethanol-Molekül
Nach diesen vielen qualitativen und quantitativen Analysen können wir nun endlich das Ethanol-Molekül darstellen. Hier eine Computersimulation des Moleküls:
Ein Molekülmodell des Ethanols
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Ethanol ist im Prinzip Ethan, bei dem ein H-Atom durch eine OH-Gruppe ersetzt wurde.
Diese OH-Gruppe hat nun aber wichtige Auswirkungen auf das physikalische und chemische Verhalten der Verbindung.
Ethanol ist beispielsweise unbegrenzt in Wasser löslich, während die Stammverbindung Ethan völlig unlöslich in Wasser ist. Die OH-Gruppe verleiht dem Ethanol also völlig neue Funktionen, daher werden solche Atomgruppierungen wie die OH-Gruppe auch als funktionelle Gruppen bezeichnet.
Die funktionelle Gruppe der Alkohole ist die Hydroxy-Gruppe bzw. die OH-Gruppe.
Nachweis der OH-Gruppe - zweiter Versuch
Auf den Versuch mit dem Ammoniumcer-nitrat hätte man im Prinzip auch verzichten können, wenn man sich die physikalischen Eigenschaften des Ethanols anschaut. Wir hatten ja zwei Möglichkeiten vorgeschlagen für die Verbindung mit der Summenformel (und Verhältnisformel) C2H6O:
- Möglichkeit 1: H3C-CH2-OH
- Möglichkeit 2: H3C-O-CH3
Es gibt in der Tat beide Verbindungen. Bei der ersten handelt es sich um Ethanol, wie wir schon wissen. Die zweite Verbindung existiert ebenfalls, es ist der Dimethylether.
Dimethylether siedet bei -24,8 ºC, während Ethanol einen Siedepunkt von +78,3 ºC hat. Das ist schon ein erheblicher Unterschied, und die Ursache für die hohe Siedetemperatur des Ethanols ist natürlich die OH-Gruppe.
Aufgabe 2
Begründen Sie, wieso man aus diesen unterschiedlichen Siedetemperaturen darauf schließen kann, dass Ethanol-Moleküle OH-Gruppen besitzen.
Eine Lösung der Aufgabe finden Sie hier.
Diese Aufgabe wollen wir hier einmal zusammen lösen. Sie können es ja gern erst einmal selbst versuchen, bevor Sie hier weiterlesen.
Lösungsvorschlag
Moleküle mit OH-Gruppen wie Wasser, Ethanol und andere Alkohole können untereinander Wasserstoffbrücken-Bindungen eingehen. Solche H-Brücken gehören zu den intermolekularen Wechselwirkungen. Das H-Atom des einen Moleküls setzt sich an das O-Atom eines anderen Moleküls. Diese Bindung ist zwar nicht so stark wie eine richtige kovalente Bindung, aber viel stärker als die schwachen van-der-Waals-Bindungen, den intermolekularen Wechselwirkungen zwischen Alkan-Molekülen.
Die Moleküle des Dimethylethers können dagegen keine H-Brücken untereinander bilden. Zwar ist ein O-Atom vorhanden, das als H-Brücken-Akzeptor wirken könnte, aber es sind keine H-Brücken-Donatoren da.
H-Brücken-Donatoren sind H-Atome, die an einen elektronegativen Atom wie N oder O sitzen. Die H-Atome des Ethers befinden sich ausnahmslos an C-Atomen, und H-Atome, die an C-Atomen sitzen, können keine H-Brücken bilden.
Allein aus diesem Vergleich der Siedetemperaturen von Ethanol und Dimethylether kann man also einwandfrei schließen, dass das Ethanol-Molekül eine OH-Gruppe besitzen muss.
Letzter Versuch: Untersuchung der OH-Gruppe
Nun könnte vielleicht jemand meinen, die OH-Gruppe des Ethanols wäre so aufgebaut wie die OH-Gruppe von Natronlauge NaOH. In der Natronlauge liegt die OH-Gruppe nicht als Hydroxy-Gruppe vor, sondern als Hydroxid-Ion OH-.
Mit einem sehr einfachen Versuch kann man nun beweisen, dass Ethanol keine Hydroxid-Ionen besitzt, sondern Hydroxy-Gruppen, bei denen das O-Atom kovalent an ein C-Atom gebunden ist.
Dazu versetzt man ein Reagenzglas mit Natronlauge NaOH und ein Reagenzglas mit Ethanol einfach mit Universalindikator. Bei der Natronlauge färbt sich dieser sofort tiefblau, womit also OH--Gruppen nachgewiesen wären. Beim Ethanol tritt keine nennenswerte Farbveränderung auf. Daraus kann man schließen, dass Ethanol weder Hydroxid-Gruppen OH- noch Protonen H+ besitzt. Protonen würden den Indikator sofort rot färben.