Aufgabe 1
Pentan-1-ol hat eine Siedetemperatur von 138 ºC, Pentan-3-ol dagegen siedet bei 116,1 ºC. Finden Sie eine Erklärung für diesen Unterschied.
Durch das Sauerstoff-Atom ist eine OH-Gruppe relativ groß. Pentan-1-ol ist ein langgestrecktes Molekül mit einer großen OH-Gruppe am Anfang (bzw. am Ende, je nach Standpunkt). Pentan-3-ol hat dagegen die große OH-Gruppe in der Mitte des Moleküls. Die Verbindung hat also eher kompaktere und nicht so langgestreckte Moleküle wie Pentan-1-ol. Daher sind die Kontaktflächen zwischen den Pentanol-3-Molekülen kleiner als die zwischen den Pentanol-1-Molekülen, und entsprechend sind die van-der-Waals-Kräfte (bzw. London-Kräfte) hier geringer, was die niedrigeren Siedetemperaturen erklärt.
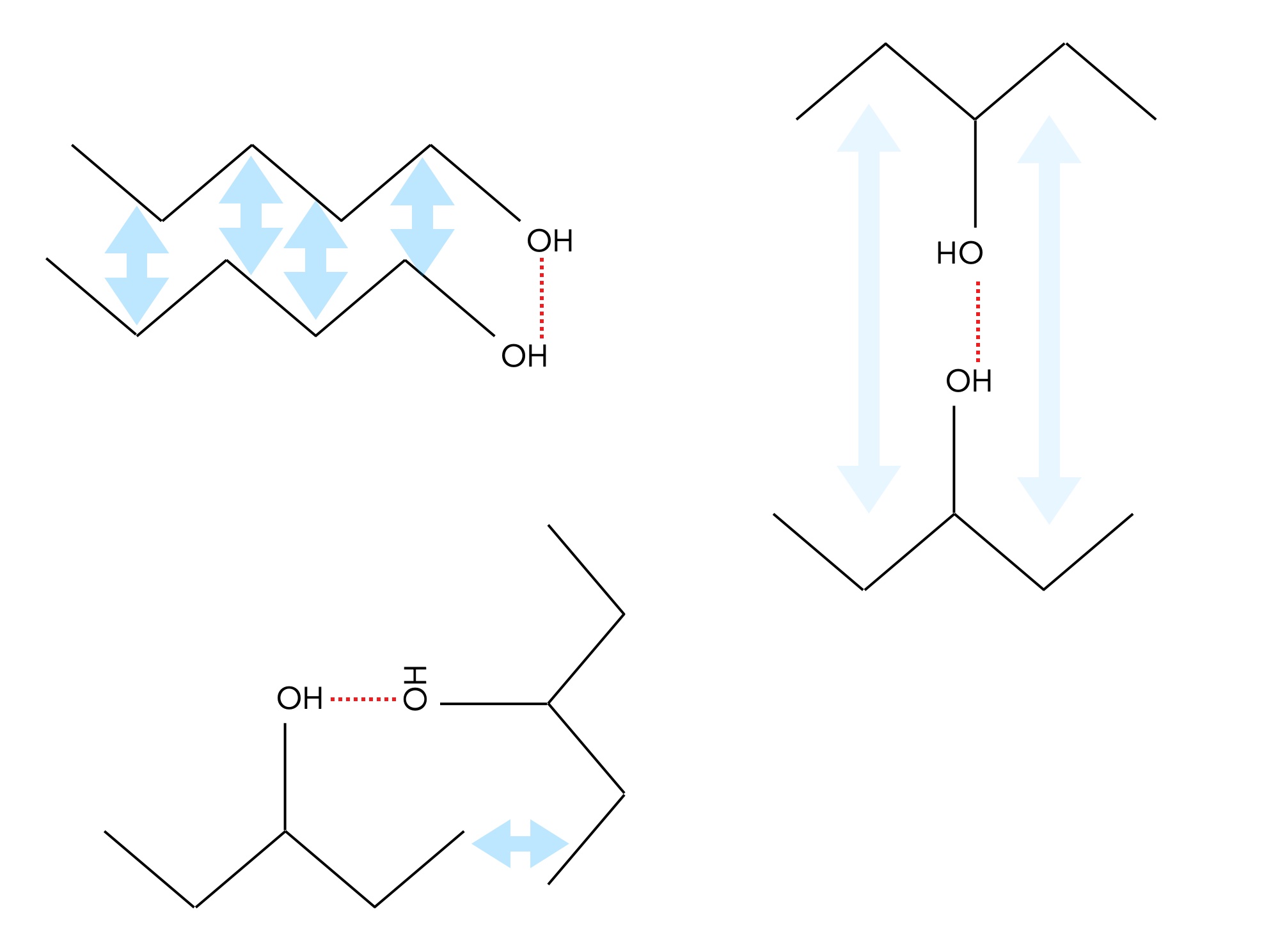
Kontaktflächen bei Pentanol-Isomeren
Autor: Ulrich Helmich 12/2024, Lizenz: Public domain
Dieses Bild zeigt die Kontaktflächen zwischen zwei Pentanol-Molekülen. Wegen der Fähigkeit zur Bildung von H-Brücken orientieren sich die Moleküle so, dass sie leicht solche H-Brücken bilden können.
Im Fall von Pentan-1-ol können H-Brücken und starke London-Kräfte zwischen zwei Molekülen gebildet werden (durch die blauen Pfeile im Bild angedeutet).
Im Fall von Pentan-3-ol können zwar H-Brücken gebildet werden, aber die Moleküle müssen sich dabei so drehen, dass die Kontaktflächen sehr klein sein. Entsprechend gering sind dann die London-Kräfte.