In den meisten Schulbüchern für die Stufe EF werden die Siedetemperaturen der Alkanole sehr ausführlich behandelt. Grund genug, in dieser Abteilung der EF-Seiten eine eigene Vertiefungsseite zu diesem wichtigen Thema anzulegen. Übrigens sind die Seiten zu den physikalischen Eigenschaften der Alkohole die am meisten aufgerufenen Seiten dieser Homepage!
Vergleicht man die Siedetemperaturen von Alkanolen mit denen der entsprechenden Alkane, so stellt man fest, dass diese von Alkanen abgeleiteten Alkohole bei viel höheren Temperaturen sieden. Zum Beispiel siedet n-Hexan bei 69 ºC, während Hexan-1-ol eine Siedetemperatur von 157 ºC hat.
Zum besseren Verständnis zeigt die folgende Tabelle die Siedetemperatur der ersten zehn Alkanole:
| Alkohol | Siedetemperatur |
|---|---|
| Methanol | 64,7 |
| Ethanol | 78,3 |
| Propan-1-ol | 97,2 |
| Butan-1-ol | 117,3 |
| Pentan-1-ol | 138,0 |
| Hexan-1-ol | 157,5 |
| Heptan-1-ol | 176,0 |
| Octan-1-ol | 194,5 |
| Nonan-1-ol | 215,0 |
| Decan-1-ol | 228,0 |
Wir wollen diese Siedetemperaturen nun einmal graphisch darstellen:
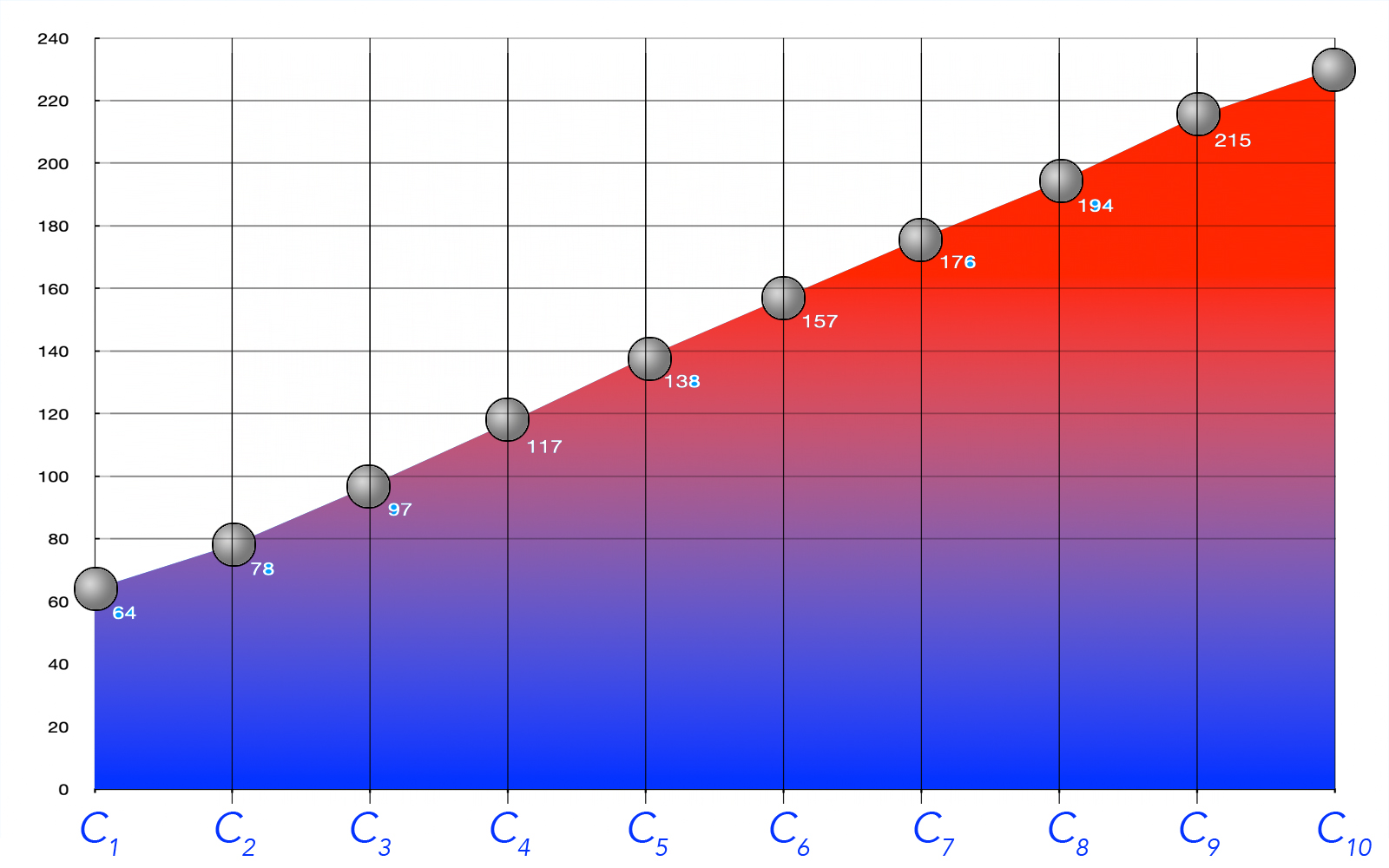
Siedepunkte der ersten 10 Alkanole
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Wenn wir den Verlauf dieser Siedetemperaturen analysieren, stellen sich gleich zwei wichtige Fragen:
- Wieso haben die Alkanole so hohe Siedetemperaturen im Vergleich zu den Alkanen?
- Wieso steigen die Siedetemperaturen der Alkanole mit steigender Kettenlänge kontinuierlich an?
Alkanole haben relativ hohe Siedetemperaturen
Beantworten wir zunächst die erste Frage. Wie kann man die allgemein hohen Siedetemperaturen der Alkohole erklären? Welche strukturellen Merkmale der Alkanole sind für diese Eigenschaft verantwortlich?
Hier ein konkretes Beispiel: Der Siedepunkt von Ethanol beträgt 78 ºC, der von Ethan -89 ºC.
Ethanol unterscheidet sich vom Ethan nur durch das zusätzliche Sauerstoff-Atom in der OH-Gruppe. Offensichtlich muss dieses O-Atom die Ursache für den 167 ºC höheren Siedepunkt des Ethanols sein.
Aber ganz so einfach ist die Sache nicht, wie folgende Tatsache zeigt. Die Verbindung Dimethylether H3C-O-CH3 hat die gleiche Summenformel wie Ethanol, ist also auch ein Ethan mit einem zusätzlichen Sauerstoff-Atom. Diemethylether hat aber einen Siedepunkt von nur -24 ºC.
Also kann das Sauerstoff-Atom des Ethanols nicht die Hauptursache für den stark erhöhten Siedepunkt sein.
Kommen wir noch einmal auf den Ether zurück. Dieser hat einen deutlich höheren Siedepunkt als das Alkan Ethan. Ursache hierfür kann ebenfalls nur das O-Atom sein. Das O-Atom ist stark elektronegativ, zieht daher die Elektronen der C-O-Bindungen näher an sich heran. Daher ist dieses O-Atom leicht negativ geladen, trägt eine negative Teilladung, wie man sagt. Die beiden benachbarten C-Atome tragen dagegen eine positive Teilladung, weil ihre Elektronendichte jetzt geringer ist. Aus diesem Grund sind die Ether-Moleküle Dipole, haben also einen negativen Pol (das O-Atom) und zwei positive Pole (die C-Atome). Dipole ziehen sich aber gegenseitig an, nicht sehr stark, aber so stark, dass der Siedepunkt des Ethers deutlich höher ist als der des Alkans.
Auch die Ethanol-Moleküle sind Dipole, weil sie ein elektronegatives O-Atom besitzen, das Elektronendichte zu sich heran und von dem C-Atom und dem H-Atom weg zieht. Also sollte auch Ethanol einen Siedepunkt von um die 20 bis 30 ºC haben. Ethanol hat aber eine Siedetemperatur von knapp 80 ºC.
Die Ursache hierfür ist das unscheinbar kleine H-Atom, das an dem O-Atom sitzt. Ein H-Atom, das an einem elektronegativen Atom wie Sauerstoff oder Stickstoff sitzt, kann Wasserstoffbrücken-Bindungen mit O- oder N-Atomen anderer Moleküle eingehen (kurz H-Brücken).
Zwei Ethanol-Moleküle können also H-Brücken untereinander ausbilden, und diese H-Brücken sind wesentlich stärker als die schwachen Dipol-Dipol-Bindungen, die zwischen Ether-Molekülen bestehen.
Der eigentliche Grund für die relative Höhe der Siedetemperaturen bei den Alkoholen ist also die Fähigkeit der Moleküle, untereinander starke intermolekulare Bindungen einzugehen, die sogenannten H-Brücken.
Alles zum Thema H-Brücken finden Sie auf dieser Lexikon-Seite. Wahrscheinlich mehr, als Sie verkraften können!
Die Siedetemperatur steigt mit der Kettenlänge
Ein Alkanol wie Heptan-1-ol besitzt zwar eine OH-Gruppe, die in der Lage ist, H-Brücken mit den OH-Gruppen anderer Moleküle auszubilden. Andererseits hat Heptan-1-ol eine aus sieben C-Atomen bestehende Kohlenstoffkette - ähnlich wie das Alkan Heptan.
Die Moleküle der Alkane werden durch die relativ schwachen van-der-Waals-Kräfte zusammengehalten. Je länger diese Moleküle sind, desto größer sind die Kontaktflächen, mit denen sich die Moleküle berühren. Und die van-der-Waals-Kräfte (genauer gesagt: die London-Kräfte) wirken über die Oberfläche der Moleküle. Je größer die Kontaktfläche zwischen zwei Molekülen, desto stärker die van-der-Waals-Kräfte. Und damit steigen auch die Siedetemperaturen der Alkohole mit der Zahl der C-Atome des Alkohols.
Diese schwachen intermolekularen Anziehungskräfte ignoriert man bei Alkoholen, Aldehyden, Ketonen oder Carbonsäuren oft, sie sind aber die Ursache dafür, dass die Siedepunkte dieser Sauerstoff-Verbindungen mit zunehmender Kettenlänge ansteigen.
Der Begriff "van-der-Waals-Kraft" wird in der Schule oft falsch verwendet. Auf dieser Lexikon-Seite finden Sie eine genauere Darstellung der drei intermolekularen Wechselwirkungen, die unter dem Oberbegriff "van-der-Waals-Kraft" zusammengefasst werden: London-, Debye- und Keesom-Kraft.
Die Siedetemperatur hängt von weiteren Faktoren ab
Die Stellung der OH-Gruppe
| Alkanol | Siedetemperatur in ºC |
| Propan-1-ol | 97,2 |
| Propan-2-ol | 82,3 |
| Butan-1-ol | 117,3 |
| Butan-2-ol | 99,5 |
| Pentan-1-ol | 138,0 |
| Pentan-2-ol | 118,9 |
| Pentan-3-ol | 116,1 |

Abhängigkeit der Siedetemperatur von der Struktur des Alkohol-Moleküls
Autor: Ulrich Helmich 1/2025, Lizenz: Public domain.
Auf diesem Bild sehen wir, welchen Einfluss die Stellung der OH-Gruppe auf den Siedepunkt eines Alkohols hat; besonders gut ist das bei den drei Pentanolen erkennbar. Die Zeichnung oben liefert die Erklärung dafür. Links sehen wir zwei Pentan-1-ol-Moleküle, rechts zwei Pentan-3-ol-Moleküle.
Die roten Doppelpfeile deuten die starken H-Brücken an, die sich zwischen den OH-Gruppen der beiden Moleküle bilden, die beigen Doppelpfeile sollen die van-der-Waals-Kräfte verdeutlichen, die zwischen den C-Ketten der Moleküle herrschen.
Die beiden Pentan-1-ol-Molekülen können sich so anordnen, dass eine große Kontaktfläche entsteht, so dass starke Van-der-Waals-Kräfte herrschen, welche die H-Brücke zwischen den Molekülen unterstützen.
Da H-Brücken stärker und damit energetisch günstiger sind als Van-der-Waals-Kräfte, ordnen sich die beiden Pentan-3-ol-Moleküle höchstwahrscheinlich so an, wie im Bild rechts gezeigt, damit sie eine H-Brücke bilden können. Dadurch rücken die Kohlenstoff-Ketten der Pentanole jedoch weiter auseinander als bei Pentan-1-ol. Die London-Kräfte sind also deutlich schwächer als bei den Pentan-1-ol-Molekülen, und damit ist auch die Gesamtstärke der intermolekularen Anziehungskraft geringer. Die Folge ist ein niedrigerer Siedepunkt.
Die Zahl der OH-Gruppen
Schauen wir uns nun die folgende Tabelle an. Sie verdeutlicht den vierten Faktor, der die Siedetemperatur eines Alkanols bestimmt.
| Alkohol | Siedetemperatur |
|---|---|
| Methanol | 64,7 |
| Ethanol | 78,3 |
| Ethan-1,2-diol | 197,2 |
| Propan-1-ol | 97,2 |
| Propan-1,2-diol | 188,0 |
| Propan-1,3-diol | 215,0 |
| Propan-1,2,3-triol | 290 |
Die Zahl der OH-Gruppen spielt eine entscheidende Rolle! Je mehr OH-Gruppen, desto höher der Siedepunkt. Die Ursache hierfür sind wieder einmal die Wasserstoffbrückenbindungen, die zwischen den OH-Gruppen der Moleküle bestehen. Je mehr OH-Gruppen, desto mehr H-Brücken können sich zwischen den Molekülen bilden, und desto höher der Siedepunkt!
Beispiel Hexanol und Glucose
Beide Moleküle besitzen sechs C-Atome, Hexan-1-ol hat aber nur eine OH-Gruppe, Glucose deren sechs. Der Siedepunkt von Hexan-1-ol liegt bei 157,5 ºC, Glucose (Traubenzucker) hat keinen Siedepunkt, weil sich die Verbindung vorher schon chemisch zersetzt. Bei 145 ºC ist wasserfreie Glucose immer noch fest, sie schmilzt bei 146 ºC. Hexan-1-ol ist bei dieser Temperatur schon kurz vor dem Sieden.
Merke:
Siedetemperaturen der Alkanole
Der Siedepunkt eines Alkohols hängt von vier Faktoren ab:
- H-Brücken: Generell haben Alkanole einen deutlich höheren Siedepunkt als die entsprechenden Alkane. Ursache hierfür sind die H-Brücken zwischen den Alkanol-Molekülen.
- Länge des Alkylrestes: Je länger der Alkylrest, desto stärker die van-der-Waals-Kräfte zwischen den Molekülen und desto höher die Siedetemperatur.
- Stellung der OH-Gruppe(n) im Molekül: Je langgestreckter das Molekül, desto größer die van-der-Waals-Kontaktfläche und desto höher der Siedepunkt; je "kugelförmiger" des Molekül, desto niedriger der Siedepunkt.
- Anzahl der OH-Gruppen: Je mehr OH-Gruppen im Molekül, desto höher der Siedepunkt.