Unter diesem Fachbegriff versteht man das "Verschieben" von Elektronen zu einem anderen Atom hin (= positiver induktiver Effekt oder +I-Effekt), oder das "Abziehen" von Elektronen von einem andern Atom her (= negativer induktiver Effekt oder -I-Effekt).
Der -I-Effekt ist elektronenziehend
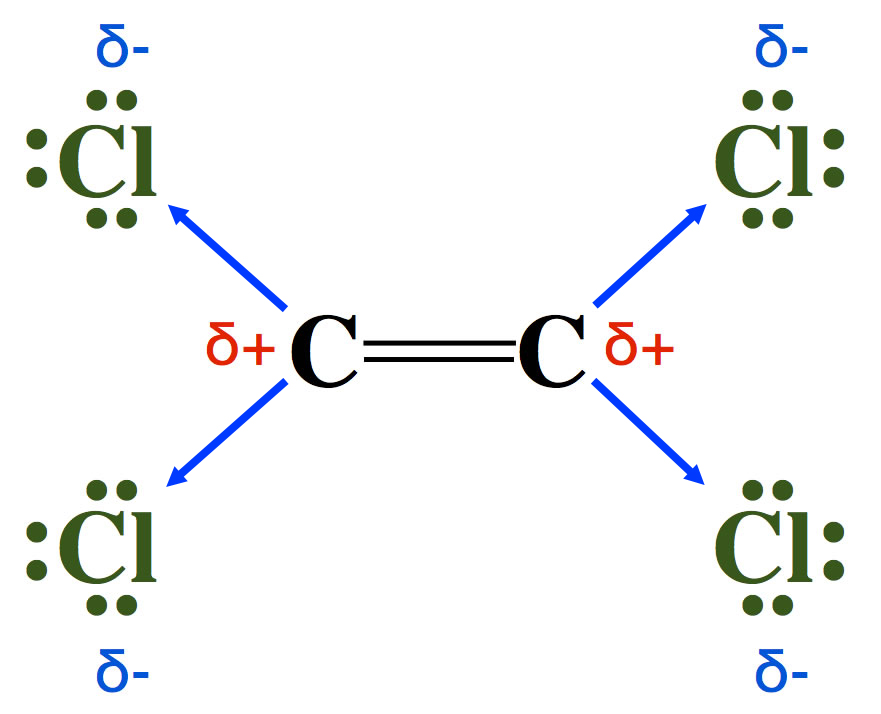
Das Tetrachlor-ethen-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain
Das Tetrachlor-ethen-Molekül ist ein gutes Beispiel für den -I-Effekt. Die Chlor-Atome haben aufgrund ihrer hohen Elektronegativität die Tendenz, Bindungselektronen zu sich zu ziehen. Dadurch verringert sich die Elektronendichte an der Doppelbindung. Die Folge ist eine Herabsetzung der Reaktivität der Doppelbindung, eine Elektrophile Addition würde zum Beispiel langsamer verlaufen als am Ethen-Molekül. Auch bei der Elektrophilen Substitution am Benzolring macht sich ein solcher -I-Effekt bemerkbar; auch hier wird die Dichte der pi-Elektronen verringert, und der Benzolring wird dadurch weniger reaktiv.
Auch positiv geladene Seitengruppen wie -NH3+ können einen -I-Effekt ausüben.
Der +I-Effekt ist elektronenschiebend
Auch Kohlenstoff kann einen -I-Effekt ausüben, wenn er mit einem Atom verbunden ist, das eine noch geringere Elektronegativität aufweist als Kohlenstoff. Aus der Sicht dieses anderen Atoms hat der Kohlenstoff dann einen +I-Effekt, also einen elektronenschiebenden Effekt.
Beispiel: Wasserstoff hat eine EN von 2,2 und Kohlenstoff eine EN von 2,55. Kohlenstoff ist also elektronegativer als Wasserstoff. Im Methan-Molekül zieht also das Kohlenstoff-Atom Elektronendichte von den Wasserstoff-Atomen ab. Das C-Atom übt einen -I-Effekt auf die H-Atome aus. Umgekehrt könnte man sagen, dass die H-Atome einen +I-Effekt auf das C-Atom ausüben.
Substituenten mit einer niedrigen Elektronegativität als Kohlenstoff üben einen +I-Effekt auf ein C-Atom aus, weil das C-Atom die Elektronen der gemeinsamen Bindung aufgrund seiner höheren Elektronegativität zu sich zieht.
Betrachten wir das folgende Molekül:
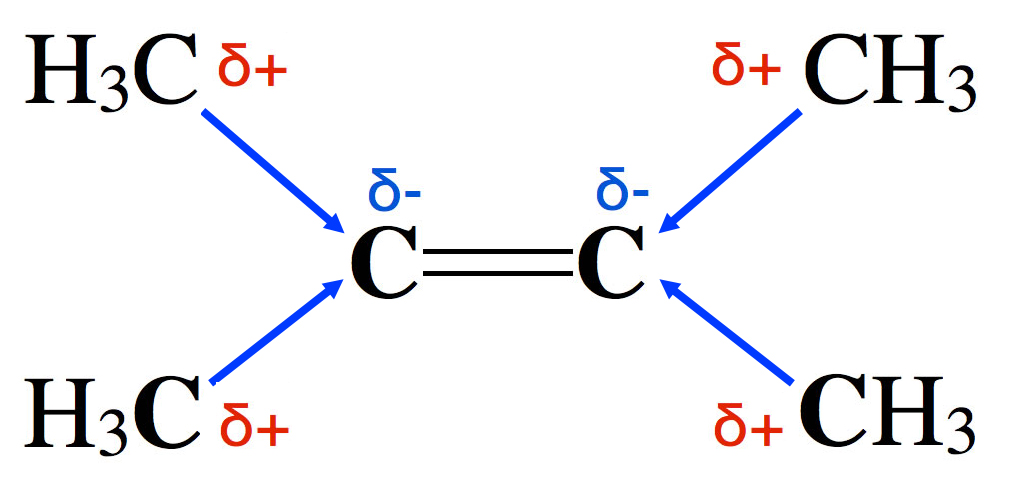
Das 2,3-Dimethyl-but-2-en-Molekül
Beim 2,3-Dimethyl-but-2-en können wir einen positiven induktiven Effekt beobachten, obwohl ja kein EN-Unterschied zwischen den sechs C-Atomen besteht.
Eine einfache Erklärung für diesen unerwarteten +I-Effekt ist das "Weiterreichen" des +I-Effektes, den die H-Atome auf die C-Atome der Methyl-Gruppen ausüben. In der Tat kann ein induktiver Effekt über eine Kette von Atomen weitergereicht werden. Dabei nimmt allerdings die Stärke des induktiven Effektes mit dem Quadrat der Entfernung ab.
Eine anspruchsvollere Erklärung für den positiven Induktiven Effekt ist die Hyperkonjugation.
Negativ geladene Seitengruppen wie -COO- können ebenfalls einen +I-Effekt ausüben, was relativ leicht zu erklären ist. Die hohe Elektronendichte, bedingt durch die negative Ladung, "schwappt" sozusagen auf die benachbarten Atome über.
Übersicht: Induktive Effekte
In der Wikipedia findet man folgende Aufstellung von +I- und -I-Effekten:
+I-Effekt
- alle Alkyl-Gruppen
- alle negativ geladenen Gruppen
-I-Effekt
- Carbonyl-Gruppe -C=O
- Hydroxy-Gruppe -OH
- Halogen-Atome -I, -Br, -Cl, -F
- Nitro-Gruppe -NO2
- Amino-Gruppe -NH2
- Carboxy-Gruppe -COOH
- Cyano-Gruppe -CN
- alle positiv geladenen Gruppen
Laut Römpp Chemie-Lexikon, wächst "das Vermögen, Elektronen anzuziehen" in dieser Reihenfolge:
(CH3)3C- < (CH3)2CH- < -C2H5 < -CH3 < -H < -C6H5 < -CH3O < -OH < -I < -Br < -Cl < -NO2 < -F