Unpolare und polare kovalente Bindungen
Unter dem Begriff Elektronegativität versteht man die Fähigkeit eines Atoms, die Elektronen einer kovalenten Bindung anzuziehen. Haben die beiden Atome einer kovalenten Bindung eine unterschiedliche Elektronegativität, dann ist die kovalente Bindung mehr oder weniger stark polarisiert.
Das Atom mit der größeren Elektronegativität zieht die Bindungselektronen stärker an als das Atom mit der geringeren Elektronegativität. Im zeitlichen Mittel halten sich die Bindungselektronen dann häufiger in der Nähe des elektronegativeren Atoms auf - die Elektronendichte ist hier messbar höher.
Der Bindungstyp hängt von der EN-Differenz ab
Je größer die EN-Differenz zwischen den beiden Atomen, desto stärker ist die Bindung polarisiert.
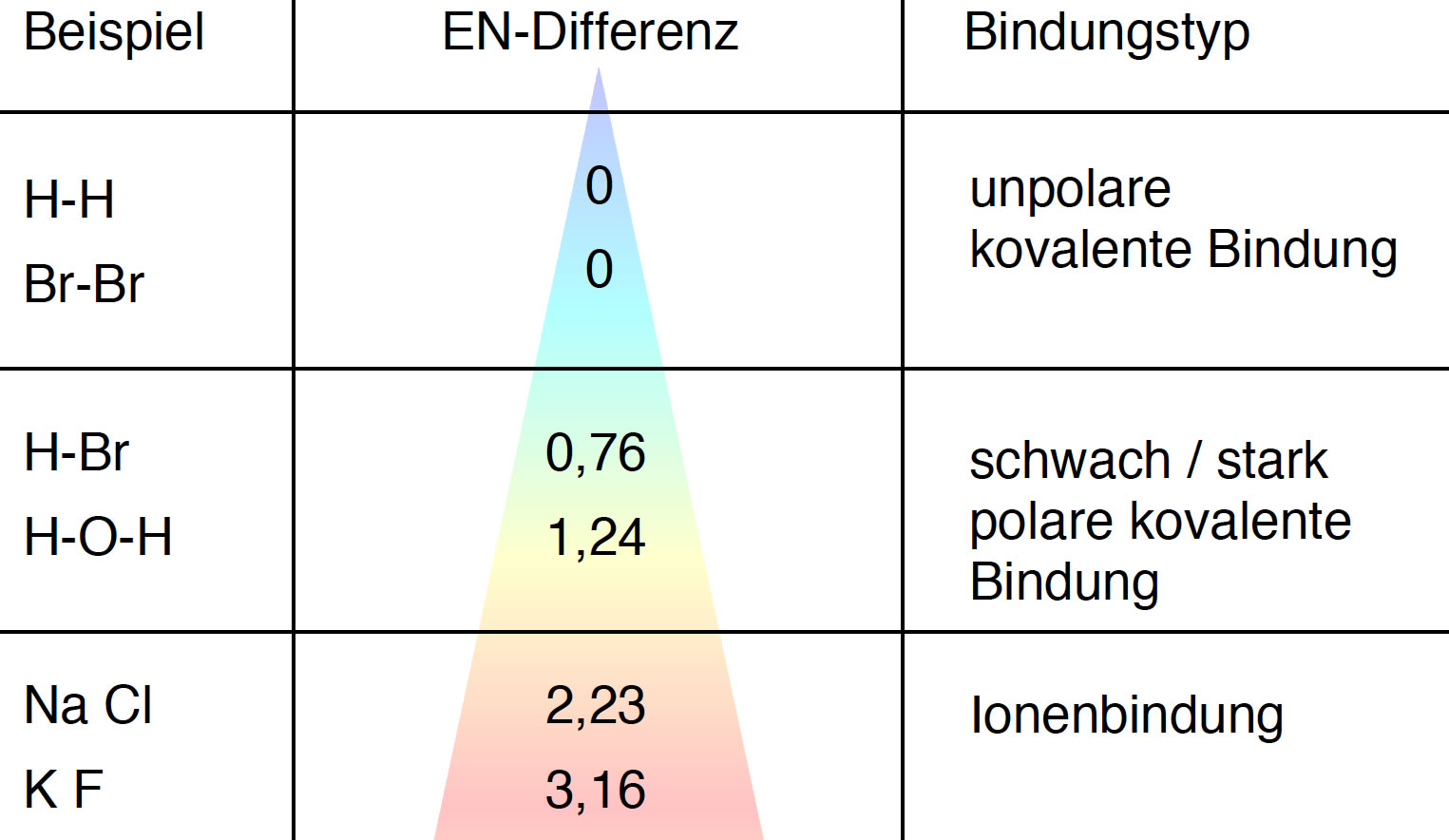
Abhängigkeit der chemischen Bindung von dem EN-Unterschied der Atome
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Wenn der EN-Unterschied zu groß ist (> 2,2), dann gibt es keine kovalente Bindung mehr zwischen den Atomen, sondern eine Ionenbindung. Das elektronegativere Element (beispielsweise Chlor) zieht dann sämtliche Bindungselektronen komplett in seine Außenhülle, während das elektropositivere Element (zum Beispiel Natrium) seine Außenelektronen komplett abgibt.
Verschiedene EN-Skalen
Es gibt verschiedene Skalen, nach denen die Elektronegativität der Elemente bzw. deren Atome eingeteilt wird, am bekanntesten sind die Allred-Rochow-Skala, nach der Fluor eine EN von 4,71 hat, die Milliken-Skala mit einer Fluor-EN von 4,42 und die Pauling-Skala mit einer Fluor-EN von 3,98. In dem entsprechenden Wikipedia-Artikel sind diese drei Skalen detailliert beschrieben.
In den meisten Büchern zur organischen Chemie orientiert man sich an der Pauling-Skala von 1932.
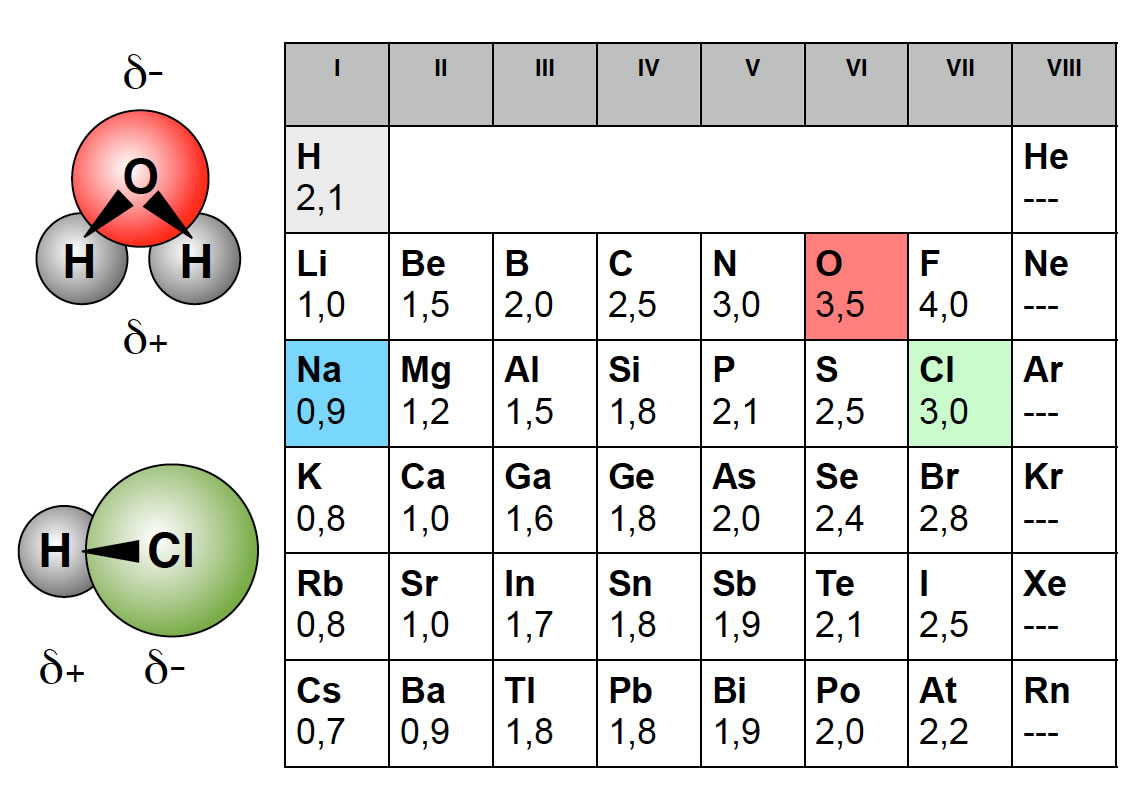
Tabelle: EN-Werte der Hauptgruppen-Elemente, Werte nach [2].
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Hier die für die organische Chemie wichtigsten Werte nach [1] bzw. [2]:
- Kohlenstoff 2,55 (2,5)
- Wasserstoff 2,20 (2,1)
- Sauerstoff 3,44 (3,5)
- Stickstoff 3,04 (3,0)
- Chlor 3,16 (3,0)
- Brom 2,96 (2,8)
EN und Oxidationszahl
Die Elektronegativität spielt auch eine wichtige Rolle bei der Bestimmung der Oxidationszahl eines Atoms in einer Verbindung. Die beiden Bindungselektronen werden immer dem Atom mit der höheren Elektronegativität zugeschlagen.
EN und chemisches Verhalten
Auch das chemische Verhalten von organischen Verbindungen wird durch die Elektronegativität der an den Bindungen beteiligten Atome bestimmt.

Folgen unterschiedlicher Elektronegativität für die Carbonyl-Gruppe
Autor: Ulrich Helmich 2016, Lizenz: Public domain
Auf diesem Bild sehen wir die Carbonyl-Gruppe -C=O. Das O-Atom hat eine höhere Elektronegativität als das C-Atom, daher ist die C=O-Bindung polarisiert, das C-Atom ist leicht positiv geladen und wird daher leicht von Nucleophilen angegriffen, während das O-Atom leicht negativ geladen ist und somit leicht von Elektrophilen angegriffen werden kann.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Spektrum Lexikon der Chemie, 1998