Entdeckung
Das Gas Chlor wurde 1774 von Carl Wilhelm Scheele entdeckt, als er Braunstein MnO2 mit konz. Salzsäure beträufelte. Im Grunde führt man diesen Versuch heute noch im Chemie-Unterricht durch, wenn man Chlor im Gasentwicklungsapparat aus Kaliumpermanganat und konz. Salzsäure herstellt.
Interessanterweise erkannte Scheele nicht, dass Chlor ein Element ist. Er hielt es für eine Sauerstoffverbindung der Salzsäure.
Erst Humpry David erkannt 1808, dass Chlor ein Element ist. Er hatte mehrmals versuch, den Sauerstoff aus der "Sauerstoffverbindung" Chlor abzuspalten, was ihm natürlich nicht gelang. DAVY gab dem Element auch den Namen "Chlor", das kommt aus dem griechischen chloros und bedeutet so viel wie "hellgrün".
Vorkommen
Das sehr reaktive Halogen kommt als freies Element so gut wie nicht vor. Lediglich in Vulkangasen oder in der Ozonschicht findet man elementares Chlor, allerdings auch nur in geringen Mengen.
In gebundener Form findet es sich dagegen in vielen Salzen, vor allem in den Chloriden. Das wichtigste Chlorid ist wohl das Steinsalz (Kochsalz, Natriumchlorid). Die Steinsalzlager enthalten neben NaCl vor allem KCl und MgCl2. Am Aufbau der Erdkruste ist Chlor mit 0,19% beteiligt, damit liegt Chlor an 19. Stelle der Elementhäufigkeiten. Auch das Meerwasser enthält Natriumchlorid, Kaliumchlorid und andere Chloride, insgesamt ca. 3%.
Darstellung
Im Labor wird Chlor durch Reaktion von Kaliumpermanganat mit konz. Salzsäure gewonnen, alternativ kann man auch Mangan(IV)-oxid mit konz. Salzsäure reagieren lassen.
Die Reaktion von Kaliumpermanganat läuft nach folgender Gleichung ab:
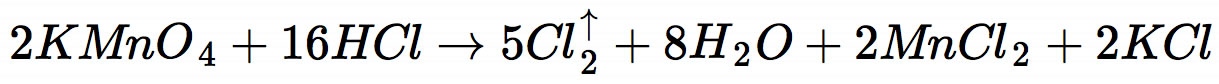
Dabei handelt es sich um eine Redoxreaktion, bei der das Permanganat-Ion reduziert und das Chlorid-Ion der Salzsäure oxidiert wird.
Herstellung
In der Industrie wird Chlor durch Chloralkali-Elektrolyse hergestellt. Dabei wird entweder eine NaCl-Lösung oder eine NaCl-Schmelze elektrolysiert. 2006 wurden auf der Erde fast 60 Millionen Tonnen Chlor hergestellt.
Früher wurde Chlor auch nach dem Deacon-Verfahren synthetisiert; heute wird dies nur noch in geringem Umfang praktiziert. Bei dem Deacon-Verfahren wird Chlorwasserstoff HCl durch Luftsauerstoff in Gegenwart eines Katalysators oxidiert:

Als Katalysator wird gern Kupferchlorid verwendet.
Eigenschaften
physikalische Eigenschaften
Chlor ist ein gelbgrünes Gas von stechendem Geruch nach "Schwimmbad". Bei längerem Einatmen kann es zu schweren Verätzungen und schließlich zum Tod führen. Kühlt man Chlorgas auf -34,6 ºC ab, kondensiert es zu einer gelben Flüssigkeit. Kühlt man weiter auf -101 ºC ab, entsteht ein gelbgrüner Feststoff. Chlor ist sehr gut in Wasser löslich, in 1 Liter Wasser lösen sich bei Zimmertemperatur 2,3 Liter Chlorgas. Die Dichte von Chlor beträgt 3,2 g/l (bei 0 ºC), damit ist Chlorgas etwa 2,5 mal so schwer wie Luft. Unter Druck lässt sich Chlor leicht verflüssigen und kann dann in Stahlflaschen transportiert werden.
chemische Eigenschaften
Chlor ist extrem reaktiv, es reagiert mit den meisten Elementen und mit vielen Verbindungen, auch mit organischen Verbindungen.
Reaktion mit Metallen
Mit Metallen bildet Chlor in meist exothermen Reaktionen Salze, nämlich die Chloride. Je edler das Metall ist, desto weniger exotherm verläuft die Reaktion. Die Umsetzung mit Alkalimetallen und Erdalkalimetallen findet bereits bei Zimmertemperatur statt, edlere Metalle wie Kupfer oder Silber muss man mehr oder weniger stark erhitzen, damit sie mit Chlor reagieren. Feuchtes (wasserhaltiges) Chlor reagiert mit Metallen wesentlich heftiger als trockenes Chlor.
Bei der Reaktion bilden sich die entsprechenden Metallchloride. Metalle der Nebengruppen wie Eisen können auch mehrere verschiedene Chloride bilden, vom Eisen gibt es zum Beispiel das FeCl2 und das FeCl3.
Reaktion mit Nichtmetallen
Mit Wasserstoff bildet Chlor die starke Säure Chlorwasserstoff HCl, deren wässrige Lösung als Salzsäure bekannt ist. Auch diese Reaktion läuft extrem exotherm ab (Chlor-Knallgas-Reaktion). Mit anderen Nichtmetallen reagiert Chlor kaum oder gar nicht.
Reaktion mit organischen Verbindungen
Mit Alkanen und Alkylverbindungen reagiert Chlor in einer radikalischen Substitutionsreaktion zu Halogenalkanen; aus Methan und Chlor kann zum Beispiel Mono-, Di-, Tri- oder Tetrachlormethan hergestellt werden. Mit Alkenen und Alkinen findet eine elektrophile Addition statt, und mit Aromaten ist eine elektrophile Substitution möglich, wenn ein geeigneter Katalysator vorhanden ist.
Verwendung
Verwendung früher
Früher wurde Chlor hauptsächlich als Bleichmittel eingesetzt. Heute macht man das nicht mehr; selbst in der Industrie verwendet man zum Bleichen (Textilien, Papier etc.) andere Verfahren.
Berüchtigt ist die Verwendung von Chlor als Giftgas im ersten Weltkrieg. Wegen seiner hohen Dichte sammelte sich das Gas vor allem in den Schützengräben an und tötete viele gegnerische Soldaten. Manche Fachleute nehmen an, dass auch im Mai 2014 Chlor als Giftgas von Regierungstruppen in Syrien eingesetzt wurde (Fassbomben).
Verwendung heute
Chlor ist ein wichtiger Grundstoff (Grundchemikalie) der chemischen Industrie. Viele anorganische und organische Verbindungen werden unter Verwendung von Chlor hergestellt.
Wichtige anorganische Chlorverbindungen sind Hypochlorit, Chlorat, Chlordioxid, Dischwefeldichlorid. Wichtige organische Chlorverbindungen sind Tetrachlormethan, Chloroform und Monomere von chlorierten Kunststoffen, beispielsweise das Vinylchlorid, aus dem dann der Kunststoff PVC produziert wird. Vinylchlorid ist übrigens das wichtigste Chlorprodukt überhaupt, 1997 wurden 33% der weltweiten Chlorproduktion für die Herstellung von Vinylchlorid verwendet.
In Schwimmbädern oder auch bei der Trinkwasserbereitung wird Chlor als gut wasserlösliches Desinfektionsmittel eingesetzt.