 |
 |
||
| Brandfördernd | Gas unter Druck |
1. Einführung
Butan C4H10 ist das vierte Glied in der homologen Reihe der Alkane nach Methan, Ethan und Propan, gefolgt vom Pentan C5H12.
2. Strukturdaten

Die beiden Butan-Isomere n-Butan und Methylpropan
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Konstitutions-Isomerie
Hier sehen wir die beiden Butan-Isomere n-Butan und Methylpropan. Die Bindungswinkel und -längen entsprechen den Werten in den anderen Alkanen, also 109,5º für die tetraedrischen Winkel und ca. 109 pm für die C-H-Bindungen und 154 pm für die C-C-Einfachbindungen.
Neu beim Butan - wenn man es mit den vorhergehenden Gliedern der homologen Reihe der Alkane vergleicht - ist die Konstitutions-Isomerie, die hier zum ersten Mal auftritt. Es gibt zwei verschiedene Butan-Strukturen, nämlich das langkettige unverzweigte n-Butan und das verzweigte Methylpropan.
Beide Butan-Isomere unterscheiden sich in ihren physikalischen und chemischen Eigenschaften teils stark voneinander.
Konformationen
Ähnlich wie bei Ethan und Propan gibt es beliebig viele Konformationen beider Butan-Isomere. In der Fachliteratur werden aber meistens nur die relevanten Konformationen des n-Butans behandelt.
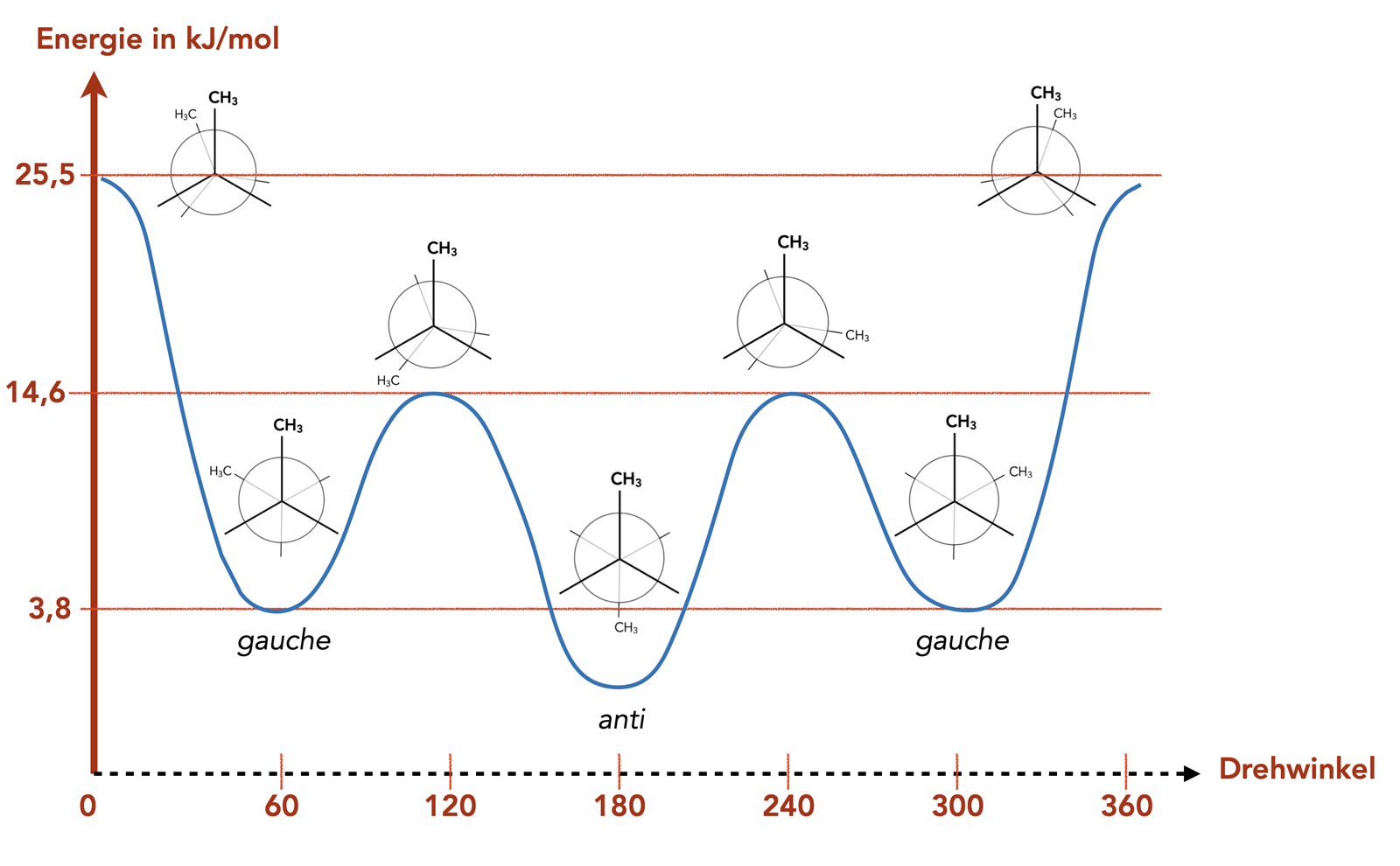
Der Energiegehalt der Butan-Konformationen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wie man sofort sieht, gibt es zwei verschiedene energetisch günstige gestaffelte Konformationen des n-Butans, die als gauche und anti bezeichnet werden. Und es existieren zwei verschiedene verdeckte Konformationen mit maximaler Energie, die aber keine besonderen Namen besitzen.
3. Physikalische Eigenschaften
Der Schmelzpunkte der beiden Butan-Isomere unterscheiden sich, ebenso wie die beiden Siedepunkte:
| Eigenschaft | n-Butan | Methylpropan |
| Schmelzpunkt | -138,3 ºC | -159,4 ºC |
| Siedepunkt | -0,5 ºC | -11,7 ºC |
| Dichte | 0,60 g/cm3 | 0,59 g/cm3 |
| Wasserlöslichkeit | 61 mg/l | 49 mg/l |
| Dipolmoment | 0,0 D | 0,123 D |
Auch bei den Dichten, Wasserlöslichkeiten und Dipolmomenten finden sich unterschiedliche Werte, wie die Tabelle zeigt.
Bei den intermolekularen Anziehungskräften dominieren die London-Kräfte, die stark von der Kontaktfläche zwischen den Molekülen abhängen. Je größer diese Kontaktfläche, desto stärke die London-Kräfte. Die n-Butan-Moleküle haben wegen ihrer langgestreckten Form eine größere Kontaktfläche, das erklärt dann die stärkeren London-Kräfte und dadurch auch den höheren Schmelzpunkt und Siedepunkt des n-Butans im Vergleich zum Methylpropan.
Obwohl das Methylpropan-Molekül völlig symmetrisch aufgebaut ist, wie man am besten an der Strichformel in Abb. 1 erkennt, ist ein kleines Dipolmoment vorhanden, im Gegensatz im n-Butan, das kein Dipolmoment hat.
Dennoch hat das n-Butan einen höheren Schmelz- und Siedepunkt, weil die London-Kräfte einen stärkeren Einfluss auf diese Werte haben als die Debye-Kräfte (Dipol-Dipol-Wechselwirkungen).
Butan ist sehr leicht zu verflüssigen, wegen der relativ hohen Siedepunkte. Das macht Butan zu einem hervorragenden Flüssiggas.
4. Gewinnung und Synthese
Die beiden Butane kommen im Erdöl und in geringen Spuren im Erdgas vor, das industriell eingesetzte Butan wird hauptsächlich bei der Erdöldestillation erzeugt.
4.1 Hydrierung von Buten
$C_4H_8 + H_2 \to C_4H_10$
Diese Reaktion benötigt Platin- oder Nickel-Katalysatoren [2].
4.2 Synthese nach Wurtz:
$2 \ C_2H_5Br + 2 \ Na \to C_4H_10 + 2 \ NaBr$
In dem Wikipedia-Artikel finden Sie eine ausführliche Darstellung dieser Reaktion
4.3 Kolbe-Synthese
Laut [5] kann n-Butan auch durch eine Kolbe-Synthese aus den Salzen der Propansäure hergestellt werden. Die Decarboxylierung des Propansäure-Anions liefert dann ein Ethyl-Radikal, und zwei Ethyl-Radikale können sich dann zu einem Butan-Molekül vereinigen. Inwieweit diese Reaktion in der Laborpraxis tatsächlich angewendet wird, geht aus der Fachliteratur nicht hervor.
5. Reaktionen
5.1 Oxidation, Verbrennungswärme
Wie alle Alkane ist auch Butan leicht oxidierbar, wenn genügend Sauerstoff vorhanden ist, verbrennt Butan zu Wasser und Kohlendioxid [6]:
$C_4H_{10} + 6 \frac{1}{2} \ O_{2} \to 4 \ CO_{2} + 5 \ H_{2}O \ \ \ \Delta H = -2878 kJ/mol$
Die Verbrennungswärme ist deutlich höher als beim Propan (-2222 kJ/mol).
5.2 Dehydrierung
Durch Entzug von Wasserstoff kann n-Butan zu zwei Alkenen umgewandelt werden: 1-Buten und 2-Buten. Das Methylpropan kann durch Dehydrierung in Methylpropen umgesetzt werden.

Dehydrierung von n-Butan und Methylpropan
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Weitere technisch wichtige Reaktionen sind die Synthese von Buta-1,3-dien, Isooctan oder - mit Schwefel - Thiophen.
5.3 Chlorierung
Die Chlorierung von Butan ist eine industriell wichtige Reaktion und liefert wertvolle Ausgangsstoffe für weitere Synthesen.
1-Chlorbutan (Siedepunkt 78 ºC) wird durch thermische Chlorierung von n-Butan mit Chlorgas bei Temperaturen von 200 ºC über Aluminiumoxid hergestellt. Auch photochemisch kann diese Reaktion ablaufen, dann reichen schon niedrige Temperaturen von 15-20 ºC [7].
2-Chlorbutan (Siedepunkt 68 ºC) kann ebenfalls durch thermische Chlorierung von n-Butan synthetisiert werden, allerdings immer im Gemisch mit 1-Chlorbutan. Durch die unterschiedlichen Siedepunkte der beiden Chlorbutan-Isomere sollte eine Trennung durch Destillation möglich sein.
1-Chlor-2-methylpropan und 2-Chlor-2-methylpropan werden aus Methylpropan durch Chlorierung hergestellt, wobei wegen der größeren Stabilität tertiärer Radikale mehr 2-Chlor-2-methylpropan entsteht als rein statistisch erwartet. Bei 20 ºC bildet sich 64% 1-Chlor-2-methylpropan, und bei 800 ºC sogar 80%. Das liegt daran, dass bei höheren Temperaturen die Höhe der Aktivierungsenergie keine Rolle mehr bei der Reaktion spielt, daher entspricht hier die Ausbeute in etwa den statistischen Erwartungen.
5.4 Bromierung
Eine Bromierung von Butan ist zwar möglich, wird aber so gut wie nie eingesetzt. Im Labor gewinnt diese Verbindungen eher durch Reaktion der entsprechenden Alkohole oder Alkene [8].
5.5 Isooctan-Synthese

Dimerisierung von Methylpropen (Isobuten)
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Methylpropan dient zur Herstellung von Methylpropen (Dehydrierung). Durch eine starke Säure wie Fluorwasserstoff wird Methylpropen (Isobuten) protoniert, das entstandene Carbenium-Ion setzt sich dann elektrophil an die C=C-Doppelbindung eines zweiten Isobuten-Moleküls. Es bildet sich ein doppelt so großes Carbenium-Ion, das durch Abspaltung eines Protons in ein Octen übergeht, nämlich 2,4,4-Trimethyl-pent-2-en. Dieses wird dann hydriert, und es entsteht 2,4,4-Trimethyl-pentan, auch als Isooctan bekannt. Isooctan spielt eine wichtige Rolle als klopffester Treibstoff.
6. Vorkommen und Bedeutung
6.1 Vorkommen
Butan kommt im Erdöl und im Erdgas vor, es wird hauptsächlich bei der Erdöldestillation gewonnen. Man nimmt an, dass geringe Spuren von Butan auch bei der Zersetzung organischen Materials durch Prokaryoten freigesetzt werden, vor allem beim Abbau von Fettsäuren. Andere Forscher haben herausgefunden, dass Butan von manchen Archaeen als Energiequelle genutzt wird, ähnlich wie Methan [9].
6.2 Bedeutung
Chemische Industrie
Die beiden Butan-Isomere sind ist wichtige Ausgangsstoffe für die Herstellung von Butenen sowie von 1,3-Butadien und Isooctan.
Medizin
Butan hat nicht viele Anwendungen in der Medizin. Am bekanntesten dürften die Kältesprays sein, die zur Schmerzlinderung bei Verletzungen eingesetzt werden. Diese Sprays erzeugen durch die schnelle Verdampfung der Gase eine Kältewirkung auf der Haut, was zu einer vorübergehenden schwachen Betäubung führt. Auch in anderen Sprays, die in der Medizin eingesetzt werden, findet sich Butan. Hier allerdings nicht wegen seiner kühlenden Wirkung, sondern einfach als Treibgas.
Ein anderer medizinischer Aspekt ist der, dass Butan von manchen Leuten als Droge verwendet wird, so ähnlich wie manche Schnüffelstoffe.
Technik und Alltag
Im Alltag begegnen wir Butan in Form von Flüssiggas, abgefüllt in Kartuschen. Diese setzt man ein, um kleine Gasbrenner zu betreiben, zum Beispiel für das Camping.
Auch in Schulen werden spezielle, besonders sichere Butan-Brenner eingesetzt, wenn beispielsweise der Biologie-Raum nicht mit Erdgas versorgt wird oder keine Anlage für die Propangas-Versorgung eingebaut wurde. Allerdings dürfen in Deutschland nur acht dieser Kartuschenbrenner gleichzeitig in einem Raum eingesetzt werden, und die Kartuschen dürfen nicht von den Schüler(innen) ausgewechselt werden [10].
Gemische aus 40% Propan und 60% Butan werden an Tankstellen als Autogas eingesetzt. Auch zum Löten und Schweißen wird Butan verwendet.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "Propan"
- Propan-Datenblatt von GisChem
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Schirmeister/Schmuck/Wich, Beyer/Walter Organische Chemie, 25. Auflage, Hirzel-Verlag 2015.
- Vorlesungsskript 9 der Uni-München
- Wikipedia, Artikel "1-Chlorbutan"
- Wikipedia, Artikel "2-Chlorbutan"
- Hufe, Platthaus: "So nutzen Mikroorganismen Butan zur Energiegewinnung". Laborpraxis.vogel.de vom 15.10.2016.
- "Arbeiten mit Gas" auf Sichere-Schule.de