Versuch
Im Chemieunterricht wird zur Einführung des Begriffs "Dipol" oder "Dipol-Dipol-Wechselwirkung" meistens folgender einfacher Versuch durchgeführt:
Versuch
Ablenkung eines Wasserstrahls
Durchführung:
An einem Stativ wird eine mit Leitungswasser gefüllte Bürette befestigt, unter die Bürette stellt man ein leeres Becherglas. Eine Plastikfolie oder -hülle wird mit einem Stofflappen mehrfach gerieben (stets in die gleiche Richtung!).
Dann lässt man einen dünnen Wasserstrahl aus der Bürette in das Becherglas laufen und hält die Plastikfolie oder -hülle in die Nähe des Wasserstrahls. Das Plastik darf den Wasserstrahl dabei aber nicht berühren.
Beobachtung:
Der Wasserstrahl wird von dem Plastik angezogen. Hier ein kurzes Video dazu.
Erklärungen zum Versuch
Wasser-Moleküle verhalten sich wie Dipole. Die Moleküle haben ein positiv geladenes Ende und ein negativ geladenes. Das negativ geladene Ende besteht aus dem stark elektronegativen Sauerstoff-Atom mit seinen zwei freien Elektronenpaaren. Das positiv geladene Ende setzt sich aus den beiden Wasserstoff-Atomen zusammen.
Durch das Reiben wird die Plastikfolie elektrisch aufgeladen, wobei es völlig egal ist, ob sie sich positiv oder negativ auflädt.
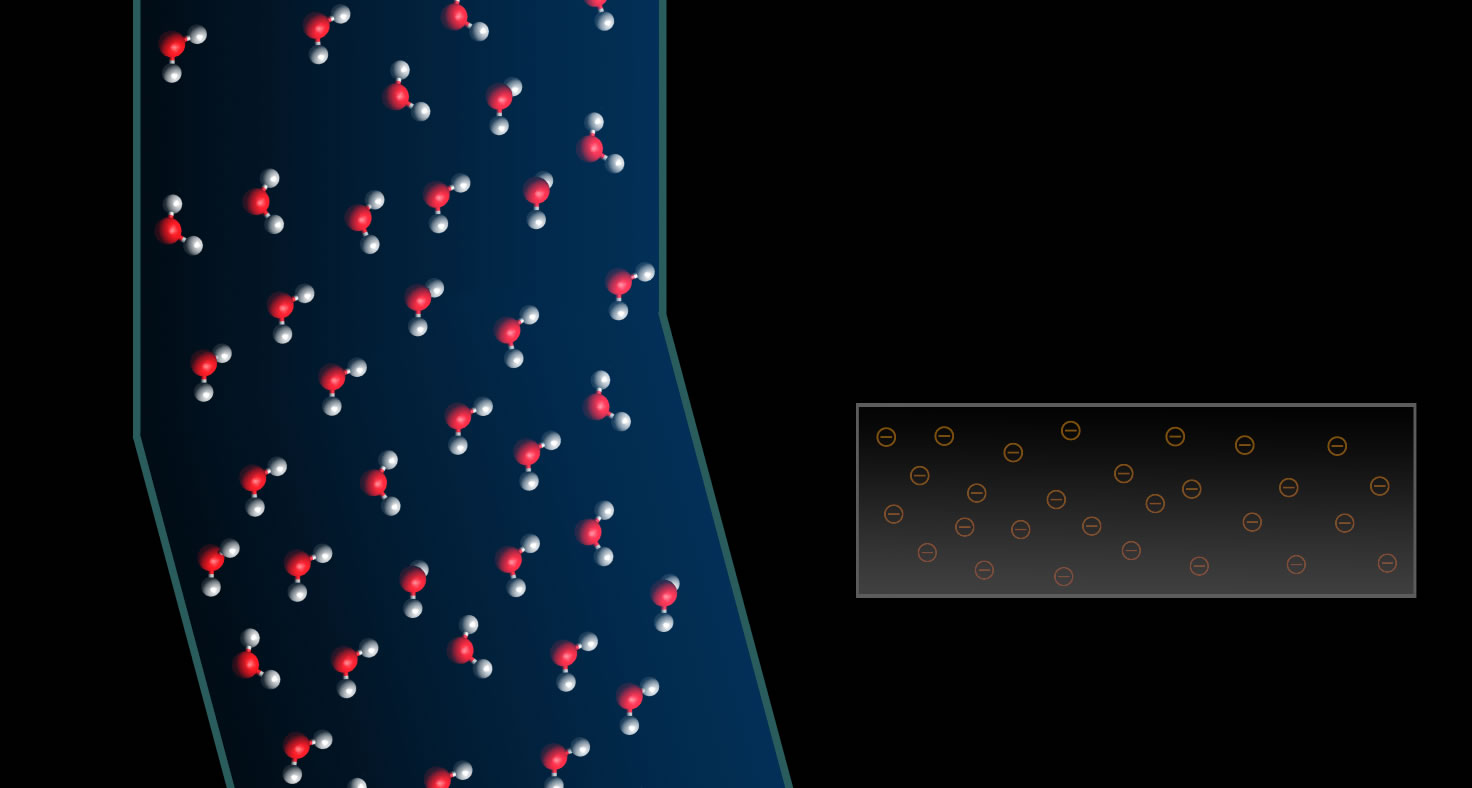
Anziehung eines Wasserstrahls durch eine negativ geladene Folie
Autor: Ulrich Helmich, Lizenz: Public domain
Hält man nun die elektrisch negativ geladene Folie an den Wasserstrahl, so drehen sich alle Wasser-Dipole so, dass ihr positives Ende in Richtung der Folie zeigt. Ist die Folie dagegen positiv geladen, drehen sich die Wasser-Dipole so, dass ihr negatives Ende zur Folie zeigt.
Positive und negative Ladungen ziehen sich an, daher wird der Wasserstrahl nun in Richtung der Folie gezogen, egal ob die Folie negativ oder positiv geladen ist.
Keesom-Wechselwirkung
In der Fachliteratur wird die Dipol-Dipol-Kraft als Keesom-Kraft oder Keesom-Wechselwirkung bezeichnet. Diese van-der-Waals-Wechselwirkung besteht immer dann, wenn es sich bei den Molekülen um permanente Dipole handelt. Die Verbindung Aceton ist ein Musterbeispiel für das Wirken der Keesom-Kraft.
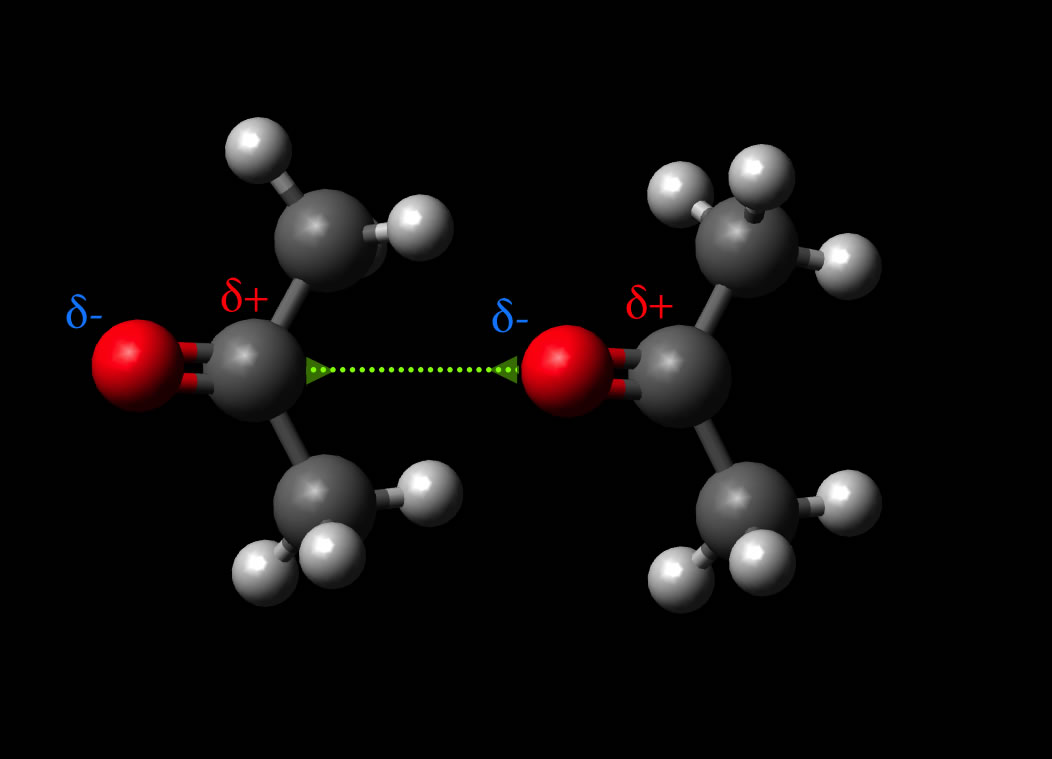
Dipol-Dipol-Wechselwirkung zwischen zwei permanenten Aceton-Dipolen
Autor: Ulrich Helmich, Lizenz: Public domain
Die Sauerstoff-Atome (rot) ziehen die Bindungselektronen der C=O-Doppelbindung stärker an sich als die mittleren C-Atome. Die C=O-Doppelbindung ist also recht polar, was dazu führt, das das gesamte Aceton-Molekül ein permanenter Dipol ist. Wasserstoffbrücken-Bindungen können Aceton-Moleküle untereinander jedoch nicht bilden, dazu fehlen die H-Atome, die an ein elektronegatives O- oder N-Atom gebunden sind. Alle H-Atome des Acetons sind an ein C-Atom gebunden; das reicht nicht aus, um H-Brücken zu bilden.
Weitere Einzelheiten zu dieser Komponente der van-der-Waals-Wechselwirkung finden Sie auf dieser Lexikonseite.
Neben der Keesom-Wechselwirkung oder -Kraft spielen bei den intermolekularen Anziehungskräften zwei weitere Wechselwirkungen eine Rolle, nämlich die Debye-Wechselwirkung und die London-Wechselwirkung. Alle drei Wechselwirkungen (Keesom, Debye und London) werden dann als van-der-Waals-Wechselwirkungen zusammengefasst:
- Anziehung permanenter Dipol - permanenter Dipol (Keesom-Wechselwirkung, 2-25 kJ/mol)
- Anziehung permanenter Dipol - polarisierbares Teilchen (Debye-Wechselwirkung, 2-10 kJ/mol)
- Anziehung polarisierbares Teilchen - polarisierbares Teilchen (London-Wechselwirkung, 0,1-40 kJ/mol)
Dipol-Moment
Das Dipol-Moment ist ein quantitatives Maß für die Stärke eines permanenten Dipols. Es hängt vor allem von zwei Faktoren ab: Dem EN-Unterschied zwischen den an der polaren Bindung beteiligten Atomen und der Geometrie der Moleküle.
Je größer der EN-Unterschied zwischen den relevanten Atomen des Dipols ist, desto größer ist das Dipolmoment.
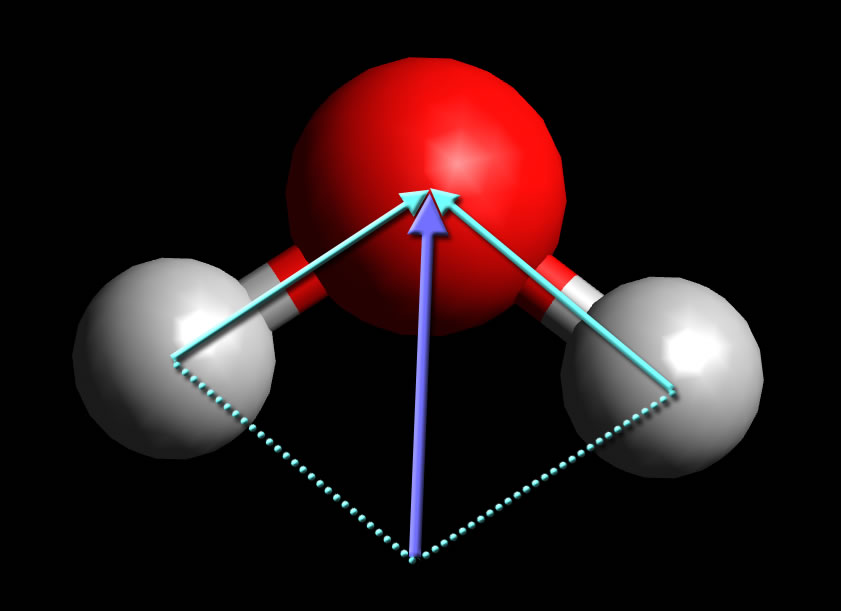
Veranschaulichung des Dipolmoments am Beispiel Wasser-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain
Im Physikunterricht wird das das Kräfte-Parallelogramm besprochen. Ähnlich verfährt man bei der Bestimmung des Dipol-Moments. Die beiden durchgezogenen blauen Pfeile symbolisieren die Stärke der polaren Bindung zwischen Wasserstoff und Sauerstoff. In der Chemie ist es üblich, den Pfeil von der positiven zur negativen Ladung zu ziehen - genau umgekehrt wie in der Physik. Um die Stärke und die Richtung des Dipol-Moments zu bestimmen, kann man sich dieser Kräfte-Parallelogramm-Methode bedienen.
Das Dipol-Moment eines Moleküls wird in Debye gemessen. Hier einige interessante Werte für bekannte Moleküle [2]:
- Wasser H-O-H: 1,84
- Schwefelwasserstoff H-S-H: 0,97
- Fluorwasserstoff H-F: 1,83
- Chlorwasserstoff H-Cl: 1,11
- Bromwasserstoff H-Br: 0,83
- Iodwasserstoff H-I: 0,45
- Natriumchlorid Na+ Cl-: 8,5
Am Beispiel der vier Halogenwasserstoffe kann man gut sehen, welchen Einfluss die EN-Differenz auf das Dipol-Moment hat (EN = Elektronegativität). Beim Fluorwasserstoff ist die EN-Differenz am größten, hier ist auch das Dipol-Moment am größten.
Natriumchlorid als Ionenverbindung gehört eigentlich nicht in diese Übersicht, aber trotzdem ist die Sache interessant: Wäre NaCl ein Molekül, hätte es ein gewaltiges Dipol-Moment, weil die EN-Differenz extrem hoch ist.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "elektrisches Dipolmoment"