Oxidationsbegriff
Um die Oxidation der Alkohole verstehen zu können, muss zunächst der Oxidationsbegriff selbst klar sein. Weil dies ein allgemeines Thema ist, das in der Chemie immer wieder vorkommt, habe ich eine eigene Seite zur Oxidation für meine Lexikon-Abteilung geschrieben.
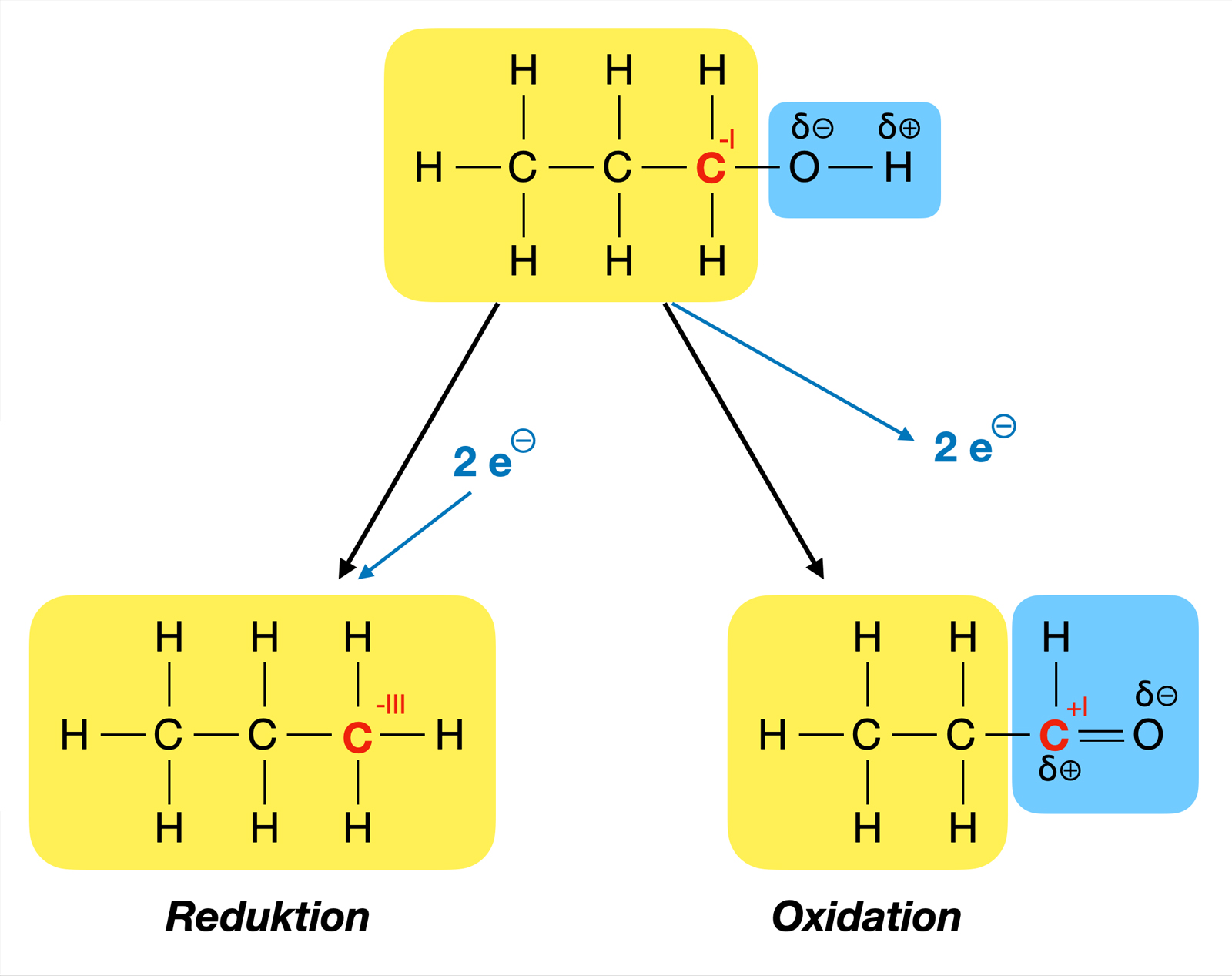
Bei der Oxidation eines Alkohols gibt die OH-Gruppe ein H-Atom ab, und das C-Atom, das die OH-Gruppe trägt, steuert ein zweites H-Atom bei. Rein formal wird also Wasserstoff H2 abgespalten, man kann daher von der Eliminierung eines Wasserstoff-Moleküls sprechen. Eine solche H2-Eliminierung wird auch als Dehydrierung bezeichnet.
Wenn das alles so einfach wäre, wie eben beschrieben, dann dürfte sich eine Flasche Schnaps nicht allzu lange halten. Schade um den 50 Euro teuren Weinbrand! Nach wenigen Minuten wäre kein Ethanol mehr in der Flasche, sondern nur noch Wasser und gasförmiges Ethan.
Was mit diesem kleinen und merkwürdigem Beispiel angedeutet werden soll: Natürlich verschwindet der Wasserstoff nicht einfach "so" aus dem Alkohol, sondern man muss nachhelfen. Die Aktivierungsenergie für eine spontane Dehydrierung ist einfach viel zu hoch, bei Zimmertemperatur kann die Reaktion nicht spontan ablaufen. Das ist ja auch gut so, sonst gäbe es keine Spirituosen-Abteilung im Supermarkt, höchstens eine Ethan-Verkaufsstelle.
Man muss dem Alkohol ein Oxidationsmittel zur Verfügung stellen. Einen Stoff also, der sich sehr gern mit Wasserstoff verbindet und so in der Lage ist, dem Alkohol seinen Wasserstoff zu "entreißen". Welches Oxidationsmittel anzuwenden ist, hängt wiederum davon ab, wie schwer es ist, die beiden H-Atome aus dem Alkohol-Molekül zu entfernen. Manchmal reichen leichte Oxidationsmittel, manchmal muss man zu stärkeren Oxidationsmitteln greifen.
Die Präsentation "Oxidation der Alkohole" können Sie gegen eine kleine Kostenbeteiligung von mir erhalten.
Oxidationsmittel für Alkohole
Natrium- oder Kaliumdichromat Na2Cr2O7 bzw. K2Cr2O7.
Mangandioxid (Braunstein) MnO2.
Mit diesen schwachen bis mittelstarken Oxidationsmitteln kann Ethanol beispielsweise zu Acetaldehyd oxidiert werden. Wenn kräftigere Oxidationsmittel wie zum Beispiel Kaliumpermanganat KMnO4 eingesetzt werden, kann eine Weiteroxidation zur Essigsäure nur schwer verhindert werden.
Sekundäre Alkohole können leichter oxidiert werden als primäre, hier reichen schon schwache Oxidationsmittel oder sogar der Luftsauerstoff aus. Übrigens kann Ethanol, also ein primärer Alkohol, auch durch Luftsauerstoff oxidiert werden, auf diese Weise entsteht beispielsweise Essig aus Wein. Allerdings helfen dabei die Enzyme der Essigsäurebakterien kräftig mit.
Die Oxidationszahl
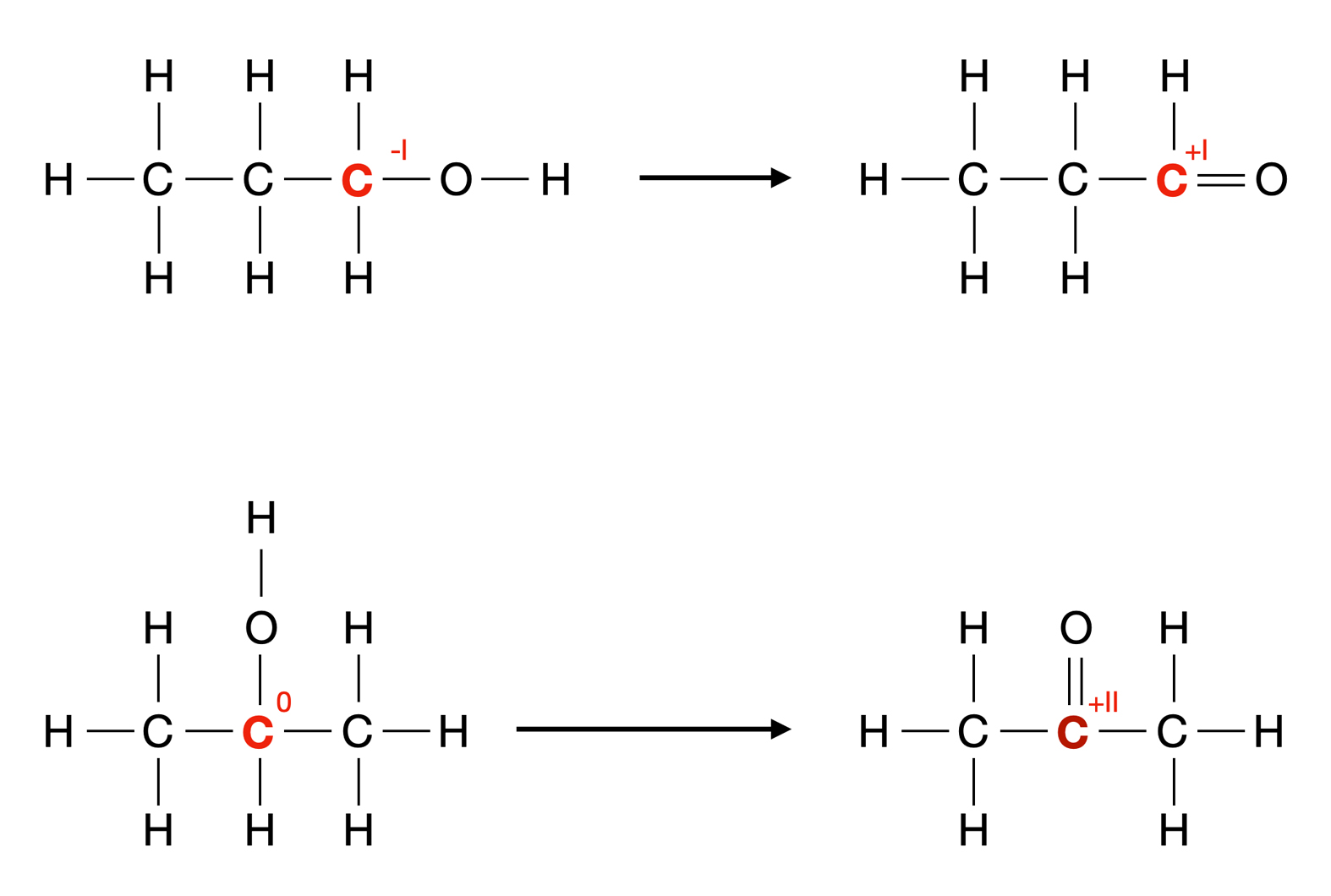
Reduktion (links) und Oxidation (rechts) eines primären Alkohols (Propan-1-ol) zu Propan bzw. Propanal
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Die Abbildung oben zeigt nun das Propan-1-ol-Molekül in der Mitte, das Propan-Molekül links und das Propanal-Molekül rechts. Die Reaktionspfeile deuten an, dass sowohl Propan wie auch Propanal aus Propanol hergestellt werden können. Allerdings interessiert uns hier im Augenblick nur die Reaktion des Propanols zum Aldehyd Propanal.
Wenn Sie sich mit Oxidationszahlen auskennen, werden Sie feststellen, dass der Alkohol um zwei Stufen oxidiert wurde.
Falls Sie sich noch nicht mit Oxidationszahlen auskennen:
Auf dieser Seite gibt es genauere Informationen zum Thema.
Die Präsentation "Oxidationszahlen" können Sie ebenfalls gegen eine kleine Kostenbeteiligung von mir erhalten.
Die Oxidationszahl des rechten C-Atoms beim Propan-1-ol ist -I, während sie beim Propanal +I ist (Oxidationszahlen werden immer als römische Zahlen geschrieben). Propan-1-ol wurde also um zwei Stufen oxidiert, hat also zwei Elektronen abgegeben.
Das Oxidationsmittel, das man zur Oxidation einsetzt, muss also in der Lage sein, die beiden Elektronen aufzunehmen. Gut geeignet sind zum Beispiel zweiwertige Kupfer-Ionen Cu2+, die durch Aufnahme von zwei Elektronen zu elementarem Kupfer werden.
Oxidation primärer, sekundärer und tertiärer Alkohole
Merke:
Oxidation von Alkoholen
Aus primären Alkoholen werden Aldehyde, aus sekundären Alkoholen Ketone. Das Kohlenstoffgerüst bleibt bei diesen Oxidationen erhalten. Tertiäre Alkohole können zwar auch oxidiert werden, aber dabei wird das Kohlenstoffgerüst zerstört. Meistens entstehen dabei Wasser und Kohlendioxid als Oxidationsprodukte oder kleinere organische Moleküle.