Um beurteilen zu können, wie stark ein Atom oder ein Molekül oxidiert oder reduziert wurde, hat man den abstrakten bzw. formalen Begriff Oxidationszahl eingeführt.
Bei Elementen wie Magnesium oder Schwefel ist es recht einfach, eine Oxidation zu erkennen. Wenn wir Magnesium verbrennen, entsteht Magnesiumoxid, und aus Schwefel und Sauerstoff erhalten wir Schwefeldioxid.
Auch bei der Reaktion von Fe2+-Ionen zu Fe3+-Ionen oder vergleichbaren Vorgängen ist leicht die Oxidation zu erkennen, denn schließlich wurde ein Elektron abgegeben. Und wenn Cu2+-Ionen ein Elektron aufnehmen entstehen Cu+-Ionen, was auch jeder sofort als Reduktion erkennt (siehe auch Oxidationsbegriff).
Bei organischen Verbindungen ist es häufig aber nicht auf den ersten Blick erkennbar, ob ein C-Atom oxidiert oder reduziert wurde. Hier hilft dann die Bestimmung der Oxidationszahl vor der Reaktion und nach der Reaktion.
Bestimmung der Oxidationszahl
Die Oxidationszahl eines Atoms ist sozusagen der Unterschied zwischen SOLL und HABEN: Wie viele Elektronen SOLL das Atom laut Periodensystem haben - und wie viele Elektronen HAT es tatsächlich - zumindest "auf dem Papier" ?
Machen wir uns das am Beispiel des Ethan-Moleküls klar. Welche Oxidationszahlen haben die beiden C-Atome sowie die sechs H-Atome?
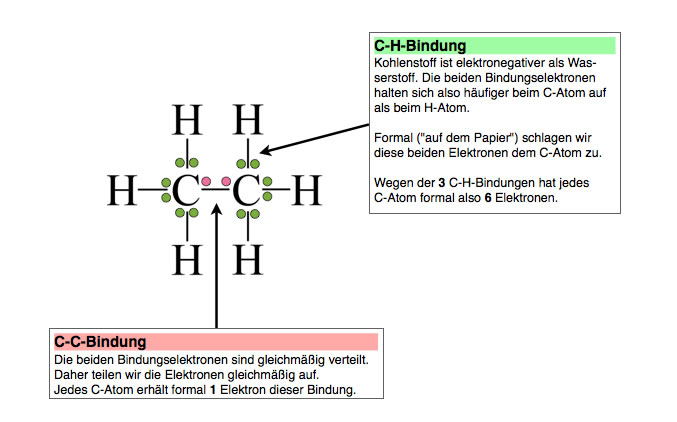
Oxidationszahlen des Ethan-Moleküls
C-H-Bindung
Kohlenstoff ist elektronegativer als Wasserstoff. Die beiden Bindungselektronen halten sich also mit höherer Wahrscheinlichkeit beim C-Atom auf als beim H-Atom.
Formal (sozusagen "auf dem Papier") schlagen wir diese beiden Elektronen dem C-Atom zu. Wegen der drei C-H-Bindungen hat jedes C-Atom formal also sechs Elektronen.
C-C-Bindung
Die beiden Bindungselektronen sind gleichmäßig verteilt, da die beiden C-Atome natürlich die gleiche Elektronegativität haben. Daher teilen wir die Elektronen gleichmäßig auf die beiden C-Atome auf. Jedes C-Atom erhält formal ein Elektron dieser Bindung.
Oxidationszahl der beiden C-Atome
Laut Periodensystem sollte ein C-Atom vier Elektronen besitzen; denn Kohlenstoff ist ein Element der vierten Hauptgruppe. Formal gesehen haben die C-Atome im Ethan aber jeweils sieben Elektronen, also drei Elektronen mehr, als sie eigentlich haben sollten. Diese Differenz zwischen der Zahl der Elektronen laut Periodensystem und der formalen Zahl der tatsächlich vorhandenen Elektronen ist dann die Oxidationszahl. In diesem Fall haben die beiden C-Atome die Oxidationszahl -III. Oxidationszahlen werden stets in römischen Ziffern angegeben.
Weitere Beispiele
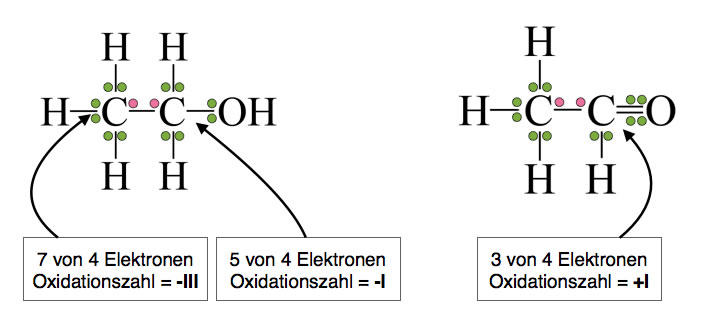
Oxidationszahlen bei Ethanol und Acetaldehyd
Das mit der OH-Gruppe verbundene C-Atom des Ethanols hat formal noch fünf Elektronen statt der vier, die es laut PSE haben sollte. Die Oxidationszahl beträgt daher -I. Im Vergleich mit dem entsprechenden C-Atom des Ethans ist das C-Atom also um zwei Stufen oxidiert worden, was der Abgabe von zwei Elektronen entspricht.
Das mit dem O-Atom verbundene C-Atom des Acetaldehyds hat formal nur noch drei Elektronen, damit hat es eine Oxidationszahl von +I. Wird Ethanol also zu Acetaldehyd oxidiert, so gibt dieses C-Atom zwei Elektronen ab.