Grundlagen
In der organischen Chemie werden ständig irgendwelche Verbindungen oxidiert. Dieser Reaktionstyp ist so wichtig, dass er bereits in der Stufe EF behandelt wird. Hier meistens am Beispiel der Oxidation von primären und sekundären Alkoholen zu Aldehyden bzw. Ketonen.
Das Problem bei diesem "Reaktionstyp" ist, dass es sich eigentlich gar nicht um einen bestimmten Reaktionstyp handelt. Eine Oxidation ist keine Substitution, keine Addition und auch keine Eliminierung, und auch die Kategorien radikalisch, nucleophil oder elektrophil passen hier nicht wirklich. Dennoch habe ich die Oxdiation hier als "Reaktionstyp" dargestellt, weil ich manchen Reaktionsketten eben Oxidationen (und Reduktionen) immer wieder vorkommen.
Grundlegende Begriffe
Unter einer Oxidation versteht man verschiedene Vorgänge:
- Aufnahme von Sauerstoff
- Abgabe von Wasserstoff
- Abgabe von Elektronen
Betrachten wir dazu mal einfach ein paar typische Reaktionen, wie sie bereits in der Stufe EF behandelt werden. Als erstes wollen wir uns die Oxidation von Ethanol zu Ethanal anschauen.
Fallbeispiel Oxidation von Ethanol mit CuO
Variante 1 als Schülerversuch auch schon in der Sek. I
Man gibt etwas Ethanol in eine Abdampfschale und glüht dann ein Kupferblech aus. Das noch heiße Kupferblech (mit seiner Oxidschicht) wird dann schnell in den Alkohol gehalten. Das Kupferblech nimmt sofort wieder seine rotbraune helle Farbe an, und gleichzeitig kann man einen stechenden Geruch beobachten.
Variante 2 als Demonstrationsversuch oder Schülerversuch in der Sek. II
Man gibt 40 bis 50 ml Alkohol in einen 250 ml-Rundkolben und verbindet diesen mit einem Verbrennungsrohr, dessen Ausgang seinerseits mit einem Liebigkühler verbunden ist. In dem Verbrennungsrohr befinden sich dicht gepackte Kupferspäne. Der Rundkolben wird mit der Pilzheizhaube erhitzt, so dass der Alkohol siedet, und das Verbrennungsrohr wird mit dem Bunsenbrenner stark erhitzt, so dass die Kupferspäne richig heiß werden. Die heißen Alkoholdämpfe werden dann über die heißen Kupferspäne geleitet. Das heiße Kupfer oxidiert den Alkohol zum Aldehyd. Die Aldehyd-Dämpfe werden dann in den Kühler geleitet und kondensieren dort.
Reaktion
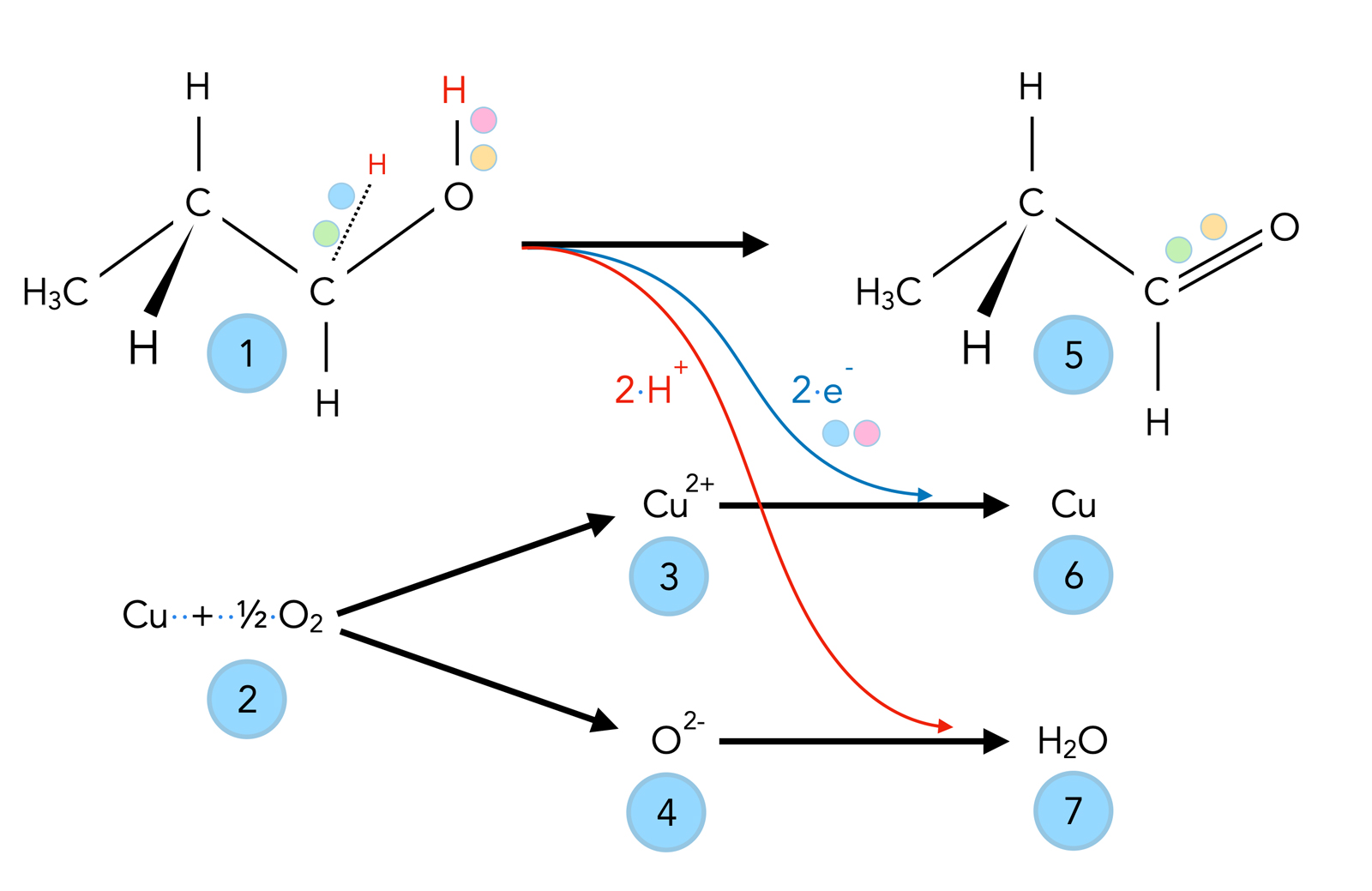
Oxidation von Propan-1-ol zu Propanal
Die Oxidation des Alkohol-Moleküls (im Bild am Beispiel von Propan-1-ol gezeigt) ist sowohl mit einer Abgabe von Wasserstoff verbunden; zwei H-Atome werden abgegeben. Auf dem Bild sieht man, dass dieser Vorgang etwas komplexer ist: Es werden zwei Protonen und zwei Elektronen abgegeben. Formal sind das zwar zwei H-Atome, praktisch treten diese aber nicht auf.
Die beiden Elektronen werden nun dazu genutzt, die zweifach positiv geladenen Kupfer-Ionen zu reduzieren, so dass elementares Kupfer entsteht. Die beiden Protonen dagegen vereinigen sich mit dem Oxid-Ion des gebildeten Kufperoxids, und so entsteht Wasser.
Reaktionstyp
Wenn man sich die Abbildung 1 betrachtet, muss man zu dem Schluss kommen, dass diese Oxidation zum Reaktionstyp der Eliminierungen gehört, genauer gesagt, zum Reaktionstyp der Dehydrierung. Zwei H-Atome werden aus dem Alkohol entfernt, und es bildet sich eine C=O-Doppelbindung.
Fallbeispiel Oxidation eines Alkohol mit Chromsäure / Chromat / Dichromat
Häufig werden Alkohol mit Hilfe von Chromsäure oder deren Salzen, den Chromaten oxidiert. Als Schulversuch findet man oft die Oxidation von Ethanol mit Kaliumdichromat. Auf dieser Reaktion beruhen auch die verschiedenen Alkoholtest-Röhrchen, die bis vor kurzem noch bei der Polizei eingesetzt wurden.
Reaktion im Überblick

Oxidation von Ethanol mit Kaliumdichromat
Die Reaktion erscheint schon reichlich komplex. Ein Ethanol-Molekül gibt - wie üblich - zwei Protonen und zwei Elektronen ab. Als Elektronenakzeptor tritt hier das Dichromat-Ion Cr2O72- auf. Durch Aufnahme von sechs Elektronen entsteht daraus die reduzierte Form 2 Cr3+. Wohin aber mit dem Sauerstoff des Dichromat-Ions? Dazu dienen die Protonen, die allerdings nicht vom Alkohol geliefert werden können, sondern von der Schwefelsäure, die zugesetzt werden muss. Mit den Protonen der Schwefelsäure vereinigen sich die O-Atome des Dichromats dann zu Wasser-Molekülen.
Auch die Reaktionsprodukte sind nicht ganz einfach zu verstehen. Zunächst könnte man denken, dass Kaliumsulfat entsteht, doch so einfach ist das nicht. Wie die untere Reaktionsgleichung zeigt, entsteht Chromsulfat Cr2(SO4)3 und nur ein wenig Kaliumsulfat[1].
Reaktion mit Chromaten