5.1 Rekapitulation Schulwissen
Eliminierungen werden im Schulunterricht normalerweise kurz besprochen; oft wird auch im Schülerversuch aus Ethanol das Alken Ethen synthetisiert, oder zumindest im Lehrerversuch.
In der Schulchemie sind die 1,2-Eliminierungen (auch β-Eliminierungen genannt) die wichtigsten, sie führen in der Regel zu Alkenen oder anderen Verbindungen mit einer C=C-Doppelbindung oder einer C=O-Doppelbindung.
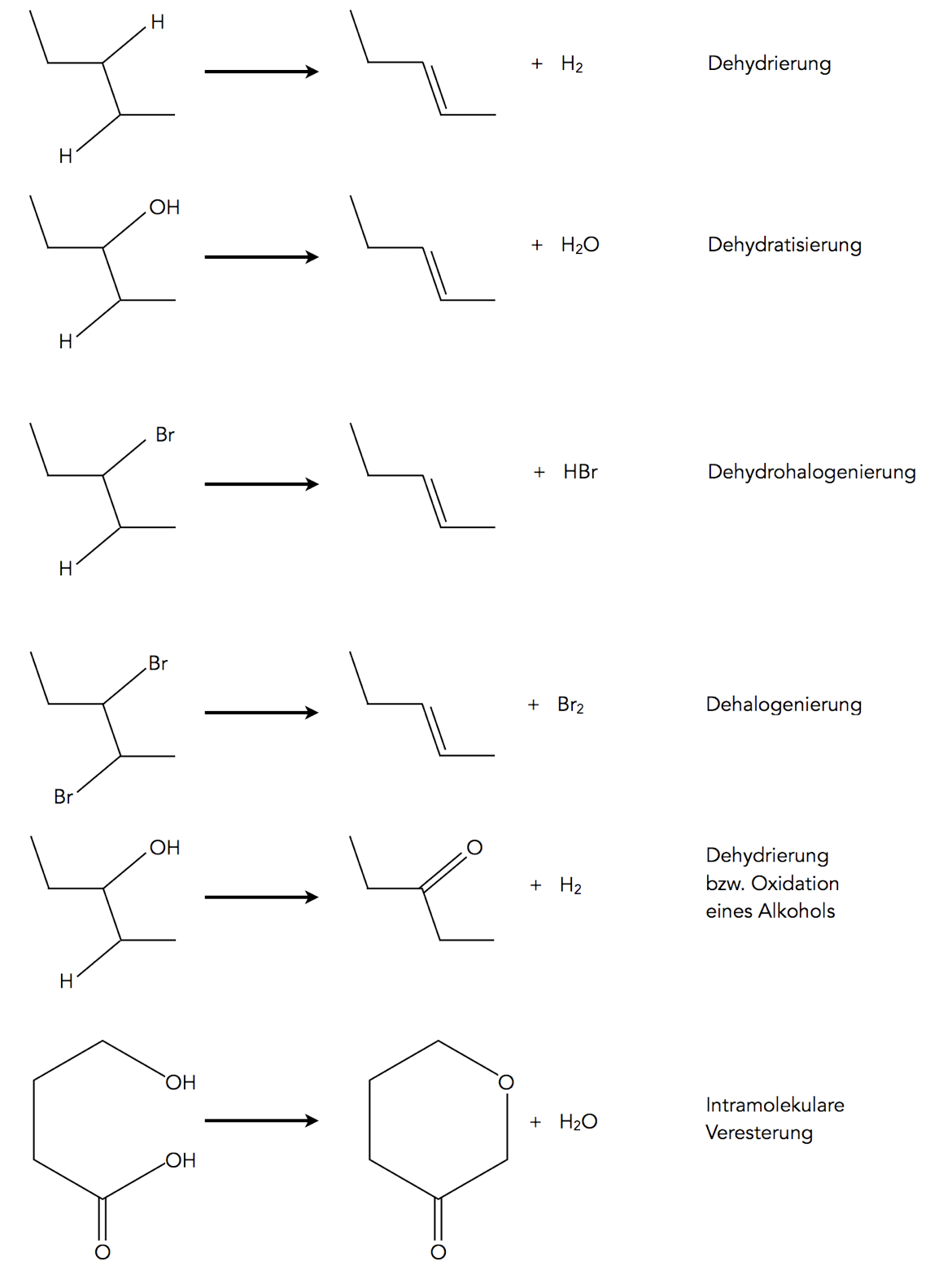
Einige typische Eliminierungs-Reaktionen
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Dehydrierung = 1,2-Eliminierung von Wasserstoff, es bildet sich ein Alken.
Dehydratisierung = 1,2-Eliminierung von Wasser, auch hier bildet sich ein Alken.
Dehydrohalogenierung = 1,2-Eliminierung von Chlorwasserstoff, Bromwasserstoff etc., auch hier entsteht wieder ein Alken.
Dehalogenierung = 1,2-Eliminierung von Chlor, Brom etc., wieder ist ein Alken das Produkt.
Oxidation eines primären oder sekundären Alkohols = 1,2-Eliminierung von Wasserstoff, im Prinzip also eine Dehydrierung.
Intramolekulare Veresterung = 1,4-Eliminierung von Wasser, also eine Dehydratisierung.
Natürlich sind auch weitere intramolekulare Ringschluss-Reaktionen möglich, bei denen ein Molekül abgespalten wird. Formal handelt es sich dabei ebenfalls um Eliminierungen.
Auf die genauen Mechanismen der verschiedenen Eliminierungsreaktionen wird in den aktuellen Schulbüchern nicht oder nur sehr oberflächlich eingegangen; im Schroedelband findet sich dazu gar nichts.
5.2 Studienvorbereitung
5.2.1 Die verschiedenen Typen der Eliminierung
5.2.1.1 Einteilung nach Stellung der betroffenen C-Atome
Je nachdem, welche C-Atome ihrer Substituenten "beraubt" werden, unterscheidet man mehrere Klassen von Eliminierungen [5], die im folgenden Bild dargestellt werden:
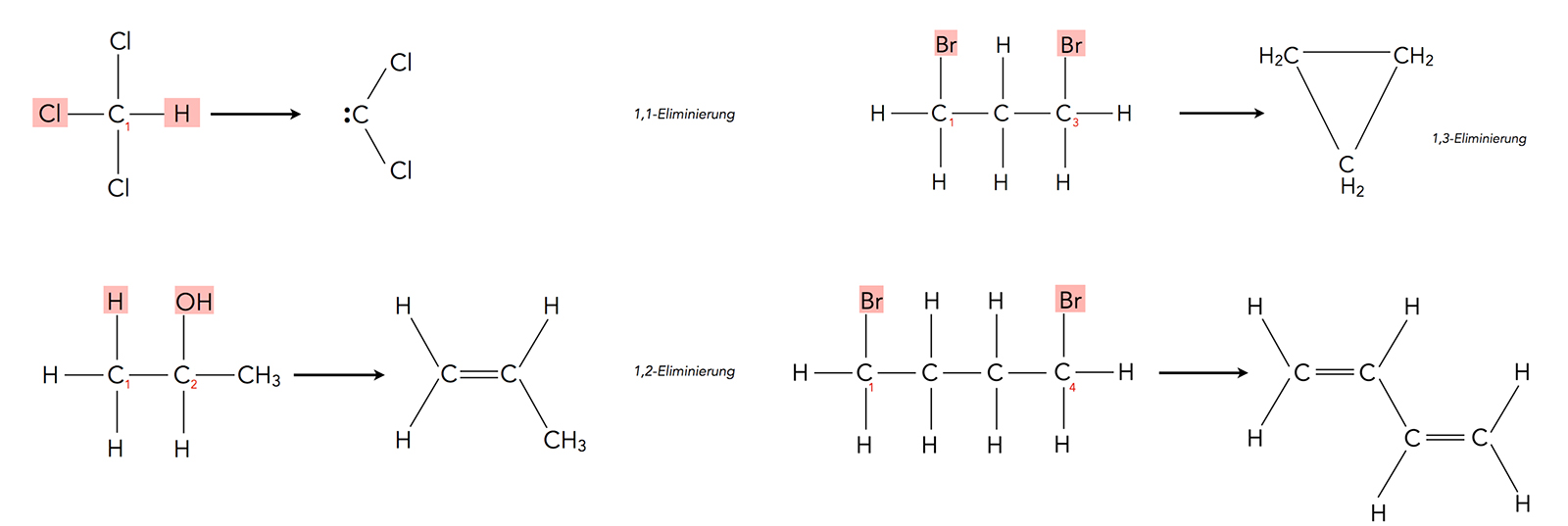
Vier Klassen von Eliminierungen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die Abbildung zeigt Beispiele für die verschiedenen Klassen der Eliminierungen, nämlich die 1,1-, die 1,2-, die 1,3- und die 1,4-Eliminierungen. Es ist üblich, die 1,1-Eliminierungen als α- und die 1,2-Eliminierungen als β-Eliminierungen zu bezeichnen.
Auch Ringschluss-Reaktionen gehören zu den Eliminierungen:
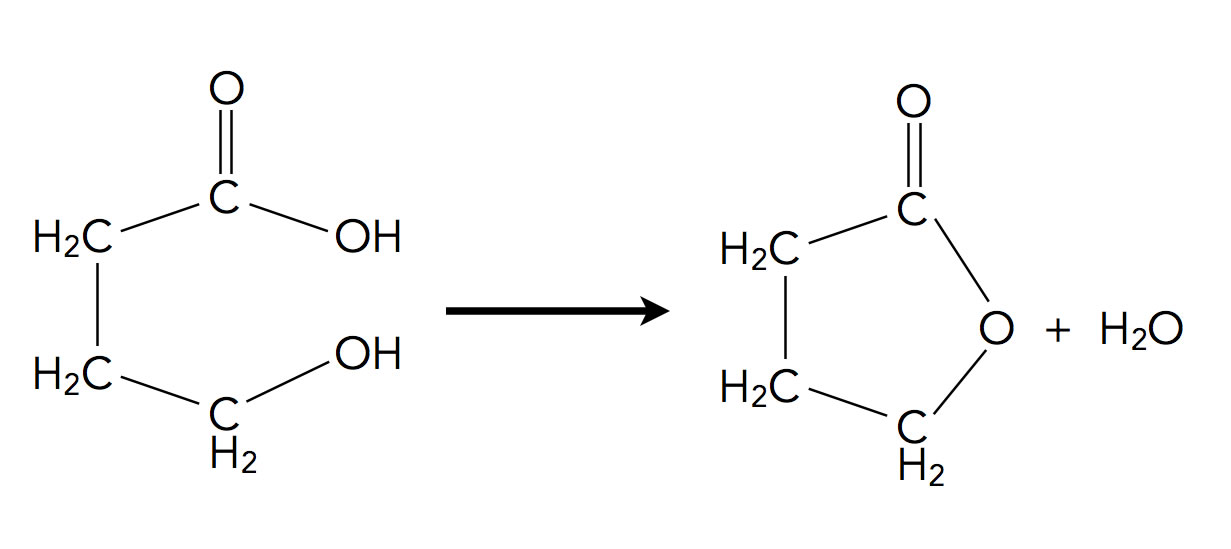
Intramolekulare Esterbildung, eine Eliminierung?
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Formal handelt es sich hier um eine 1,4-Eliminierung, allerdings würde man diese Reaktion eher als intramolekulare Veresterung oder Kondensation bezeichnen. Wenn man solche Reaktionen als Eliminierungsreaktionen bezeichnet, sind natürlich auch 1,5-, 1,6- und noch "höhere" Eliminierungsreaktionen denkbar.
5.2.1.2 Einteilung nach der Kinetik
Ähnlich wie bei den nucleophilen Substitutionen werden auch die Eliminierungen nach ihrer Kinetik in zwei Typen eingeteilt, die E1-Eliminierungen laufen in einem zweischrittigen Prozess ab, wobei der geschwindigkeitsbestimmende Schritt eine monomolekulare Reaktion ist. Die E2-Eliminierungen laufen in einem Schritt ab, beide Atome oder Atomgruppen treten gleichzeitig aus dem Molekül aus.
5.2.1.3 Einteilung nach der Orientierung
Stehen die beiden zu eliminierenden Abgangsgruppen auf der selben Seite des Substrats, spricht man von einer syn-Eliminierung, stehen sie auf gegenüberliegenden Seiten, von einer trans-Eliminierung.
5.2.2 Der E1-Mechanismus
Der E1-Mechanismus ist mit dem SN1-Mechanismus der Nucleophilen Substitution verwandt.
Schauen wir uns dazu die Dehydratisierung eines Alkohols etwas näher an.
Wer sich von Ihnen dafür interessiert, wie der Versuch praktisch durchgeführt wird, kann ja noch einmal auf die entsprechende Seite zur Versuchsdurchführung gehen.
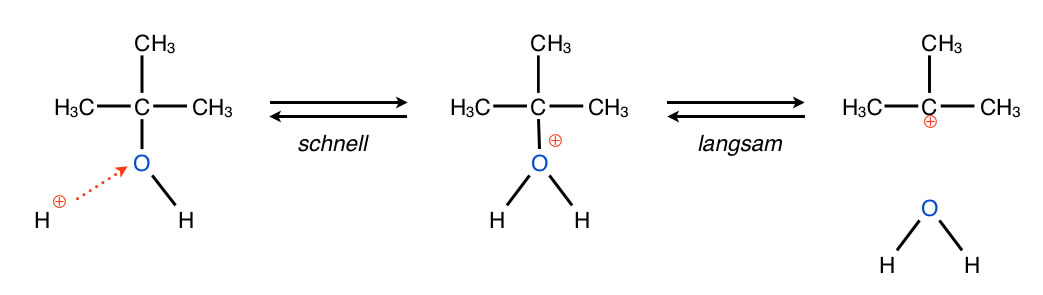
Bildung eines Carbenium-Ions
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Bei der Eliminierung müssen die OH-Gruppe und ein H-Atom aus dem Alkohol entfernt werden. Die OH-Gruppe ist allerdings eine sehr schlechtes Nucleofug (Abgangsgruppe). Man kann aber "nachhelfen", indem man die Lösung ansäuert, zum Beispiel mit Schwefelsäure, dann wird nämlich die OH-Gruppe protoniert und es bildet sich eine OH2+-Gruppe. Diese ist im Gegensatz zur "nackten" OH-Gruppe eine sehr gute Abgangsgruppe und kann leicht als Wasser-Molekül H2O abgespalten werden. Die positive Ladung bleibt am C-Atom zurück und es entsteht ein Carbenium-Ion . Das alles kennen wir bereits vom Schritt 1 des SN1-Mechanismus der Nucleophilen Substitution.
Dieses Carbenium-Ion ist recht instabil und "versucht", in einem zweiten Reaktionsschritt seine positive Ladung zu verlieren. Dazu gibt es zwei Möglichkeiten.
- Anlagerung eines negativ geladenen Ions, zum Beispiel eines Bromid-Ions. Wird dieser Reaktionsweg eingeschlagen, so haben wir es mit einer SN1-Reaktion zu tun.
- Abgabe eines Protons. Dies ist dann der Reaktionsweg der Eliminierung, bei der eine C=C-Doppelbindung entsteht, in diesem Falle bildet sich das Alken 2-Methyl-propen. Allerdings kann ein Proton nicht so einfach abgegeben werden, es ist schon eine einigermaßen starke Base :B erforderlich, die das Proton aufnehmen kann.
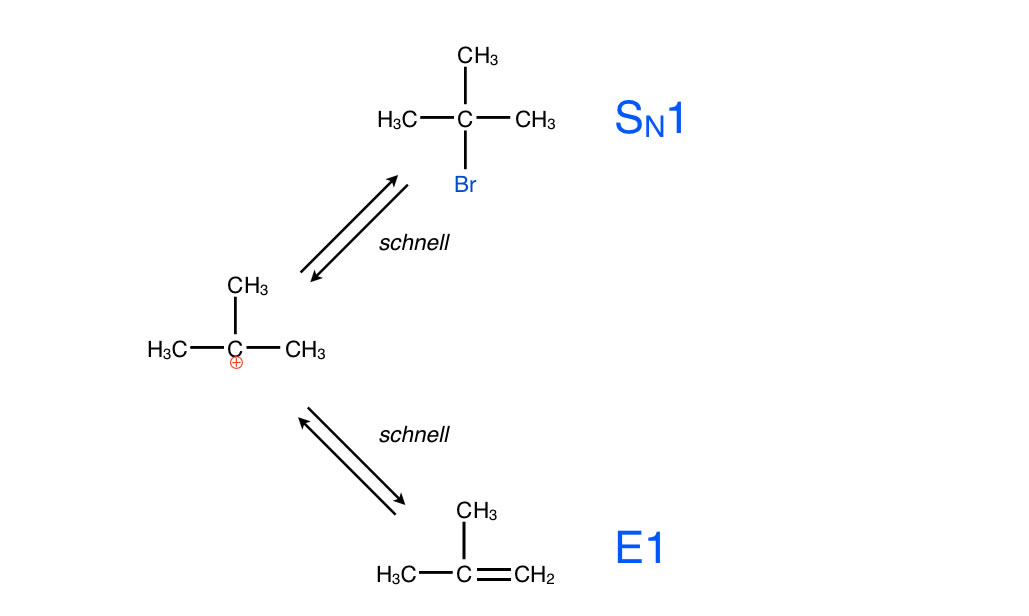
Die E1-Eliminierung als Konkurrenzreaktion zur SN1-Substitution
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Welcher der beiden Reaktionswege eingeschlagen wird, hängt natürlich von den genauen Reaktionsbedingungen ab, vor allem von der Temperatur [7].
Temperatur unter 100 ºC
Bei diesen "niedrigen" Temperaturen reagiert der Alkohol bevorzugt mit der zugesetzten Schwefelsäure zu Schwefelsäureethylester.
Temperatur 130 bis 140 ºC
Bei "mittleren" Temperaturen reagiert das Carbenium-Ion mit einem weiteren Alkohol-Molekül als Nucleophil und es entsteht ein Diethylether-Molekül:
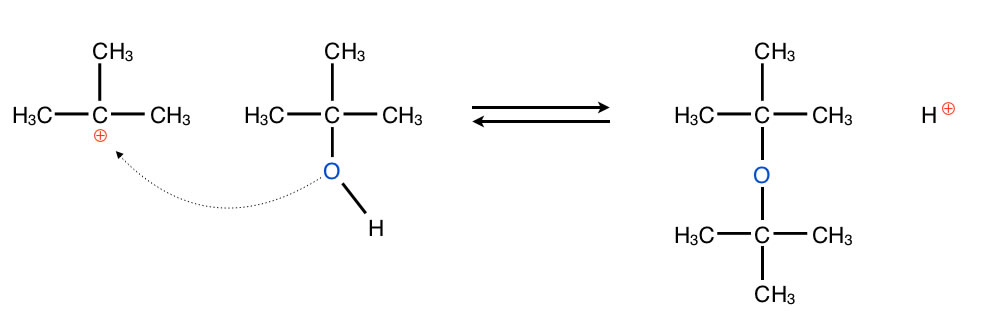
Die Etherbildung ist ebenfalls eine SN1-Reaktion
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Temperatur 160 bis 180 ºC
Hier überwiegt die Eliminierungsreaktion, und es bildet sich hauptsächlich Ethen.
Aufgabe:
In dem Buch von Vollhardt und Schore [5] findet sich folgende Angabe:
"Löst man 2-Brom-2-methylpropan bei 25 °C in wässrigem Ethanol, so erhält man eine Mischung von (CH3)3C-O-CH2-CH3 (30 %), (CH3)3C-OH (60 %) und (CH3)2C=CH2 (10 %)."
Erklären Sie diesen Befund.
Lösungsvorschlag:
Die erste Verbindung, ein Ether, ist das Produkt der SN1-Reaktion mit Ethanol, die zweite Verbindung entsteht in einer Reaktion mit Wasser als Nucleophil, und die dritte Verbindung ist das Produkt einer E1-Eliminierung.
Aufgabe:
Der Faktor Entropie hat oft einen entscheidenden Einfluss auf den Verlauf chemischer Reaktionen. Begründen Sie, wieso dieser Entropiefaktor ΔS den Mechanismus der Eliminierung begünstigt, wenn man Ethanol mit Schwefelsäure erhitzt und welche Rolle dabei die Temperatur spielt.
Lösungsvorschlag:
Bei der Esterbildung und bei der Etherbildung entsteht aus zwei Edukt-Molekülen ein Produkt-Molekül. Die Entropie nimmt hierbei also ab.
Bei der Eliminierungsreaktion entstehen dagegen aus einem Molekül Ethanol zwei Moleküle, nämlich Ethen und Wasser. Die Entropie nimmt bei dieser Reaktion also zu. Aus diesem Grund ist diese Reaktion energetisch vorteilhaft, denn der Entropiezuwachs wirkt sich auf die freie Reaktionsenthalpie ΔG günstig aus: ΔG = ΔH - T * ΔS.
Wie man aus dieser Gleichung entnehmen kann, wirkt sich der Entropiefaktor ΔS um so stärker günstig aus, je höher die Temperatur T ist. Daher überwiegt bei hohen Temperaturen die Eliminierungsreaktion.
Bemerkung:
Würde man jetzt auch noch die Aktivierungsenergien der drei verschiedenen Reaktionswege kennen, könnte man noch genauere Angaben dazu machen, welche Reaktion bei welchen Temperaturen bevorzugt abläuft. Bei niedrigen Temperaturen werden nämlich normalerweise die Reaktionswege bevorzugt, die eine möglichst niedrige Aktivierungsenergie haben. Nach den obigen Befunden scheint das ja die Esterbildung zu sein.
5.2.3 Der E2-Mechanismus
Während der eben besprochene E1-Mechanismus mit dem SN1-Mechanismus verwandt ist - beide haben den gleichen ersten Reaktionschrit - ist der E2-Mechanismus mit dem SN2-Mechanismus verwandt.
Rekapitulation SN2-Mechanismus
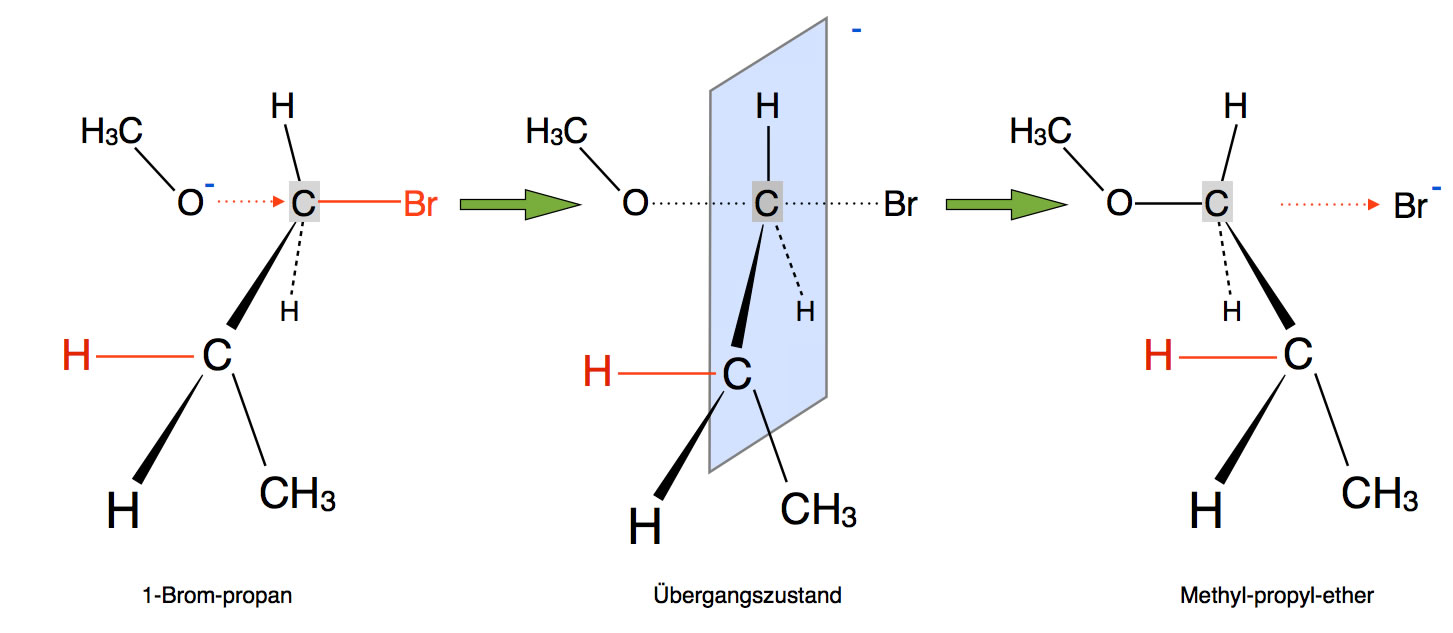
Betrachten wir einmal eine "alltägliche" SN2-Reaktion, nämlich die Umsetzung von 1-Brom-propan mit dem Methanolat-Ion als Nucleophil:
Diese Reaktion läuft nach dem SN2-Mechanismus ab. Der SN1-Mechanismus ist energetisch sehr ungünstig, weil dann ein primäres Carbenium-Ion gebildet werden müsste. Also scheidet auch eine E1-Eliminierung als Konkurrenzreaktion aus.
E2 als Konkurrenzreaktion
Trotzdem kann man bei der Reaktion ein Alken als Nebenprodukt feststellen, nämlich Propen.
Wie kann Propen entstehen, wenn keine E1-Eliminierung ablaufen kann?
Offensichtlich gibt es eine alternative Möglichkeit der Eliminierung. Dazu betrachten wir das nächste Bild:
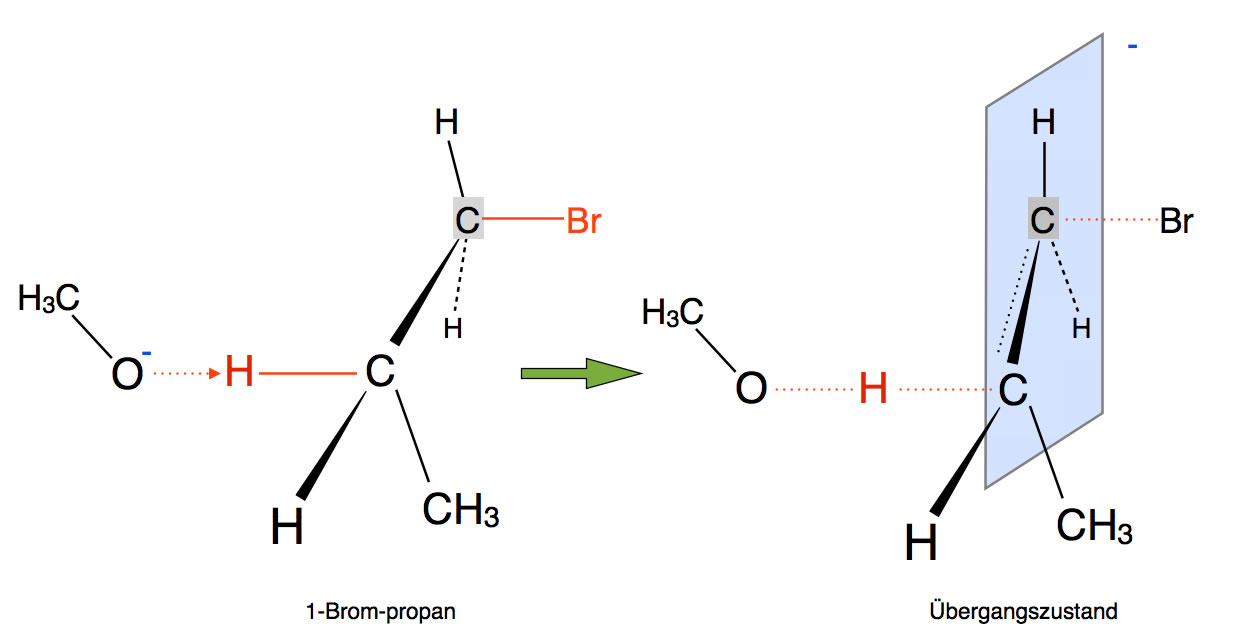
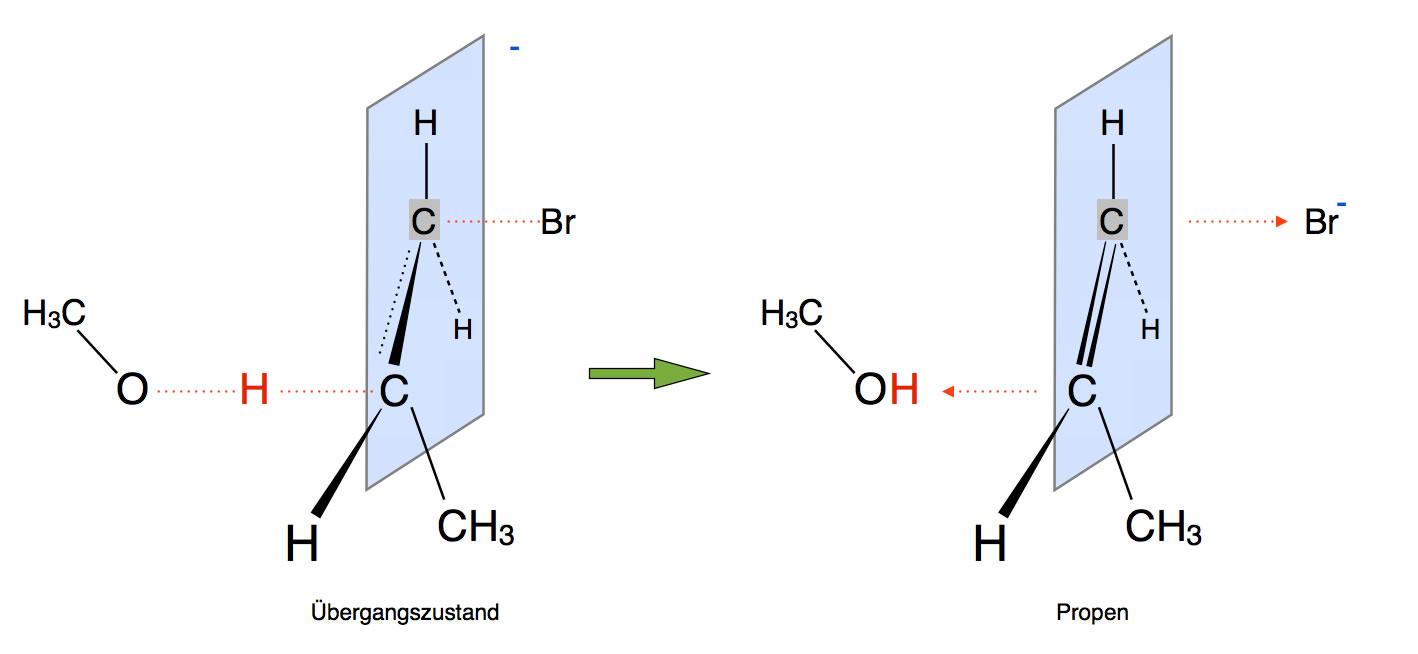
Die Bildung des Übergangszustandes bei der E2-Eliminierung
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Das Methanolat-Anion greift hier nicht als Nucleophil an, sondern als Base!
Als Nucleophil würde Methanolat das Brom ersetzen (SN2-Mechanismus). Als Base dagegen entfernt das Methanolat ein Proton aus dem 1-Brom-Propan.
Entfernt man ein Proton aus einem organischen Molekül, bleibt ein negativ geladenes C-Atom zurück, ein sogenanntes Carbanion. Carbanionen sind recht instabil, und wenn es eine Möglichkeit gibt, die Bildung eines Carbanions zu vermeiden, so wird diese auch gewählt.
Bei der E2-Eliminierung wird die Bildung eines Carbanions vermieden, indem gleichzeitig (konzertierte Reaktion) mit der Entfernung des Protons ein Bromid-Ion abgegeben wird. Das kann man an dem Übergangszustand in der folgenden Abbildung gut erkennen.
Die Base Methanolat "zieht" das H-Atom ganz aus dem Molekül heraus, gleichzeitig entfernt sich das Brom als Bromid-Ion von dem Molekül. Aus der "halben" Doppelbindung wird eine ganze Doppelbindung.
Damit haben wir den E2-Mechanismus im Prinzip schon kennengelernt.
Auf dieser Vertiefungsseite wird der E2-Mechanismus näher beleuchtet. Vor allem wird die Frage geklärt, warum die E2-Eliminierung als trans-Eliminierung und nicht als syn-Eliminierung abläuft. Auch auf die Selektivität der E2 wird näher eingegangen.
5.2.4 Der E1cB-Mechanismus
5.2.4.1 Rekapitulation E2
Bei einer Eliminierung kann die C-X-Bindung gleichzeitig mit der C-H-Bindung gespalten werden, dann handelt es sich um eine bimolekulare E2-Eliminierung (siehe Abschnitt 5.2.3).
5.2.4.2 Rekapitulation E1
Wenn die C-X-Bindung zuerst gespalten wird und erst danach die C-H-Bindung, handelt es sich um eine normale E1-Eliminierung, die Konkurrenzreaktion zur SN1-Substitution mit einem Carbenium-Ion als Zwischenprodukt. Diese E1-Eliminierung wurde im Abschnitt 5.2.2 besprochen.
5.2.4.3 Und nun etwas Neues
Es kann aber auch sein, dass zuerst die C-H-Bindung und erst danach die C-X-Bindung gespalten wird. Eine starke Base zieht das H-Atom als Proton aus der Verbindung heraus, und zurück bleibt ein Carbanion als Zwischenprodukt. Erst im zweiten Schritt wird die C-X-Bindung gespalten.
Diese monomolekulare Eliminierung bezeichnet man als E1cB-Eliminierung. Das "cB" steht dabei für "conjugierte Base". Gemeint ist damit, dass die starke Base, die das Proton aus dem Halogenalkan abstrahiert, einen entscheidenden Einfluss auf die Geschwindigkeit der Reaktion hat.
Es stellt sich nun allerdings die Frage, wieso der E1cB-Mechanismus mit einer monomolekularen Kinetik verläuft und nicht mit einer bimolekularen. Es müssen doch zwei Moleküle zusammenstoßen, wenn die Base das Proton abstrahieren soll, nämlich die Base und das Halogenalkan.
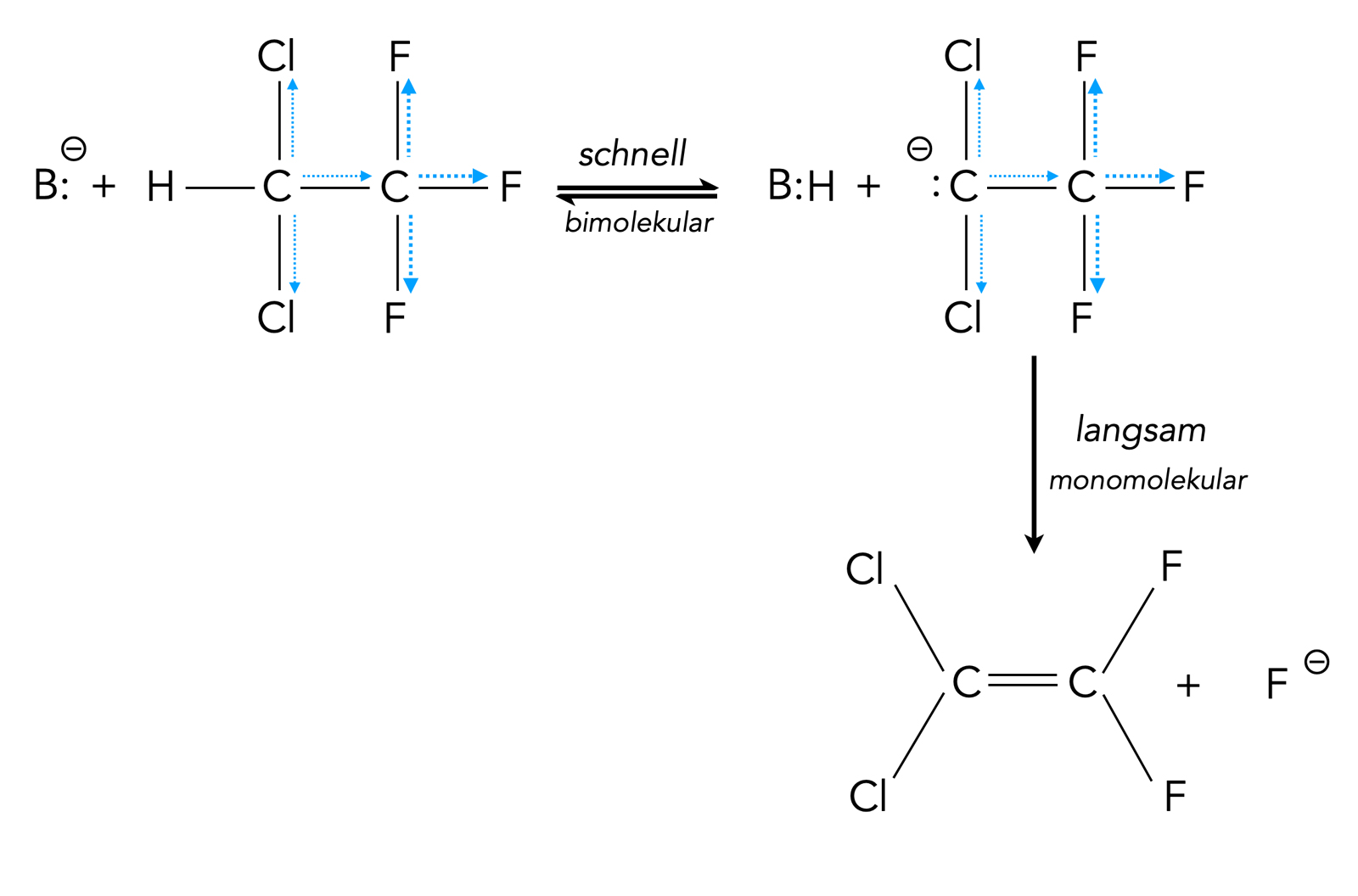
Beispiel für eine E1cB-Reaktion
Autor: Ulrich Helmich 07/2023, nach einer Abbildung aus [6, S. 291], Lizenz: Public domain
Genau das ist auch der Fall. Im ersten Schritt stoßen die Base und das Halogenalkan zusammen, und die Base abstrahiert das Proton, wobei ein Carbanion entsteht. Dieser Schritt ist bimolekular. Allerdings verläuft dieser Schritt relativ schnell, schneller als der zweite Reaktionsschritt. Daher ist er nicht geschwindigkeitsbestimmend.
Das gebildete Carbanion wird in diesem Beispiel durch die fünf Halogen-Atome mit ihrem starken -I-Effekt (blaue Pfeile) stabilisiert.
Der zweite Reaktionsschritt, die Trennung der C-X-Bindung (im Bild eine C-F-Bindung), verläuft dagegen langsam. Dieser monomolekulare Schritt ist dann auch der geschwindigkeitsbestimmende Schitt der Gesamtreaktion, die daher formal monomolekular verläuft.
Zusammenfassung
Bei einer Eliminierung abstrahiert eine Base ein Proton aus dem Halogenalkan. Je nachdem, in welchem Reaktionsschritt diese Protonenabgabe erfolgt, unterscheidet man E1, E2 und E1cB-Eliminierungen
- Entfernung des Protons und Spalten der C-X-Bindung erfolgen gleichzeitig: E2-Mechanismus, bimolekulare Kinetik.
- C-X-Bindung wird zuerst gespalten und erst dann entfernt die Base das Proton: E1-Mechanismus, monomolekulare Kinetik wegen dem langsamen ersten Reaktionsschritt.
- Proton wird von der Base zuerst abstrahiert, und erst dann wird die C-X-Bindung gespalten: E1cB-Mechanismus, monomolekulare Kinetik wegen dem langsamen zweiten Reaktionsschritt.
5.3 Was sagt die Fachliteratur?
Im Buddrus/Schmidt ist den Eliminierungen ein eigenes Kapitel gewidmet, auf E1- und E2-Reaktionen wird ausführlich eingegangen, hier werden auch stereochemische Aspekte berücksichtigt, auf die ich in dieser Studienvorbereitung nicht eingegangen bin. Der Vollhardt/Schore geht sogar noch ausführlicher auf die verschiedenen Eliminierungstypen ein und in einem eigenen großen Abschnitt werden die Faktoren diskutiert, die darüber entscheiden, ob bzw. wann eine Eliminierung bzw. eine Substitution stattfindet.
Auch in den anderen Fachbüchern findet sich ein mehr oder weniger großer Abschnitt über die Eliminierungsreaktionen, auch im Clayden.
5.4 Aufgaben und Übungen
Aufgabe 5.1**
Lässt man 1-Brombutan mit CH3O- reagieren, entsteht das Substitutionsprodukt mit einem Anteil von 90%, das Eliminierungsprodukt zu 10%. Nimmt man als Halogenalkan dagegen 1-Brom-2-methyl-propan, so bilden sich ca. 60% Eliminierungs- und nur 40% Substitutionsprodukt.
Finden Sie eine Erklärung hierfür und begründen Sie Ihre Ausführungen differenziert.
Aufgabe 5.2a***
Bei vielen Eliminierungen können zwei verschiedene Alkene entstehen.
Zeichnen Sie die beiden Reaktionsprodukte, die bei der E2-Eliminierung von 2-Brom-2-methyl-butan entstehen können und erläutern Sie.
Aufgabe 5.2b*
Bei vielen Eliminierungen können zwei verschiedene Alkene entstehen. Das Alken mit den meisten Alkylsubstituenten an der C=C-Doppelbindung wird als Saytzeff-Produkt bezeichnet, das Alken mit den wenigsten Alkylgruppen als Hofmann-Produkt.
Ordnen Sie diese Begriffe den beiden Eliminierungsprodukten von 2-Brom-2-methyl-butan zu.
Aufgabe 5.3*
2-Chlor-3-methyl-pentan wird mit einer starken Base versetzt, so dass eine E2-Reaktion stattfindet.
Zeichnen und benennen Sie das zu erwartende Produkt bzw. die zu erwartenden Produkte.
Aufgabe 5.2**

Die oben gezeigte Verbindung (ein Aldol) wird von einer starken Base angegriffen. Begründen Sie, welches der beiden H-Atome (a) oder (b) bei dieser E1cB-Eliminierung von der Base abstrahiert wird.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schroedel-Band Organische Chemie, Hannover 2003.
Seitenanfang -
Weiter mit den physikalischen Eigenschaften der Halogenalkane...