Inhalt
4.1 Rekapitulation Schulwissen
4.2 Studienvorbereitung
- 4.2.1 Die SN1-Reaktion
- 4.2.2 Die SN2-Reaktion
- 4.2.3 Konkurrenz SN1-SN2
- Verweise auf Spezialseiten
Exkurs: Was sagt ChatGPT?
4.3 Aufgaben und Übungen
4.1 Rekapitulation Schulwissen
Die nucleophile Substitution ist einer der wichtigsten Reaktionsmechanismen der Organischen Chemie und wurde mit Sicherheit in der gymnasialen Oberstufe behandelt. Wir wollen das Wichtigste hier noch einmal kurz rekapitulieren.
Substitution
Unter einer Substitution versteht man den Austausch eines Atoms oder einer Atomgruppe X durch ein anderes Atom oder eine andere Atomgruppe Y, allgemein formuliert also:
$R-X + Y \to R-Y + X$
Nucleophile
Teilchen (Atome, Moleküle, Ionen) werden als Nucleophile bezeichnet, wenn sie von positiven Ladungen angezogen werden. Man unterscheidet anionische Nucleophile wie Br-, OH-, CH3CH2O- und neutrale Nucleophile wie NH3, H2O oder C2H5OH.
Nucleophile Substitution
Unter diesem Begriff versteht man eine Substitution, bei der ein Nucleophil X gegen ein Nucleophil Y ausgetauscht wird. Das Nucleophil X, das bei dieser Reaktion freigesetzt wird, bezeichnet man auch als Nucleofug.
SN1-Substitution
Bei diesem Typ der Nucleophilen Substitution wird im ersten Schritt das Nucleofug X heterolytisch als Anion abgespalten, es bleibt dann ein Carbenium-Ion als Zwischenprodukt zurück. Im zweiten Reaktionsschritt setzt sich das Nucleophil Y an das Carbenium-Ion. Der erste Schritt ist der geschwindigkeitsbestimmende Schritt, weil die Abspaltung des Nucleofugs recht langsam verläuft. Er erfolgt monomolekular, und daher kommt auch die Bezeichnung SN1-Reaktion, die Ziffer 1 steht für den monomolekularen ersten Schritt.
SN2-Substitution
Dieser Typ der Nucleophilen Substitution verläuft in einem Schritt. Das Nucleophil Y wird von dem positiv polarisierten C-Atom angezogen, das mit dem elektronegativen Nucleofug X verbunden ist. Die Bildung der neuen Y-C-Bindung und die Aufspaltung der vorhandenen C-X-Bindung geschieht zeitgleich in einem Schritt. Die Geschwindigkeit dieses einzigen Reaktionsschrittes ist von der Konzentration der beiden Edukte (organisches Substrat R-X und Nucleophil Y) abhängig, die Reaktion verläuft also bimolekular, und daher kommt auch die Bezeichnung SN2-Reaktion.
SN1-SN2-Konkurrenz
Ein organisches Substrat R-X kann theoretisch sowohl nach dem SN1-Mechanismus wie auch nach dem SN2-Mechanismus mit einem Nucleophil reagieren. Allerdings ist es so, dass durch die Wahl des Substrates, durch die Wahl des Nucleophils, durch die Wahl des Lösemittels und durch weitere Reaktionsbedingungen gezielt gesteuert werden kann, welcher der beiden Mechanismen bevorzugt abläuft.
So reagieren primäre Halogenalkane bevorzugt nach dem bimolekularen Mechanismus, während tertiäre Halogenalkane eher nach dem monomolekularen Mechanismus mit Nucleophilen reagieren.
SN1-E1-Konkurrenz
Wenn ein tertiäres Halogenalkan R-X sein Halogen-Atom als Halogen-Anion X- abgibt, bleibt als Zwischenprodukt ein Carbenium-Ion R+ zurück. Dieses kann nun entweder ein Nucleophil Y- anlagern, dann verläuft die Reaktion nach dem SN1-Mechanismus. Alternativ kann das Zwischenprodukt aber auch ein Proton H+ abgeben, dann erhält man ein Alken, und es hat eine sogenannte Eliminierungsreaktion stattgefunden.
All dies und viel mehr können Sie auf den Seiten für die gymnasiale Oberstufe nachlesen, falls Sie noch Fragen haben:
4.2 Studienvorbereitung Top
Wir beginnen unsere Studienvorbereitung ganz "klassisch", indem wir zunächst den monomolekularen SN1-Mechanismus behandeln, dann die bimolekulare SN2-Reaktion und dann die Frage stellen, welche Faktoren einen Einfluss darauf haben, welcher der beiden Wege bei einer konkreten Umsetzung eingeschlagen wird. Dieser wichtige Abschnitt ist so umfangreich, dass er auf mehrere Vertiefungsseiten ausgelagert wurde.
Nach diesen Ausführungen finden Sie Verweise auf Spezialseiten, und dann kommt der große Abschnitt mit Aufgaben und Übungen zur Nucleophilen Substitution.
4.2.1 Die SN1-Reaktion Top
Die folgende Abbildung zeigt den ersten Reaktionsschritt der SN1 - Reaktion eines Halogenalkans, nämlich von 2-Brombutan.
4.2.1.1 Schritt 1
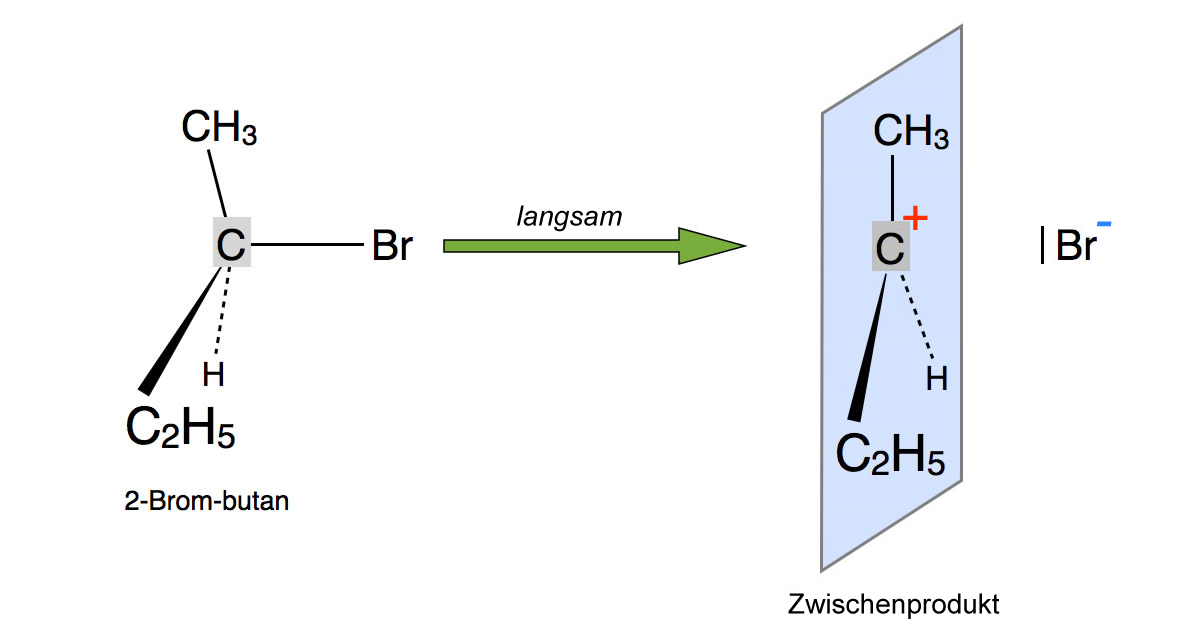
Der erste Schritt der SN1-Reaktion von 2-Brom-butan mit Iodid
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Das 2-Brombutan-Molekül zerfällt spontan in ein tertiäres Carbenium-Ion und ein Bromid-Anion. Da dieser Reaktionsschritt mit der Spaltung der kovalenten C-Br-Bindung verbunden ist, ist seine Aktivierungsenergie recht hoch, und entsprechend langsam verläuft dieser Schritt 1.
Achten Sie darauf, dass das Zwischenprodukt, also das Carbenium-Ion, eine planare Struktur besitzt. Das positiv geladene C-Atom ist sp2-hybridisiert, die beiden Lappen des pz-Orbitals (hier nicht eingezeichnet) ragen nach links und rechts aus der blau gekennzeichneten Ebene heraus.
4.2.1.2 Schritt 2
Das Zwischenprodukt ist ein planares Carbenium-Ion, ein Nucleophil kann das Carbenium-Ion also von zwei Seiten mit gleicher Wahrscheinlichkeit angreifen:
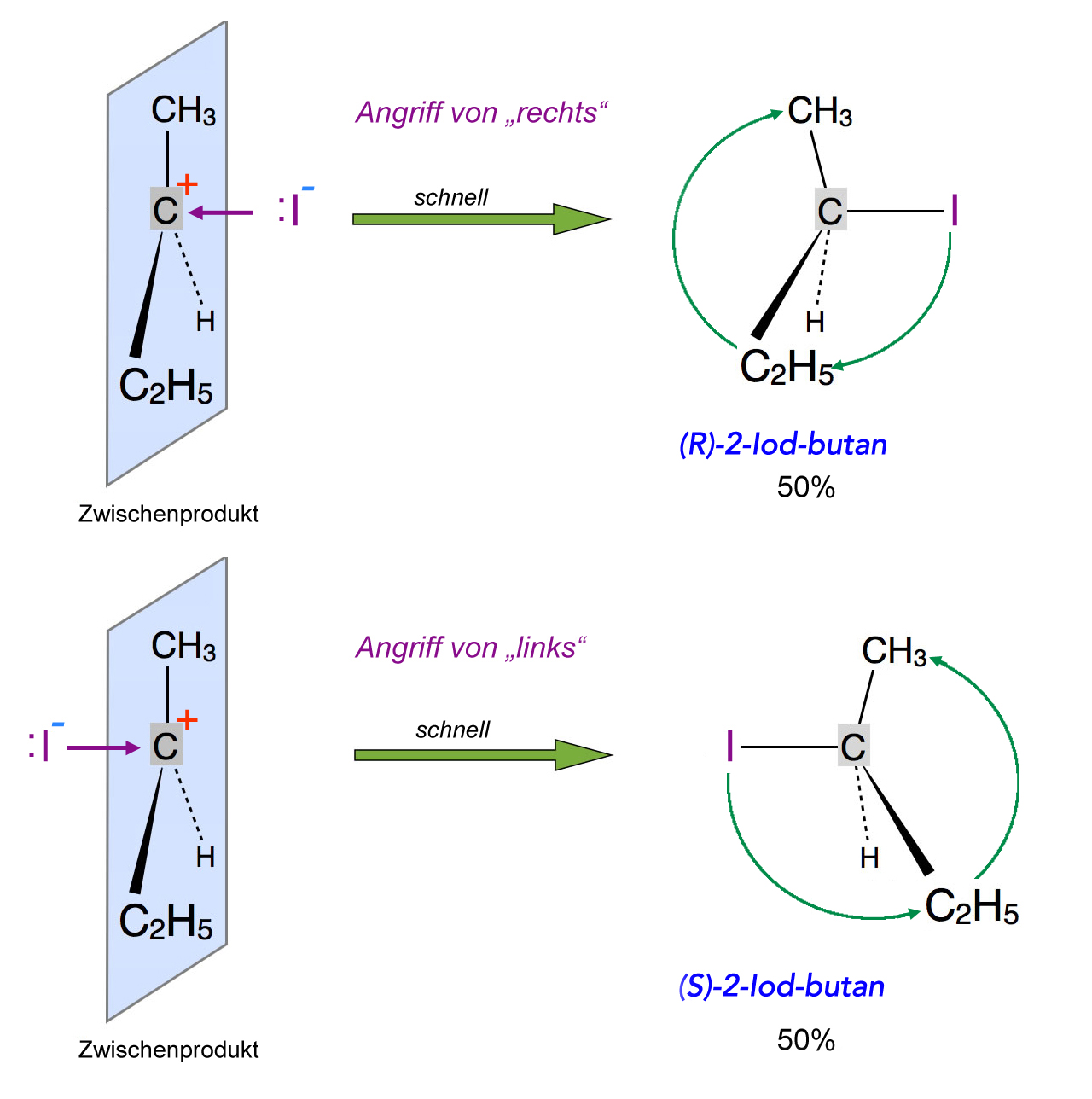
Angriff eines Nucleophils auf das Carbenium-Ion liefert ein 50:50 Racemat
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
In beiden Fällen entsteht als Reaktionsprodukt 2-Iodbutan. Allerdings unterscheiden sich die beiden Produkte wie Bild und Spiegelbild, es handelt sich um Enantiomere (Spiegelbild-Isomere).
Greift das Iodid-Ion von "rechts" an, so entsteht 2-Iodbutan in der R-Konfiguration.
Greift das Nucleophil dagegen von "links" an, bildet sich 2-Iodbutan in der S-Konfiguration. Die Begriffe "R- bzw. S-Konfiguration" werden in dem Kasten weiter unten erklärt.
Da die Wahrscheinlichkeit eines Angriffs von links und rechts gleich groß ist - zumindest wenn das Carbenium-Ion einigermaßen symmetrisch aufgebaut ist - erhält man gleich viel von jeder Konfiguration, es entsteht also ein Racemat. Ein Racemat liegt immer dann vor, wenn beide Spiegelbild-Isomere in gleichen Anteilen vorhanden sind.
Ermittlung der R/S-Konfiguration:
Man dreht das Molekül(modell) so, dass der Substituent mit der niedrigsten Priorität nach hinten weist. In unserem Fall ist das das H-Atom (Ordnungszahl 1).
Die anderen drei Substituenten verbindet man jetzt in der Reihenfolge ihrer Priorität (absteigend!) mit Pfeilen. Das Iod-Atom hat wegen seiner hohen Ordnungszahl die höchste Priorität. Dann kommt die Ethylgruppe mit zwei C-Atomen und schließlich die Methylgruppe mit nur einem C-Atom.
Kleine Denkaufgabe:
Welchen Namen hätte die untere (S)-Verbindung, wenn die Methylgruppe durch eine Aminogruppe ersetzt würde?
Antwort:
Stickstoff hat eine höhere Priorität als Kohlenstoff, weil die Ordnungszahl von Stickstoff 7 ist, die von Kohlenstoff aber nur 6. Also müsste das Iod-Atom zunächst mit dem Stickstoff-Atom verbunden werden und dann erst mit der Ethylgruppe. Wir hätten dann (R)-1-Amino-1-Iod-ethan vorliegen.
Der Schritt 2 der SN1-Reaktion besteht in der Bildung einer neuen kovalenten Bindung. Eine solche Bindungsbildung ist stets exotherm und hat eine recht niedrige Aktivierungsenergie. Daher verläuft dieser Schritt recht schnell.
4.2.1.3 Energiebetrachtungen
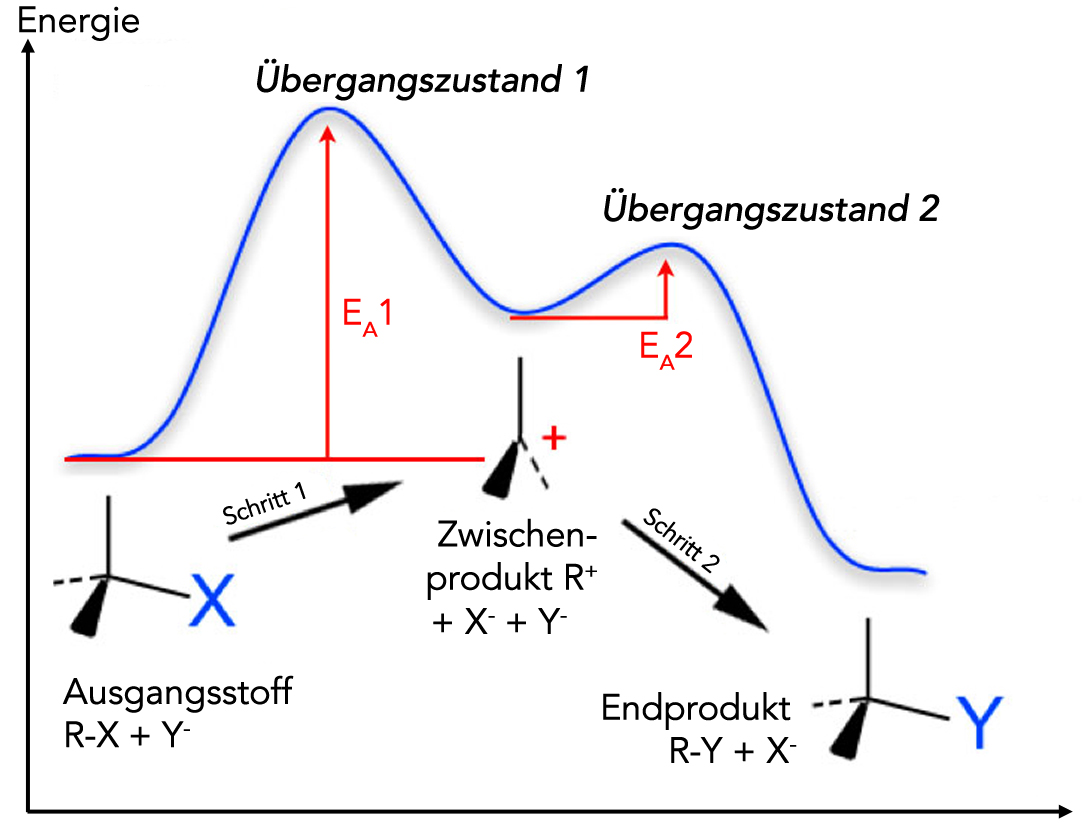
Energiediagramm einer SN1-Reaktion
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Auf diesem Bild sehen wir das Energiediagramm einer SN1-Reaktion. Das Edukt R-X reagiert mit einem anionischen Nucleophil Y- zum Produkt R-Y.
- Der erste Reaktionsschritt hat eine recht hohe Aktivierungsenergie EA1, weil eine Bindung gespalten werden muss.
- Als Zwischenprodukt entsteht ein Carbenium-Ion.
- Der zweite Reaktionsschritt besteht in der Bildung einer neuen Bindung. Daher ist hier die Aktivierungsenergie EA2 recht niedrig. Außerdem ist der zweite Schritt stark exotherm weil eine neue Bindung entsteht.
Der monomolekulare erste Schritt bestimmt wegen seiner hohen Aktivierungsenergie die Geschwindigkeit der Gesamtreaktion, der erste Schritt ist der geschwindigkeitsbestimmende Schritt.
Allerdings ist die Gesamtreaktion nicht monomolekular, sondern nur pseudomonomolekular - es sind ja immer noch zwei Edukte an der Reaktion beteiligt.
4.2.2 Die SN2-Reaktion Top
4.2.2.1 Ein Überblick
Betrachten wir eine SN2-Reaktion näher, um erste Hinweise auf einen möglichen Reaktionsmechanismus zu bekommen:
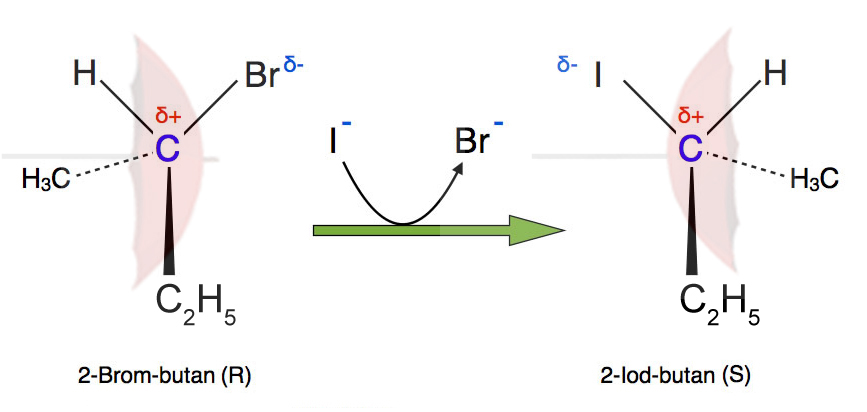
Reaktion von 2-Brom-butan zu 2-Iod-butan
Autor: Ulrich Helmich 2020, nach einer Tafelzeichnung von Prof. G. Dyker; Vorlesung "Organische Chemie" an der Ruhr-Universität Bochum 2012. Lizenz: Public domain.
Das Halogenalkan 2-Brombutan reagiert mit Iodid-Ionen zu 2-Iodbutan und Bromid-Ionen - und zwar in einem Schritt, der bimolekular verläuft. Die Geschwindigkeit dieser Reaktion hängt also sowohl von c(2-Brombutan) wie auch von c(I-) ab:
vr = k * c(2-Brombutan) * c(I-)
4.2.2.2 Die Walden-Inversion
Achten Sie nun bitte auf die Geometrie der Strukturformeln. Es hat nämlich eine sogenannte Inversion stattgefunden, eine Umkehrung der räumlichen Struktur.
Das Brom-Atom im Edukt ist in der Abbildung nach rechts ausgerichtet, das Iod-Atom im Produkt aber nach links. Auch die Methylgruppe und das Wasserstoff-Atom haben ihre Position verändert. Das Produkt sieht fast so aus wie das Spiegelbild des Edukts.
Diese Inversion der Raumstruktur ist typisch für eine SN2-Reaktion. Entdeckt hat sie Paul Walden (1863-1957), darum wird sie auch Walden-Inversion oder Walden-Umkehr genannt.
4.2.2.3 Bildung des Übergangszustandes
Kommen wir nun zu der Frage, wieso das Substrat bei der Reaktion umklappt und sich in sein Spiegelbild verwandelt? Was passiert am chiralen C-Atom, wenn das Iodid-Ion als Nucleophil angreift?
Wir betrachten dazu wieder die Reaktion von 2-Brombutan mit Iodid-Ionen.
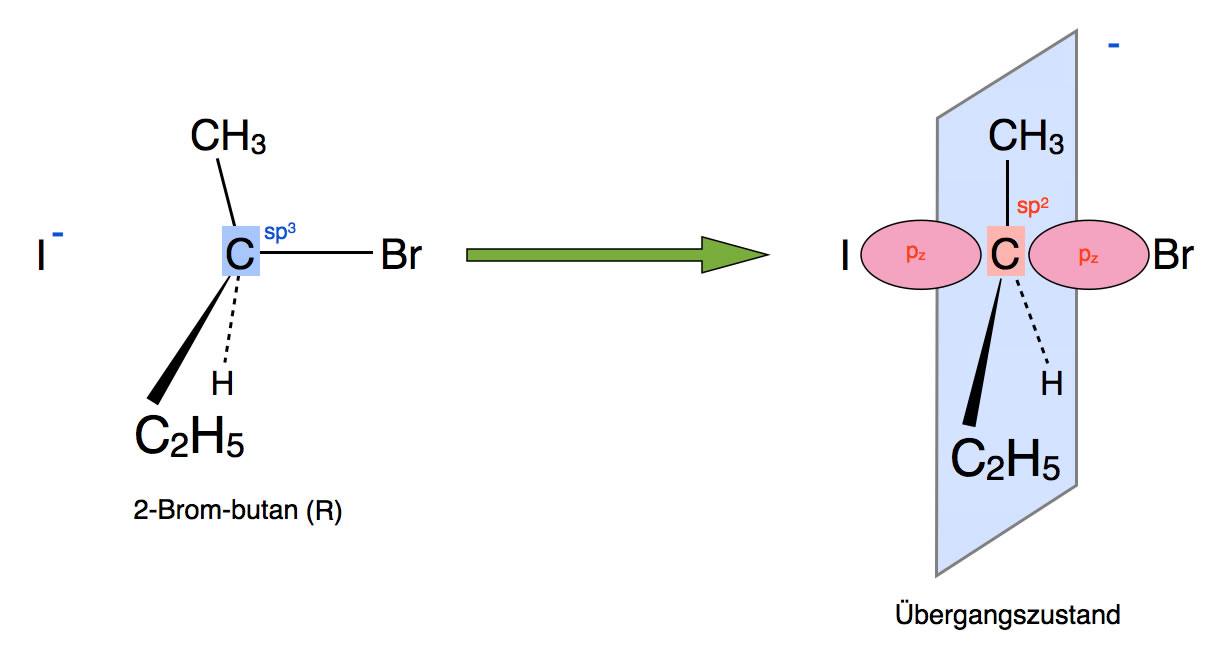
Die Bildung des Übergangszustandes
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Wie man auf dem Bild sehen kann, nähert sich das Iodid-Ion dem Substrat von der Rückseite. Es handelt sich um einen typischen Rückseitenangriff, wie wir ihn schon bei der Bromierung von Alkenen gesehen haben.
Wieso findet ein solcher Rückseitenangriff statt?
Die folgenden Überlegungen beziehen sich jetzt stets auf die nächste Abbildung.
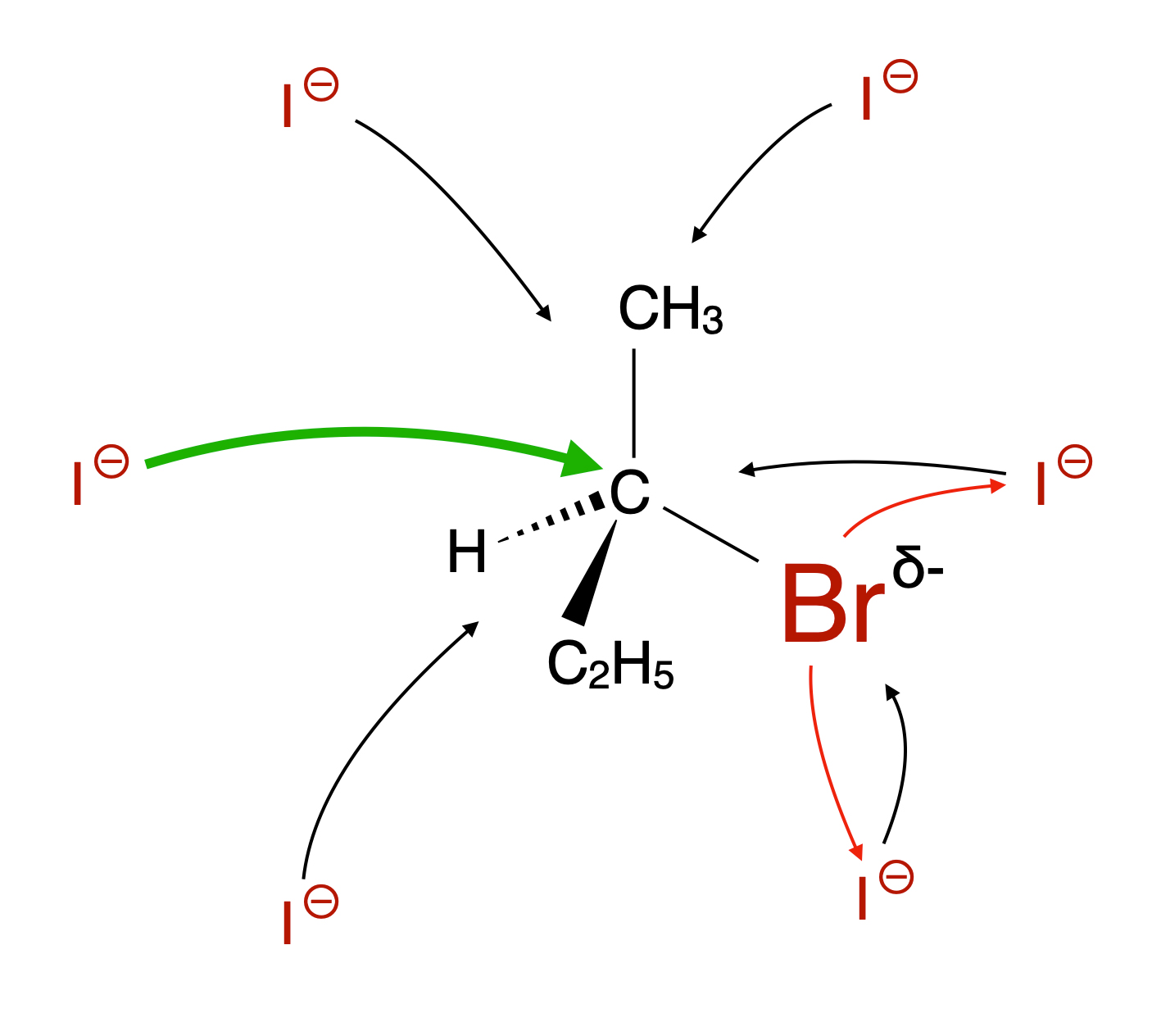
Unterschiedliche "Einflugwinkel" des Nucleophils
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
- Angenommen, das Iod-Anion würde das Molekül von "oben" angreifen. Dann müsste es an der Methylgruppe vorbeikommen, was nicht so ganz einfach ist.
- Wenn das Iod-Anion das Molekül von "unten" angreifen würde, wäre die Sache noch ungünstiger. Die Ethylgruppe ist größer als die Methylgruppe, ein Angriff von dieser Seite wäre also noch unwahrscheinlicher.
- Nun könnte das Iod-Anion ja auch von "rechts" angreifen. Dummerweise ist das Brom-Atom nicht nur sehr groß, sondern trägt auch noch eine negative Teilladung, wegen der hohen Elektronegativität von Brom. Es würde also nicht nur eine sterische Hinderung stattfinden (durch die Größe des Br-Atoms), sondern das negativ geladene Nucleophil würde auch noch elektrisch abgestoßen (was durch die roten Pfeile angedeutet wird).
Die Annäherung von links - also durch einen Rückseitenangriff - hat also die größte Wahrscheinlichkeit auf Erfolg.
Was hat es mit dem Übergangszustand auf sich?
Wenn sich das Iodid-Ion dem Substrat von der Rückseite weit genug angenähert hat, bildet sich ein instabiler Übergangszustand:
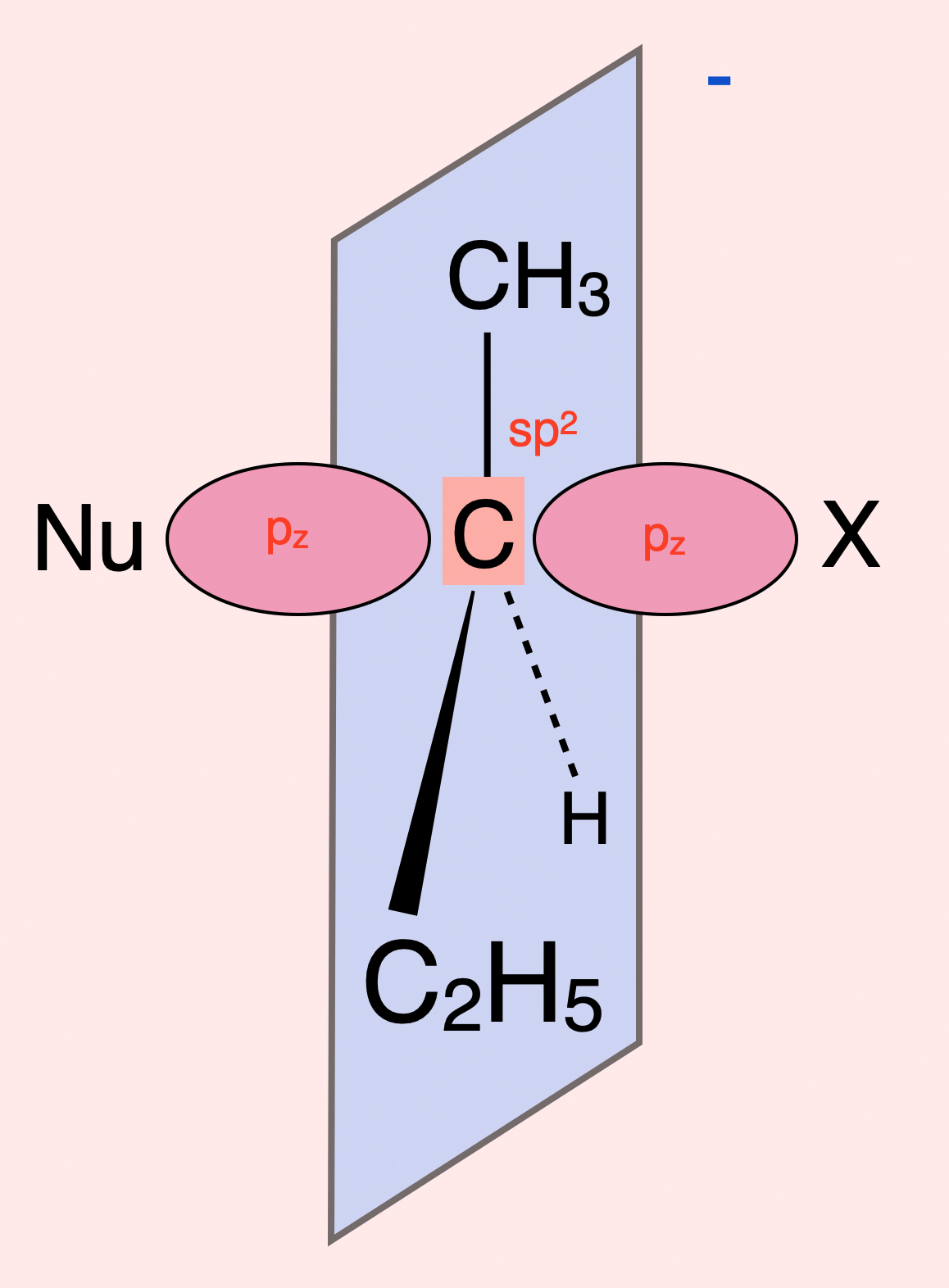
Der Übergangszustand einer SN2-Reaktion
Autor: Ulrich Helmich 2020, Lizenz: Public domain
Dieser Übergangszustand wird als pentavalent (fünfwertig) bezeichnet.
Das mittlere C-Atom ist sp2-hybridisiert, die drei assoziierten Substituenten liegen daher in einer Ebene. Die beiden Lappen des pz-Orbitals ragen nach links und rechts aus dieser Ebene heraus. Das pz-Orbital nimmt dann auf der linken Seite Kontakt mit einem Orbital des Nucleophils Nu auf, und hält auf der rechten Seite noch Kontakt mit dem Nucleofug X.
Hybridisierungswechsel
Bei dem Übergang vom sp3-hybridisierten Zustand in den sp2-hybridisierten Zustand sind zwei energetisch bedeutsame Faktoren zu berücksichtigen:
Faktor 1: Der Hybridisierungswechsel ist einerseits mit einem gewissen Energieaufwand verbunden. Je größer die Reste sind, die an dem zentralen C-Atom sitzen, desto größer wird der Energieaufwand für das "Umklappen".
Faktor 2: Alkylgruppen stoßen sich gegenseitig elektrostatisch ab.
Das haben wir beispielsweise bei den Konformationen des Ethan-Moleküls gesehen, die gestaffelte Konformation hat eine etwas geringere Energie als die verdeckte Konformation.
Daher ist es energetisch günstiger, wenn die Alkylgruppen einen möglichst großen Abstand voneinander haben. Im sp2-hybridisierten Zustand ist dieser Abstand wegen der flacheren Bindungswinkel von 120º etwas größer als im sp3-hybridisierten Zustand mit Bindungswinkeln von 109,5º.
Insgesamt überwiegt in der Regel der Faktor 2 (Abstoßung der Alkylgruppen), so dass die Bildung des pentavalenten Übergangszustands erleichtert wird.
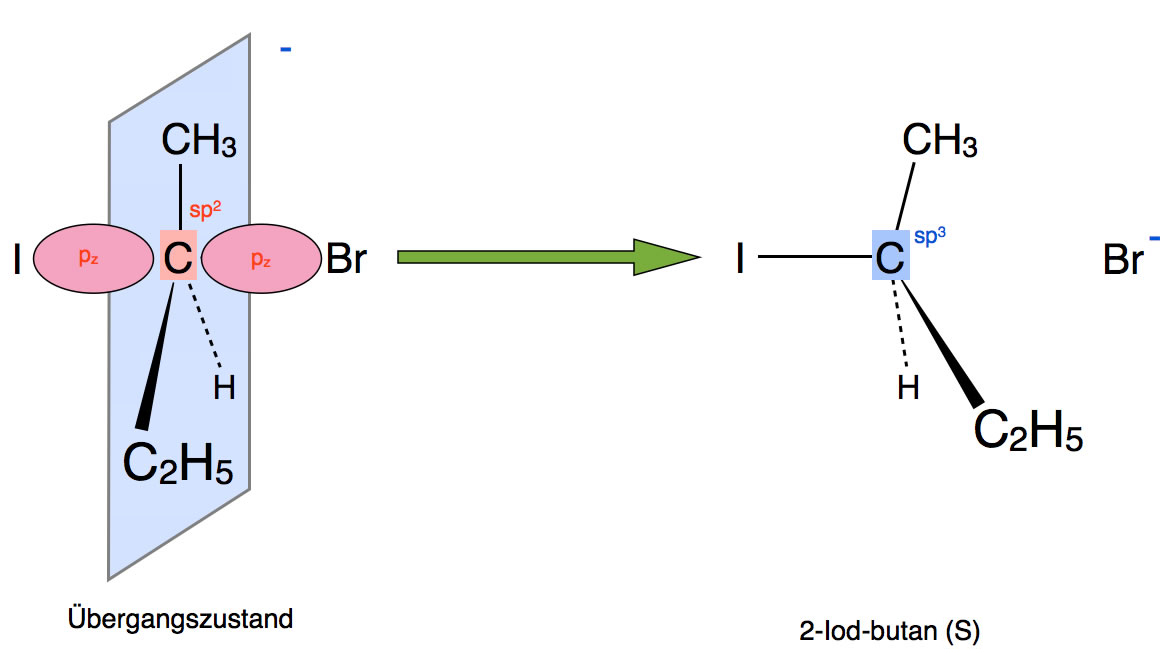
Die Bildung des Endproduktes
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Bei der Bildung des Endproduktes geht das zentrale C-Atom wieder in den sp3-hybridisierten Zustand über. Dabei kommt es dann zur Walden-Umkehr bzw. zur Inversion der Raumstruktur.
4.2.3 Konkurrenz SN2 - SN1 Top
Welcher Mechanismus tatsächlich stattfindet, hängt von vier Hauptfaktoren ab, wie wir näher untersuchen wollen:
- Substrat
- Lösemittel
- Nucleophil
- Nucleofug
Aber auch dann, wenn man alle Einflussfaktoren kennt, kann letzten Endes nur das Experiment darüber Aufschluss geben, welcher Mechanismus tatsächlich abläuft. Im Idealfall reichen hier reaktionskinetische Untersuchungen aus: Hängt die Geschwindigkeit der Reaktion NUR von dem organischen Substrat ab oder von dem Substrat UND dem Nucleophil? Außerdem kann man stereochemische Untersuchungen durchführen: Kommt es bei chiralen Molekülen durch die Substitution zu einer Walden-Umkehr oder nicht?
Zwischen der "reinen" SN1-Reaktion und der "reinen" SN2-Reaktion gibt es noch die Möglichkeit, dass beide Mechanismen gleichzeitig ablaufen. Das Konzept der Ionenpaare beleuchtet diese Möglichkeiten etwas genauer.
Es gibt langlebige, stabile Carbenium-Ionen und kurzlebige. Die Lebensdauer eines Carbenium-Ions hat entscheidenden Einfluss auf den genauen Verlauf der SN1- bzw. SN2-Reaktion.
Exkurs: Was sagt ChatGPT? Top
Ich habe mir einmal den Spaß gemacht, ChatGPT zu bitten, mir eine Zusammenfassung dieser Seite zu erstellen. Das Ergebnis möchte ich Ihnen nicht vorenthalten. Danach werde ich die Aussagen von ChatGPT kritisch analysieren.
Zusammenfassung
- Halogenalkane sind organische Verbindungen, bei denen ein oder mehrere Wasserstoffatome in einem Kohlenwasserstoffmolekül durch Halogenatome (wie Chlor, Brom oder Iod) ersetzt sind.
Die Nomenklatur der Halogenalkane folgt bestimmten Regeln, um sie eindeutig zu benennen und zu identifizieren. - Halogenalkane weisen aufgrund der Anwesenheit von Halogenatomen spezifische physikalische Eigenschaften auf, wie eine höhere Siede- und Schmelzpunkte im Vergleich zu nicht halogenierten Kohlenwasserstoffen.
- Die Reaktivität von Halogenalkanen basiert auf der Polarität der Kohlenstoff-Halogen-Bindung. Die C-X-Bindung ist polarisiert, wodurch das Halogenatom elektrophil und das Kohlenstoffatom elektrophob wird.
- Halogenalkane können an verschiedenen chemischen Reaktionen beteiligt sein, wie nukleophilen Substitutionen, Eliminierungen oder Reaktionen mit Metallorganischen Verbindungen.
- Bei nukleophilen Substitutionen können Halogenalkane ein Nukleophil durch ein Halogenatom ersetzen, wobei unterschiedliche Reaktionsmechanismen wie SN1 oder SN2 auftreten können.
- Eliminierungsreaktionen können dazu führen, dass das Halogenatom und ein benachbarter Wasserstoff entfernt werden, wodurch eine Doppelbindung oder ein Ringsystem gebildet wird.
ChatGPT am 10. Juni 2023, Antwort auf die Bitte "Fasse bitte die wichtigsten Aussagen dieser Webseite zusammen."
Gehen wir nun diese einzelnen Punkte durch.
- Die erste Aussage ist korrekt, mit dem letzten Satz zur Nomenklatur kann man allerdings nichts anfangen.
- Die zweite Aussage ist richtig, wenn man mal von kleinen grammatischen Fehlern absieht.
- Bei der dritten Aussage sind die Begriffe "elektrophil" und "elektrophob" unüblich bzw. falsch, außerdem werden hier Ursache und Wirkung verwechselt. Die C-X-Bindung ist polarisiert, weil das Halogen-Atom eine höhere Elektronegativität aufweist als das Kohlenstoff-Atom, davon liest man hier allerdings nichts.
- Die vierte Aussage ist nicht falsch, allerdings schreibe ich auf dieser Seite nichts von metallorganischen Verbindungen. Das hat ChatGPT dazu erfunden.
- Die fünfte Aussage ist völliger Blödsinn. Das Halogen-Atom wird durch ein Nucleophil ersetzt und nicht umgekehrt, obwohl die Abgangsgruppe selbst natürlich auch ein Nucleophil sein kann.
- Die letzte Aussage ist wieder korrekt, allerdings wird der Punkt auf dieser Seite kaum erwähnt, gehört also nicht in eine Zusammenfassung.
Insgesamt sind die Ausführungen von ChatGPT also teils korrekt, teils schwammig, teils falsch. Außerdem werden für diese Zusammenfassung auch die anderen Seiten der Abteilung "Halogenalkane" ausgewertet, ChatGPT sollte sich aber auf genau diese eine Seite konzentrieren. Auf die nucleophile Substitution geht ChatGPT hier aber so gut wie nicht ein.
Für Schüler und Studenten ist es also keine gute Idee, eine Hausarbeit oder Seminararbeit einfach von ChatGPT verfassen zu lassen. Als Ideen-Lieferant ist die KI dagegen durchaus gut geeignet, wenn man vor einem leeren Blatt Papier sitzt und einem kein Anfang einfällt.
4.3 Aufgaben und Übungen Top
Die folgenden Aufgaben habe ich mir teils selbst ausgedacht, teils stammen sie aus der Fachliteratur und Vorlesungen zur Organischen Chemie. Lösungsvorschläge zu diesen Aufgaben können Sie von mir erhalten, dann würde ich mich aber über eine kleine Spende per PayPal freuen (ab 2 Euro). Geben Sie dann bei PayPal unbedingt Ihre Mail-Adresse mit an, damit ich weiß, wohin ich die PDF-Datei schicken soll. Und vergessen Sie nicht den Verwendungszweck: Lösungen zu den Aufgaben OC 4.3.
Ein Arbeitsblatt mit diesen Aufgaben können Sie kostenlos hier herunterladen.
Aufgabe 4.1**
Chlorethan wird mit Kaliumiodid versetzt. Dabei kommt es zur Bildung von Iodethan und Kaliumchlorid.
Entscheiden Sie begründend, ob es bei dieser Reaktion zu einer Walden-Inversion kommt oder nicht.
Aufgabe 4.2**
Welche Reaktionsprodukte würden Sie erwarten, wenn man cis-4-Chlor-Methyl-cylohexan mit Kaliumiodid umsetzt? Gehen Sie dabei auch auf die Stereochemie der Reaktion ein (Inversion? Stereoisomere?).
Aufgabe 4.3***
S-2-Chlorbutan wird mit Kaliumiodid versetzt. Im Reaktionsprodukt findet man bei einer Analyse 30% S-2-Iodbutan und 70% R-2-Iodbutan.
Analysieren Sie dieses Ergebnis und stellen Sie Ihre Schlussfolgerungen dar!
Aufgabe 4.4****
Bromid ist eine bessere Abgangsgruppe als Chlorid. Die Verbindung S-1-Brom-1-chlorethan wird mit einem Überschuss an Kaliumiodid versetzt. Der verantwortliche Chemiker, der diese Reaktion angesetzt hat, wird durch einen wichtigen Anruf abgelenkt und kommt erst nach ein paar Stunden wieder zurück. Weil er befürchtet, dass die Reaktion nicht ordnungsgemäß stattgefunden hat, analysiert er das Reaktionsprodukt. Er findet 50% S-1-Iod-1-chlorethan und 50% R-1-Iod-1-chlorethan.
Diese Analyse deutet auf einen SN1-Verlauf, was den Chemiker aber stark verwirrt, denn er ist sicher, dass das primäre Halogenalkan nach dem SN2-Mechanismus reagiert.
Erklären Sie, was hier schief gegangen ist und warum!
Aufgabe 4.5****
Wieso läuft folgende Reaktion NICHT ab:
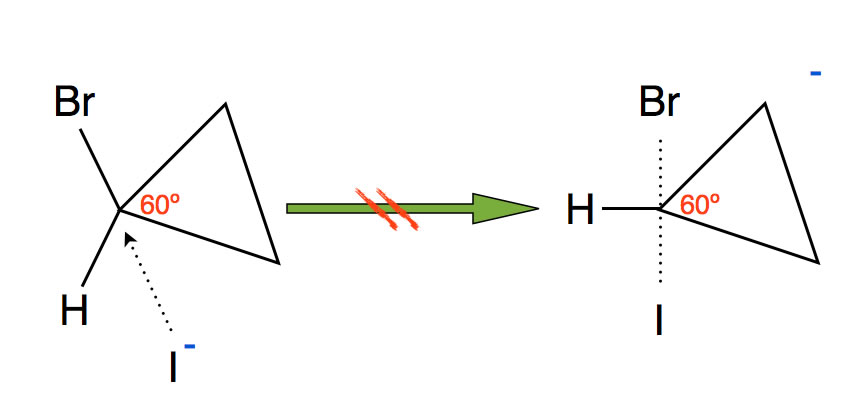
Die Reaktion von Iodid-Ionen mit Brom-Cyclopropan läuft nicht ab
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Aufgabe 4.6*****
Brom-cylohexan liegt in zwei verschiedenen Sessel-Konformationen vor:
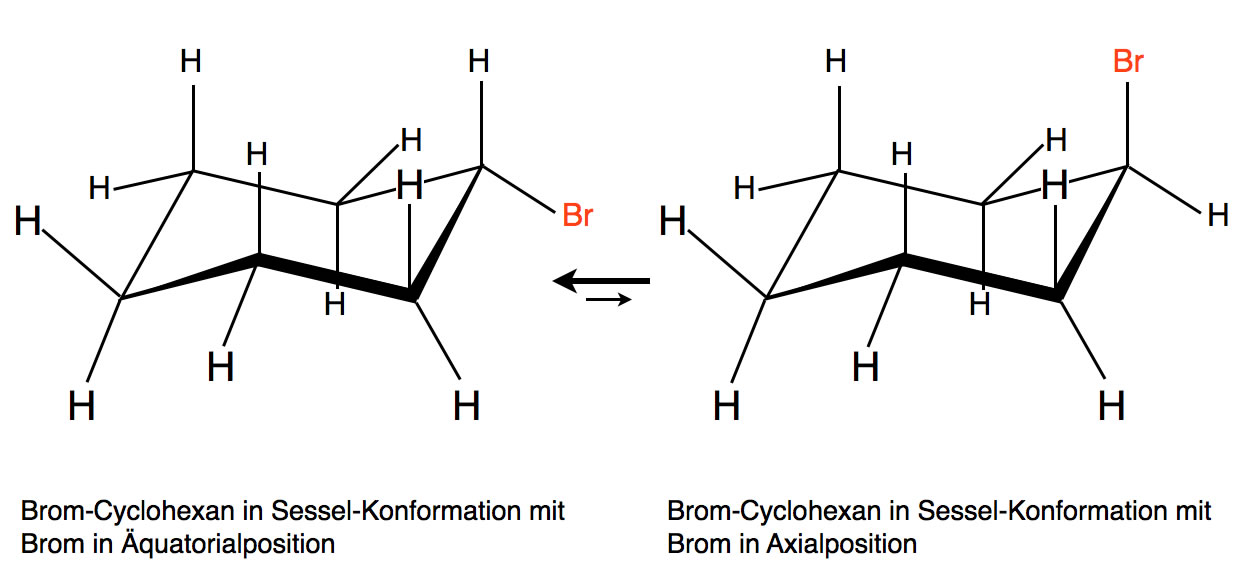
Brom-Cyclohexan in zwei verschiedenen Sessel-Konformation
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Das Gleichgewicht liegt auf der Seite mit dem Brom-Atom in der sogenannten Äquatorialposition.
Eine SN1-Umsetzung mit Iodid-Ionen sollte eigentlich recht schnell verlaufen, alle Voraussetzungen sind dafür erfüllt. Trotzdem findet man, dass die Reaktion sehr langsam verläuft.
Finden Sie hierfür eine Ursache.
Aufgabe 4.7****
Findet eine Substitution nach dem SN2-Mechanismus an einem chiralen C-Atom statt, ist wegen der Walden-Umkehr klar, dass ein Rückseitenangriff stattgefunden haben muss.
Wie kann man diesen Rückseitenangriff aber bei einem Substrat nachweisen, das kein chirales C-Atom besitzt, zum Beispiel beim Chlorethan?
Aufgabe 4.8***
Wie könnte man es schaffen, eine SN2-Reaktion durchzuführen, ohne dass eine Inversion auftritt?
Aufgabe 4.9**
Das Cycloalkan Ethyl-cyclopentan wird in einer radikalischen Substitution bromiert, man erhält mehrere Reaktionsprodukte, unter anderem ein trans-1-Brom-3-ethyl-cyclopentan:
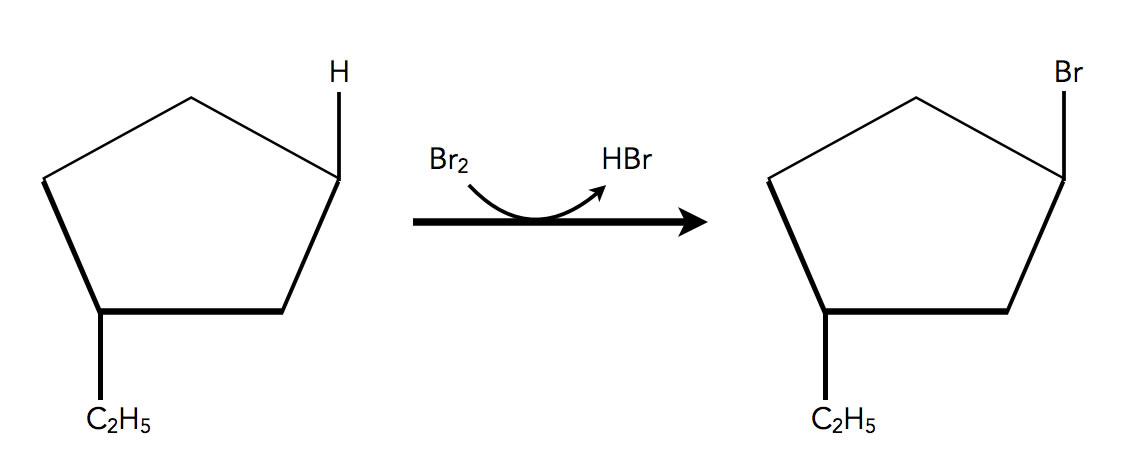
Bildung von trans-1-Brom-3-ethyl-cyclopentan durch radikalische Bromierung
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Welches Reaktionsprodukt würden Sie erwarten, wenn man das trans-1-Brom-3-ethy-cyclopentan in einer SN2-Reaktion mit Natriumiodid reagieren lässt?
Aufgabe 4.10***
Setzt man in Methanol gelöstes Brom-methan mit Natriumiodid um, erhält man Iod-methan und Natriumbromid in einer SN2-Reaktion. Die Reaktionsgeschwindigkeit dieser Umsetzung wird gemessen und auf den Wert 100 gesetzt (ein rein willkürlicher Vergleichswert!).
Ersetzt man nun in einem zweiten Versuch das Lösemittel Methanol durch das Lösemittel Aceton, so verläuft die Reaktion ca. 500 mal schneller!
Finden Sie eine Erklärung für diese enorme Beschleunigung der Reaktion!
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schmuck, Basisbuch Organische Chemie, 2. Auflage, Pearson-Verlag 2018.