5.1 Rekapitulation Schulwissen
Experimentelle Untersuchungen der C=C-Doppelbindung haben gezeigt, dass die beiden Bindungen energetisch nicht gleichwertig sind. Die eine Bindung ist eine ganz normale kovalente Bindung, ist also recht stark, ähnlich wie eine C-C-Einfachbindung. Die andere Bindung ist aber wesentlich schwächer, die beiden Bindungselektronen sind hier deutlich schwächer gebunden. Das ist der Grund für das chemische Verhalten der C=C-Doppelbindung, die ja als "elektronenreich" gilt und von Nucleophilen "geliebt" wird.
Die starke C-C-Bindung wird als sigma-Bindung bezeichnet, die schwache C-C-Bindung als pi-Bindung. Mit dem Kugelwolkenmodell kann man das Zustandekommen dieser beiden unterschiedlichen Bindungen nur schlecht erklären.
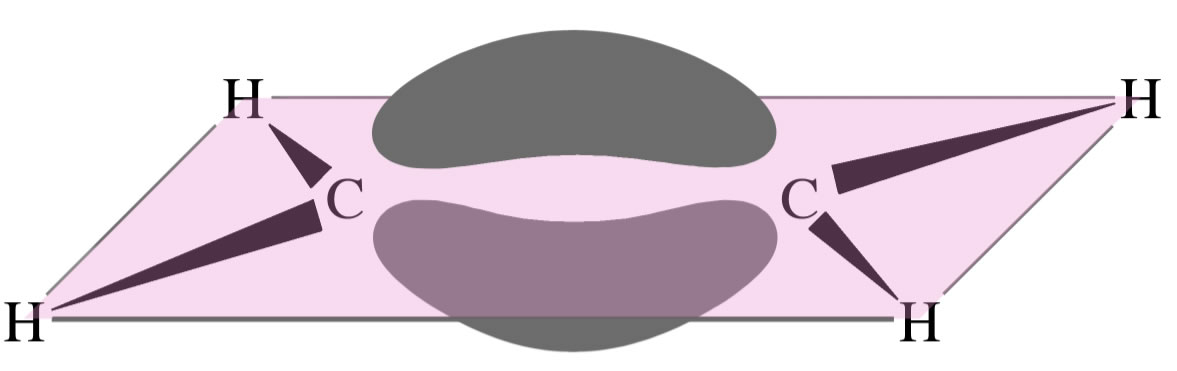
Das Ethen-Molekül mit "Bananenbindungen"
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Hier sehen wir das Ethen-Molekül mit zwei kovalenten Bindungen, die sich gegenseitig abstoßen und daher wie zwei Bananen aussehen, man spricht hier in der Tat von einer "Bananenbindung".
5.2 Studienvorbereitung
Experimentelle Untersuchungen der C=C-Doppelbindung haben gezeigt, dass die beiden Bindungen energetisch nicht gleichwertig sind. Die eine Bindung ist eine ganz normale kovalente Bindung, ist also recht stark, ähnlich wie eine C-C-Einfachbindung. Die andere Bindung ist aber wesentlich schwächer, die beiden Bindungselektronen sind hier deutlich schwächer gebunden. Das ist der Grund für das chemische Verhalten der C=C-Doppelbindung, die ja als "elektronenreich" gilt und von Nucleophilen "geliebt" wird.
Die starke C-C-Bindung wird als sigma-Bindung bezeichnet, die schwache C-C-Bindung als pi-Bindung. Mit dem Kugelwolkenmodell kann man das Zustandekommen dieser beiden unterschiedlichen Bindungen nicht erklären. Nach diesem Modell müssten beide Bindungen gleich stark sein, allerdings deutlich schwächer als eine C-C-Einfachbindung, da sich die Kugelwolken bei der Doppelbindung nicht mehr so stark überlappen wie bei der Einfachbindung.
Mit dem Orbitalmodell und sp3-hybridisierten C-Atomen kann man die C=C-Doppelbindung auch nicht besser erklären. Würde man hier ein Bild zeichnen, sähe dies genau so aus wie das Bild oben in der Kugelwolkenmodell-Darstellung, denn die sp3-Hybridorbitale haben fast die gleiche Gestalt wie die Kugelwolken des Kugelwolkenmodells.
5.2.1 Die sp2-Hybridisierung
Um die Existenz zweier verschiedener C-C-Bindungen in der C=C-Doppelbindung zu erklären, musste man das Konzept der Hybridisierung noch stärker verfeinern. Neben der sp3-Hybridisierung gibt es auch eine sp2-Hybridisierung und eine sp-Hybridisierung:
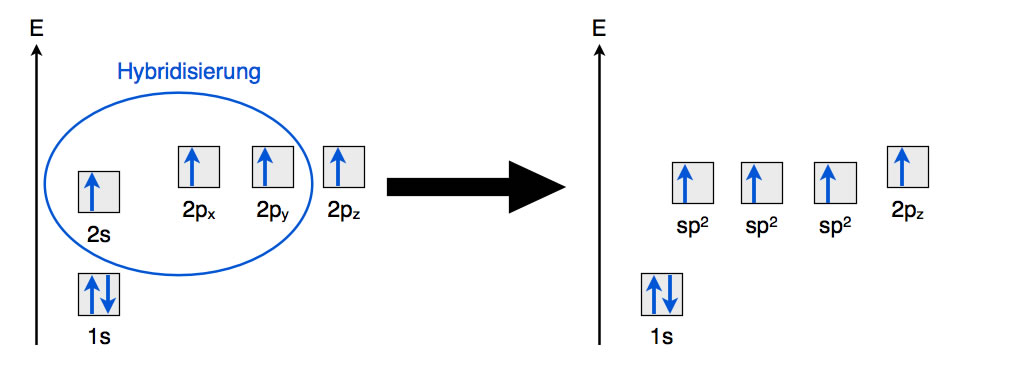
Die sp2-Hybridisierung im Energiediagramm
Autor: Ulrich Helmich, Lizenz: Public domain
Bei der sp2-Hybridisierung wird das 2s-Orbital das Kohlenstoff-Atoms mit nur zwei 2p-Orbitalen "vermischt", es resultieren drei energetisch gleichwertige sp2-Hybridorbitale. Übrig bleibt ein unverändertes 2pz-Orbital.
5.2.2 Die sigma-Bindung
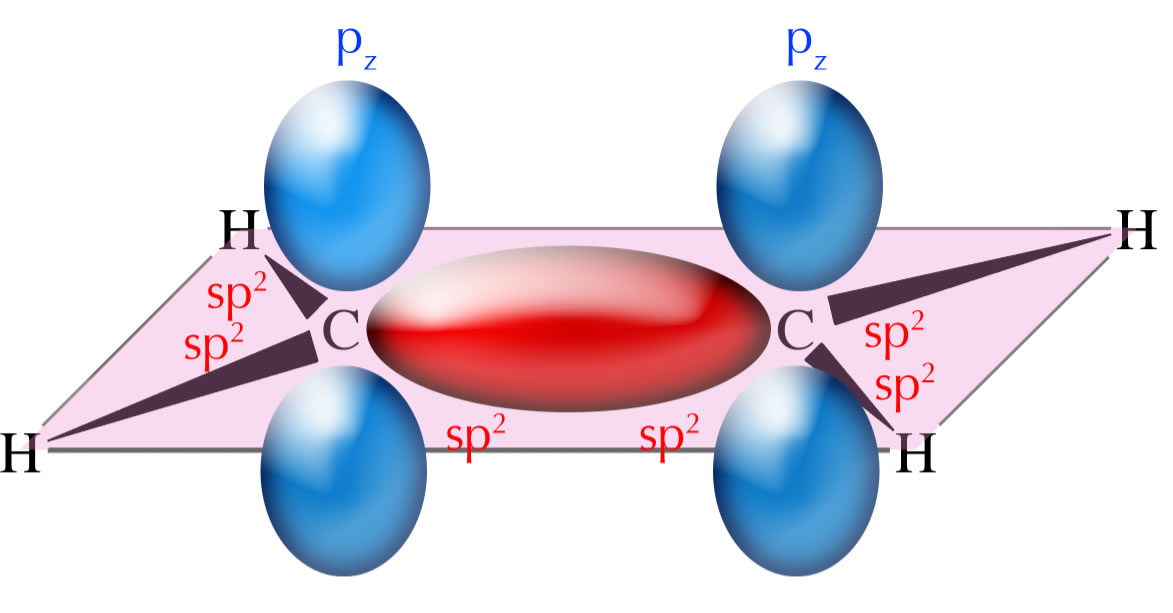
Die C=C-Doppelbindung: Die sigma-Bindung
Autor: Ulrich Helmich, Lizenz: Public domain
In dieser Abbildung sehen wir das Ethen-Molekül mit seinen zwei sp2-hybridisierten C-Atomen. Die sp2-Hybridorbitale überlappen mit den 1s-Orbitalen der vier H-Atome. Die sigma-Bindung - im Bild rot gezeichnet - entsteht durch Überlappung von sp2-Hybridorbitalen der benachbarten C-Atome. Die pz-Orbitale - im Bild blau gezeichnet - stehen senkrecht aus der Ebene hervor. Jedes pz-Orbital besteht aus zwei Orbitallappen, je einer unterhalb der Ebene und oberhalb der Ebene.
5.2.3 Die pi-Bindung
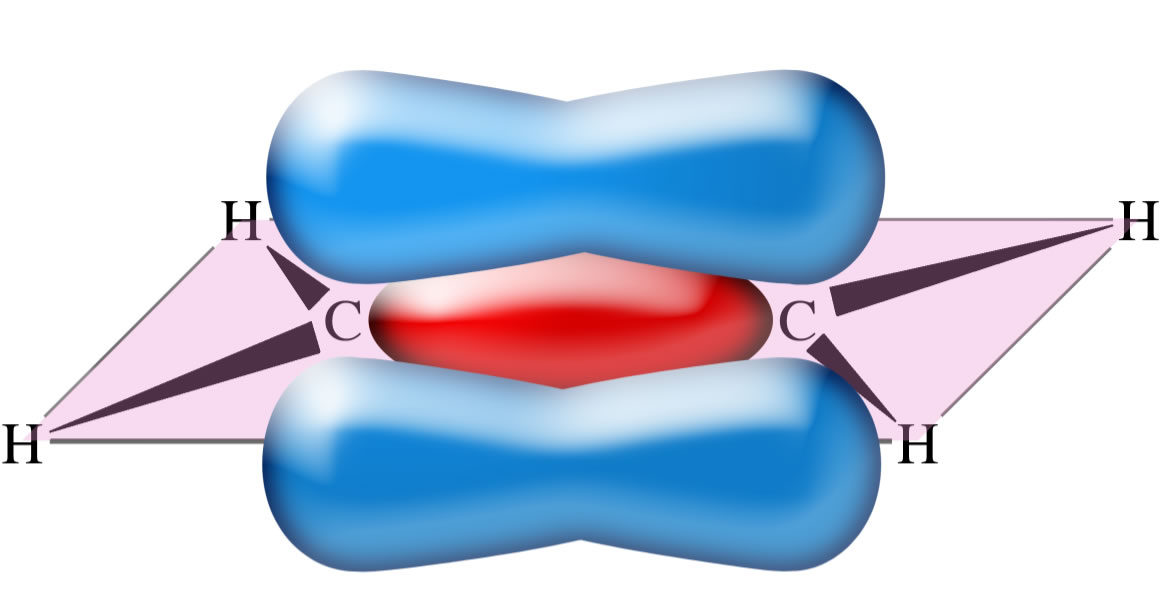
Die C=C-Doppelbindung: Die pi-Bindung
Autor: Ulrich Helmich, Lizenz: Public domain
Die pi-Bindung entsteht nun durch eine schwache Überlappung der oberen und unteren Orbitallappen der beiden pz-Orbitale. Diese Überlappung ist recht schwach, daher ist auch die pi-Bindung sehr schwach und kann leicht gespalten werden, was das chemische Verhalten der Alkene gut erklärt.
5.2.4 Die C=C-Doppelbindung als Dipol
Die C-Atome der Doppelbindung sind sp2-hybridisiert. In den sp2-Hybridorbitalen ist der s-Charakter größer als in den "üblichen" sp3-Hybridorbitalen, daher befinden sich die Elektronen etwas näher am Atomkern und werden stärker von diesem angezogen. Solche sp2-hybridisierten C-Atome haben daher eine etwas größere Elektronegativität als sp3-hybridisierte C-Atome, sie ziehen einen Teil der Elektronendichte an, und schon haben wir eine leicht polare Bindung zwischen dem sp2- und dem sp3-hybridisierten C-Atom. Das Vorhandensein von polaren Bindungen führt aber in der Regel dazu, dass das Molekül einen mehr oder weniger starken Dipolcharakter hat. Natürlich spielt die Geometrie des Moleküls auch eine gewisse Rolle, aber das wollen wir hier einmal vernachlässigen.
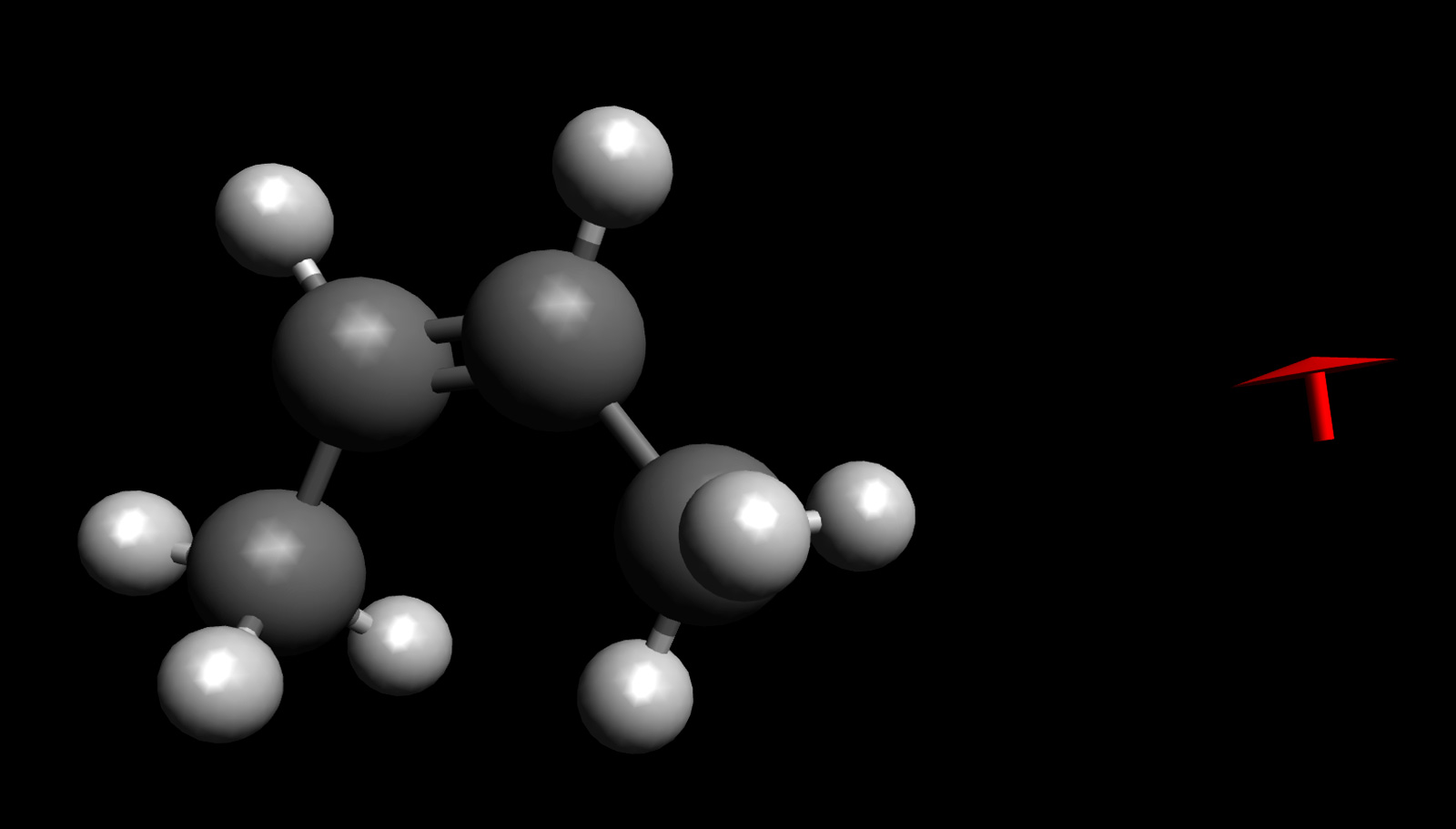
cis-But-2-en als permanenter Dipol
Autor: Ulrich Helmich 02/2023, Lizenz: Public domain
Mit dem Programm Avogadro kann man nicht nur Moleküle wie But-2-en zusammenbauen, sondern man kann auch berechnen und anzeigen lassen, wie stark der Dipolcharakter eines solchen Moleküls ist. Bei der cis-Form des But-2-ens liegt tatsächlich ein leichter Dipolcharakter vor, und der rote Pfeil, den das Programm generiert hat, zeigt eindeutig in Richtung der sp2-hybridisierten C-Atome der Doppelbindung.
5.2.5 Die C=C-Doppelbindung in der MO-Theorie
Kommen wir nun zu etwas gänzlich Neuem, zur Molekülorbital-Theorie. Dieses Thema wird in der gymnasialen Oberstufe nur sehr selten angesprochen, vielleicht wenn die Grundlagen der Farbigkeit organischer Verbindungen behandelt werden (Stichwort HOMO-LUMO).
Nach der MO-Theorie (Molekülorbital-Theorie) bilden überlappende Atomorbitale bei einer kovalenten Bindung sogenannte Molekülorbitale, abgekürzt MOs. Für jedes Atomorbital entsteht nach der MO-Theorie auch ein Molekülorbital. Bei dem Ethen-Molekül überlappen bei der Bildung der pi-Bindung zwei pz-Orbitale, also entstehen auch zwei MOs, ein bindendes und ein anti-bindendes.
Auf dieser Vertiefungsseite, die ich ursprünglich für das LK-Thema "Farbigkeit organischer Verbindungen" geschrieben haben, erhalten Sie grundlegende Informationen zur MO-Theorie am Beispiel des Ethen-Moleküls.
Eine Seite im Chemie-Lexikon dieser Homepage.
Auf dieser Vertiefungsseite wird der Unterschied zwischen der cis/trans-Isomerie und der E/Z-Isomerie besprochen.
5.3 Was sagt die Fachliteratur?
In den Organik-Vorlesungen und in der Hochschul-Fachliteratur wird sehr intensiv auf die Struktur der C=C-Doppelbindung eingegangen, erweiterte Kenntnisse des Orbitalmodells werden dabei vorausgesetzt, auch mit der MO-Theorie sollte man sich schon etwas auskennen.
5.4 Übungen
Die Lösungen dieser Aufgaben und der Aufgaben der Kapitel 1 und 2 (Alkane, Cycloalkane) können Sie gegen eine Kostenbeteiligung von 5 Euro über Paypal als PDF-Datei von mir erhalten (einfach auf den Spenden-Button klicken und als Verwendungszweck "Lösungen Organik 1-3" angeben).
Aufgabe 5.1
Neben den einfachen Alkenen mit einer C=C-Doppelbindung im Molekül gibt es auch Diene mit zwei Doppelbindungen.
Zeichnen Sie die Strukturformel der Verbindung Buta-1,3-dien so, dass man die pz-Orbitale der beiden Doppelbindungen gut erkennen kann und überlegen Sie dann, in welchem Bereich des Moleküls sich die pi-Elektronen der Doppelbindungen aufhalten.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
Seitenanfang -
Weiter mit der Radikalischen Substitution bei Alkenen...