Auswirkungen der Doppelbindung
Die C=C-Doppelbindung besteht aus zwei verschiedenen Bindungstypen, einer relativ starken sigma-Bindung aus überlappenden sp2-Hybridorbitalen und einer schwächeren pi-Bindung aus den überlappenden pz-Orbitalen.
Beide Bindungen zusammen führen dazu, dass
- die C=C-Doppelbindung kürzer ist als die C-C-Einfachbindung,
- die C=C-Doppelbindung elektronenreicher ist als die Einfachbindung,
- die C=C-Doppelbindung die freie Drehbarkeit um die C-C-Achse verhindert.
Die Aufhebung der freien Drehbarkeit bei Alkenen hat eine wichtige Konsequenz, nämlich das Phänomen der cis/trans-Isomerie. Am Beispiel der beiden 2-Butene soll einmal aufgezeigt werden, welche Auswirkungen diese Sonderform der Stereoisomerie auf die physikalischen Eigenschaften eines Alkens hat, speziell auf den Schmelzpunkt und den Siedepunkt:
| Eigenschaft | cis-But-2-en | trans-But-2-en |
|---|---|---|
| Schmelzpunkt | -139 ºC | -106 ºC |
| Siedepunkt | 4 ºC | 1 ºC |
Den höheren Siedepunkt von cis-But-2-en kann man leicht erklären. In der Schule würde man jetzt sagen, dass die Methylgruppen einen positiven induktiven Effekt haben, sie "schieben" Elektronendichte in Richtung auf die beiden mittleren C-Atome. Dadurch entstehen schwache Dipol-Kräfte, die sich beim cis-Buten addieren, während sie sich beim trans-Buten gegenseitig aufheben.
Im Chemiestudium erklärt man diesen Dipoleffekt mit der sp2-Hybridisierung der C-Atome. Die Elektronen befinden sich hier näher am Atomkern als bei sp3-hybridisierten C-Atomen und werden daher stärker angezogen, daher haben sp3-sp2-Bindungen zwischen C-Atomen einen leicht polaren Charakter mit dem sp2-hybridisiertem Atom als negativen Pol.
Den niedrigeren Schmelzpunkt des cis-But-2-en kann man mit diesem Dipol-Effekt allerdings nicht erklären. Beim Schmelzen müssen die Anziehungskräfte überwunden werden, mit denen die Buten-Moleküle im Buten-Kristall zusammengehalten werden. Offensichtlich kann man das trans-Buten besser "stapeln", so dass die Moleküle im Kristall dichter beieinander sitzen (Fachbegriff: hohe Packungsdichte). Entsprechend sind die Anziehungskräfte (London-Kräfte) höher. Das cis-Buten kann im festen Zustand nicht so eng "gestapelt" werden, die Abstände zwischen den Molekülen sind größer (geringere Packungsdichte), und daher sind die Anziehungskräfte kleiner, was wiederum einen niedrigeren Schmelzpunkt zur Folge hat.
Von besonderem Interesse ist die cis/trans-Isomerie bei den ungesättigten Fettsäuren. Siehe hierzu die Seite über trans-Fettsäuren in meinen Chemie-Lexikon.
Z/E-Isomerie
Die Begriffe cis-Isomer und trans-Isomer sind nicht immer eindeutig; aber sie werden trotzdem in den meisten Büchern für die einfacheren Fälle verwendet. Eindeutiger ist es, von Z- und E-Isomeren zu sprechen. Dabei sind Z-Isomere weitgehend mit cis-Isomeren identisch (Z steht für "zusammen", also auf der gleichen Seite), während E-Isomere weitgehend mit trans-Isomeren identisch sind (E steht für "entfernt", also auf der anderen Seite).
Allerdings ist diese Übereinstimmung Z = cis und E = trans nicht immer richtig, es gibt Ausnahmen. In der Alken-Seite der Chemgapedia wurde ein sehr schönes Beispiel behandelt:
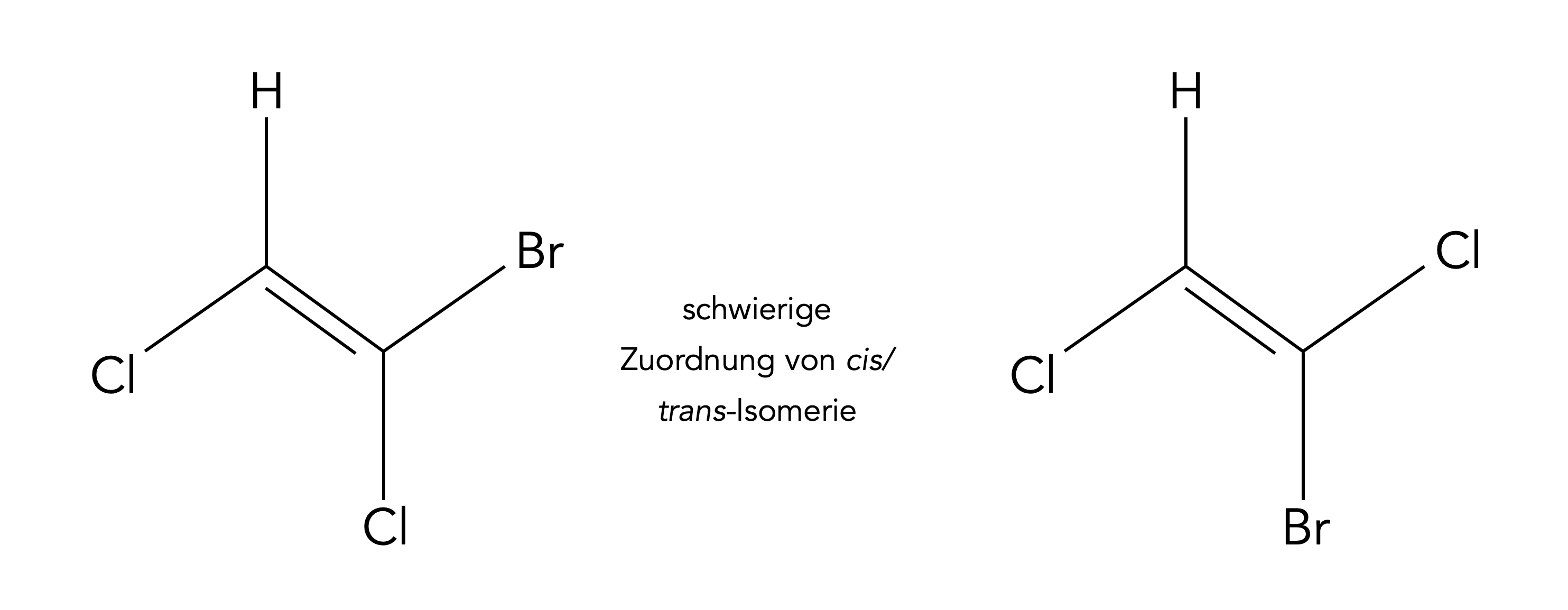
Ein komplizierterer Fall von cis/trans-Isomerie
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: CC BY-NC-SA 4.0
Hier ist es sehr schwer zu bestimmen, welches Isomer des Halogenalkens 1-Brom-1,2-dichlor-ethen in der cis- bzw. in der trans-Form vorliegt. Mit der E/Z-Terminologie hat man dagegen keine Probleme. Dazu betrachten wir das nächste Bild:
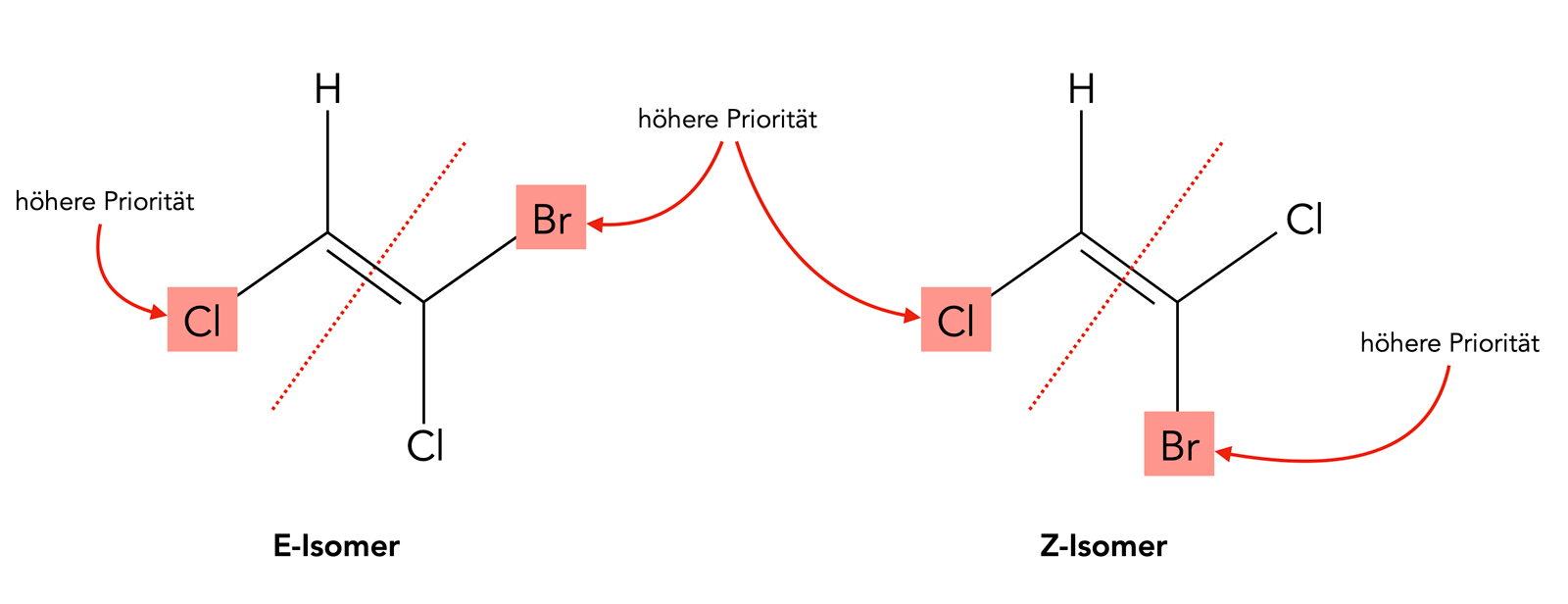
Text
Autor: Ulrich Helmich, Lizenz: Public domain
Wir teilen das Alken an der C=C-Doppelbindung formal in zwei Hälften, die wir jetzt einmal "links" und "rechts" nennen. Dann bestimmen wir auf der linken Hälfte den Substituenten mit der höheren Priorität. Ein Chlor-Atom hat sicherlich eine höhere Rangordnung als ein Wasserstoff-Atom. Auf der rechten Hälfte der Doppelbindung machen wir das Gleiche. Da Brom eine höhere Ordnungszahl hat als Chlor, hat Brom die höhere Priorität.
Die beiden Substituenten mit der jeweils höchsten Priorität befinden sich bei dem linken Molekül auf gegenüberliegenden Seiten der C=C-Doppelbindung, daher bezeichnet man dieses Isomer als E-Isomer ('E' könnte für "entfernt" stehen).
Bei dem rechten Isomer stehen die beiden Substituenten mit der höchsten Priorität auf der gleichen Seite der Doppelbindung, daher wird dieses Isomer als Z-Isomer bezeichnet (das 'Z' könnte für "zusammen" stehen).