Struktur
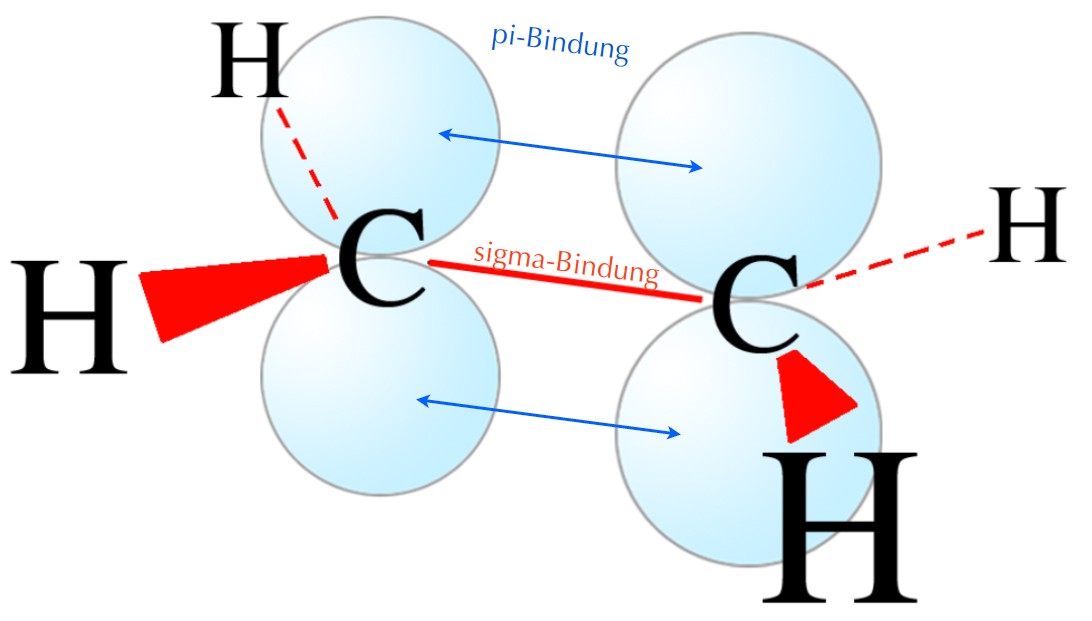
Das Ethen-Molekül nach dem Orbital-Modell
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Hier sehen wir das Ethen-Molekül, so wie es sich im Orbital-Modell darstellt. Gut zu sehen sind die vier Sigma-Bindungen zwischen den C- und H-Atomen sowie die Sigma-Bindung zwischen den beiden C-Atomen (rot gezeichnet). Da beide C-Atome sp2-hybridisiert sind und sich die pz-Orbitale leicht überlappen, ist das Ethen-Molekül planar, und alle sechs Atome liegen in einer Ebene.
Molekül-Orbitale des Ethens
Nach der MO-Theorie (Molekülorbital-Theorie) bilden überlappende Atomorbitale bei einer kovalenten Bindung sogenannte Molekülorbitale, abgekürzt MOs. Für jedes Atomorbital entsteht nach der MO-Theorie auch ein Molekülorbital. Bei dem Ethen-Molekül überlappen bei der Bildung der pi-Bindung zwei pz-Orbitale, also entstehen auch zwei MOs, ein bindendes und ein anti-bindendes.
Das bindende MO des Ethens
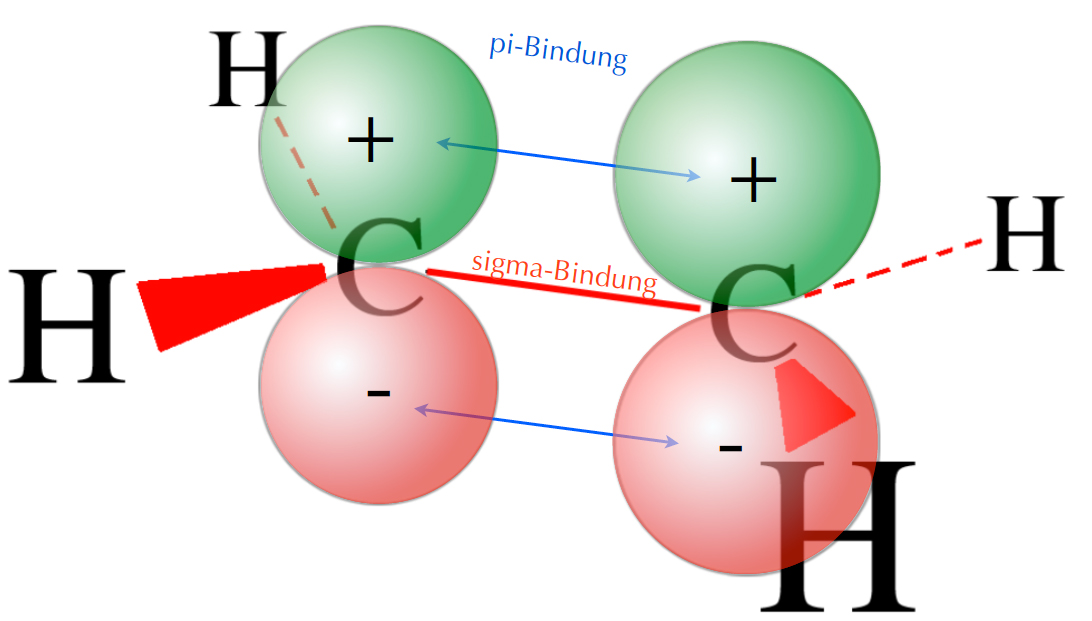
Das bindende Molekül-Orbital des
Ethen-Moleküls
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Auf diesem Bild sind die Orbitallappen der beiden pz-Orbitale in der gleichen Richtung orientiert. Eine Überlappung der beiden pz-Orbitale liefert daher ein bindendes π-Molekülorbital (MO). In diesem MO halten sich die beiden π-Elektronen auf. Die Plus- und Minus-Zeichen stehen nicht für eine elektrische Ladung, sondern sind mehr als "Wellenbauch" und "Wellental" zu verstehen. Vielleicht wird das auf dem folgenden Bild besser deutlich:
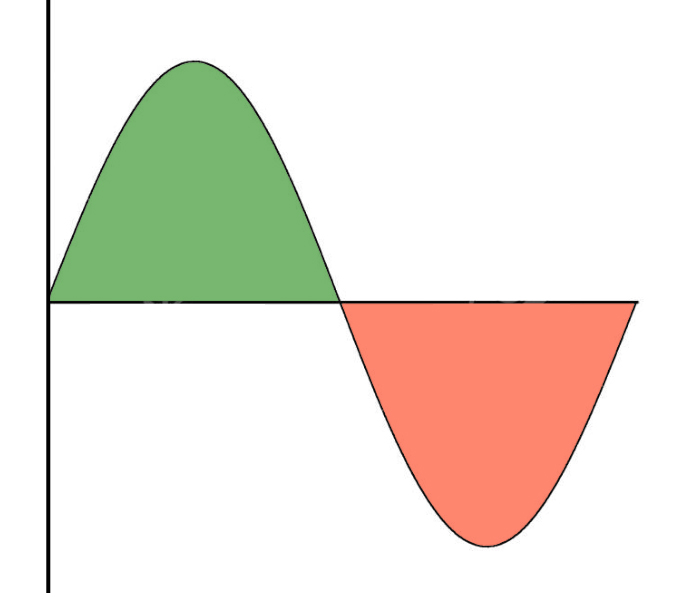
Sinuswelle mit einem Wellenberg und einem Wellental. Gleiche Farben wie auf dem Bild zuvor.
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Nach den aktuellen Vorstellungen der physikalischen Chemie sind die Atomorbitale, die wir aus dem Chemieunterricht kennen, also die s-Orbitale und die p-Orbitale, nichts anderes als Lösungen einer sogenannten Wellenfunktion oder Wellengleichung (Schrödinger lässt grüßen). In meinem eigenen Unterricht vergleiche ich das immer mit dem Schwingen einer Gitarrensaite. In der normalen "Grundstellung" hat die Seite einen Wellenbauch in der Mitte, wenn sie schwingt. Hält man die Saite aber genau in der Mitte fest, während man sie zupft, entsteht ein sogenannter Flageolett-Ton. Die Seite hat dann zwei Wellenbäuche. Ähnlich verhält es sich mit den Atomorbitalen. Die s-Orbitale entsprechen dem Grundzustand einer Gitarrensaite (ein Schwingungsbauch), die p-Orbitale entsprechen dem ersten angeregten Zustand einer Saite (zwei Schwingungsbäuche). Mit dem Unterschied, dass eine schwingende Gitarrensaite eine ein-dimensionale Welle darstellt, während ein Atomorbital eine drei-dimensionale schwingende Welle ist. Ich weiß - das ist jetzt alles extrem stark vereinfacht. Wer es genauer wissen will, muss auf die entsprechenden Physik-Saiten, ich meine natürlich Physik-Seiten, gehen.
Das anti-bindende MO des Ethens
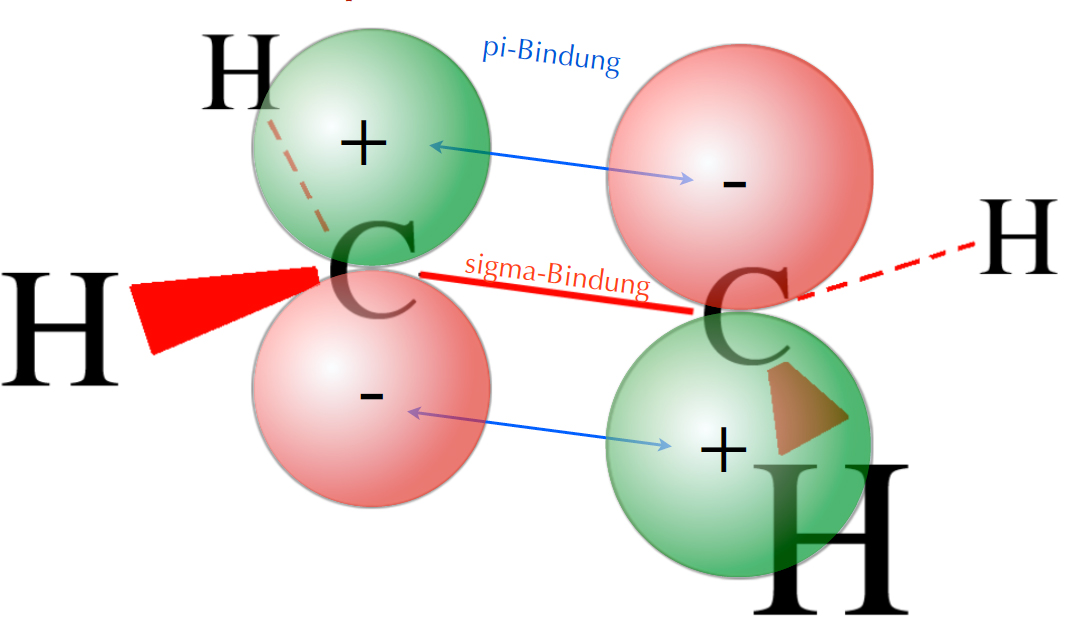
Das anti-bindende Molekül-Orbital des
Ethen-Moleküls
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Auf dem Bild sind die Orbitallappen der beiden pz-Orbitale nicht in der gleichen Richtung orientiert. Eine Überlappung der beiden pz-Orbitale liefert daher ein anti-bindendes π*-Molekülorbital (MO). In diesem anti-bindenden MO halten sich normalerweise keine Elektronen auf, es ist leer bzw. unbesetzt.
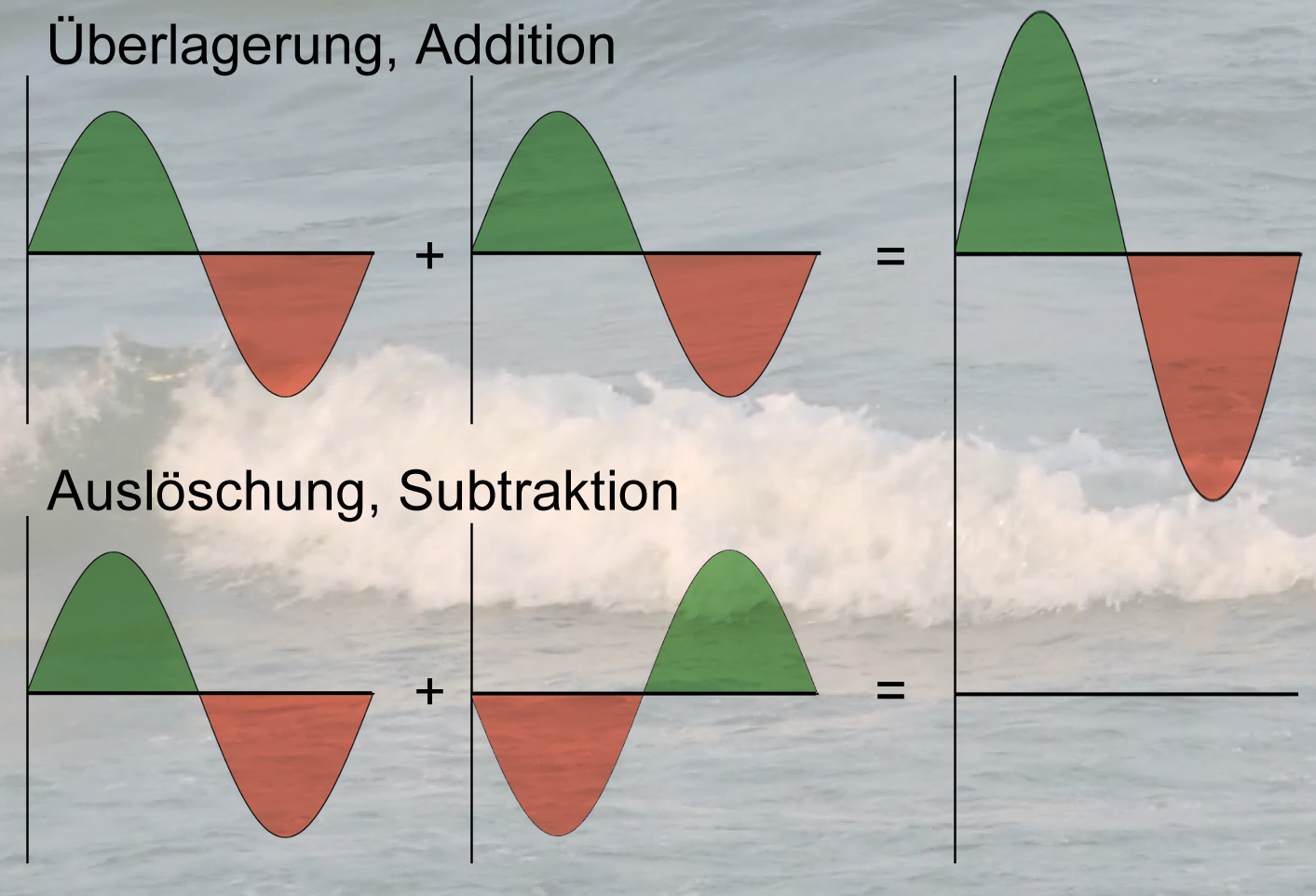
Sinuswelle mit einem Wellenberg und einem Wellental. Gleiche Farben wie auf dem Bild zuvor.
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Dieses Bild zeigt im oberen Abschnitt zwei Wellen, die sich überlagern bzw. addieren, es entsteht eine größere Welle mit einem höheren Wellenberg und einem tieferen Wellental. So ähnlich muss man sich das auch vorstellen, wenn zwei pz-Orbitale überlappen, die gleich ausgerichtet sind, also wo beide +-Lappen in die gleiche Richtung weisen.
Im unteren Abschnitt zeigt das Bild zwei Wellen, die sich gegenseitig auslöschen. Das Resultat ist ein völliges Verschwinden dieser Welle. So ähnlich ist das, wenn sich zwei pz-Orbitale überlappen, die in entgegengesetzter Richtung ausgerichtet sind, wenn also der eine Plus-Lappen mit dem Minus-Lappen des anderen Orbitals zusammenkommt.
Energieschema der MOs
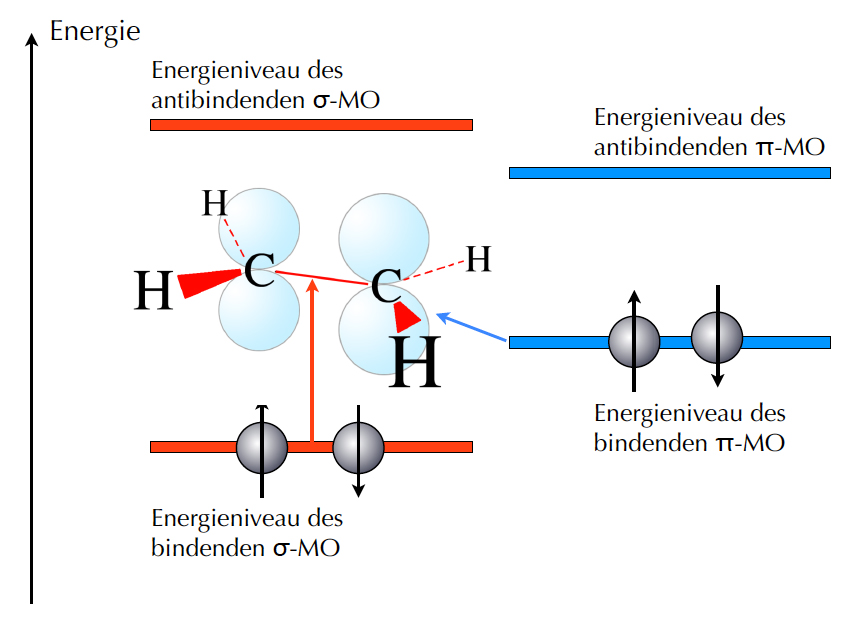
Die Energieniveaus der Molekülorbitale des Ethens
Autor: Ulrich Helmich 2021, Lizenz: Lizenz: CC BY-NC-SA 4.0
Auf diesem Bild sehen wir die Energieniveaus der vier Molekülorbitale (MOs) der C=C-Doppelbindung des Ethens. Links sehen wir die beiden σ-Orbitale, das bindende und das anti-bindende, und rechts die beiden π-Orbitale, ebenfalls ein bindendes und ein anti-bindendes.
Sowohl die σ-Orbitale wie auch die π-Orbitale werden nun mit Elektronen besetzt, und zwar so, dass "von unten" angefangen wird, also beim energetisch günstigsten Molekülorbital. Die beiden antibindenden Orbitale sind im Grundzustand des Moleküls frei. Durch Zufuhr von Energie (zum Beispiel UV-Strahlung) können aber Elektronen aus den bindenden Orbitalen in die entsprechenden antibindenden befördert werden. Bei der Absorption von Licht ist dies der Fall.