Die Edelgase sind absolut reaktionsträge
Bereits die Chemiker vergangener Jahrhunderte haben festgestellt, dass sich Edelgase völlig anders verhalten als andere chemische Elemente. Sie reagieren überhaupt nicht, selbst nicht mit konzentrierten Säuren oder beim starken Erhitzen mit reinem Sauerstoff. Auf Grund dieser Reaktionsträgheit hat man die Gase Helium, Neon, Argon, Krypton, Xenon und Radon dann auch als "Edelgase" bezeichnet, in Analogie zu den "Edelmetallen" Silber, Gold und Platin, die ja auch sehr reaktionsträge sind. Im Vergleich zu den Edelgasen sind die Edelmetalle aber noch sehr reaktionsfreudig. Vom Silber gibt es einige Verbindungen, selbst Gold und Platin können unter bestimmten Umständen mit anderen Stoffen reagieren. Die Edelgase dagegen reagieren bis auf ganz wenige Ausnahmen überhaupt nicht. Eine Übersicht der wenigen Edelgasverbindungen findet man auf der Wikipedia-Seite "Edelgasverbindungen".
Mit dem Daltonschen Kugelteilchenmodell, dem Thomsonschen Rosinenkuchenmodell oder dem Rutherfordschen Kern-Hülle-Modell konnte man das interessante Verhalten der Edelgase nicht erklären. Erst mit dem Aufkommen des Bohrschen Schalenmodells war das möglich.
Der Edelgaszustand
Nach dem Schalenmodell von Bohr haben alle Edelgase eine voll mit Elektronen besetzte Außenschale.
Das Helium besitzt zwei Elektronen auf der K-Schale, die damit voll besetzt ist. Das zweite Edelgas, das Neon, besitzt acht Elektronen auf der L-Schale, die ebenfalls voll besetzt ist. Auch das dritte Edelgas Argon besitzt acht Elektronen auf der M-Schale, die ebenfalls voll besetzt ist.
Für Experten:
An sich kann die M-Schale 18 Elektronen aufnehmen, aber wenn wir dieses Thema behandeln wollen, kommen wir in den komplexen Bereich der Übergangsmetalle und müssen das Orbitalmodell zur Hilfe nehmen. Es werden bei diesen Elementen nämlich nicht nur die s- und p-Orbitale besetzt, sondern auch die fünf d-Orbitale, in die weitere 10 Elektronen hineinpassen. Für die Stufe EF, für die diese Seiten in erster Linie geschrieben sind, ist das sicherlich nicht angemessen. Die d-Orbitale werden selbst in den Stufen Q1 und Q2 nicht thematisiert, sondern erst im Chemie-Studium, wenn die Elektronenkonfiguration von Übergangsmetallen oder die Ligandenfeld-Theorie behandelt wird.
Für Super-Experten, die trotzdem weiterlesen möchten:
Im Orbitalmodell wird die L-Schale durch ein s-Orbital und drei p-Orbitale repräsentiert. In jedes Orbital passen zwei Elektronen, also können insgesamt acht Elektronen auf der L-Schale untergebracht werden.
Die M-Schale wird im Orbitalmodell durch ein s-, drei p- und fünf d-Orbitale repräsentiert, auch hier passen wieder zwei Elektronen in jedes Orbital. Zählt man alles zusammen, so kommt man auf 18 Elektronen für die M-Schale.
Auch die N-Schale wird durch ein s-, drei p- und fünf d-Orbitale repräsentiert. Allerdings befinden sich das s-Orbital und die drei p-Orbitale auf einem energetisch niedrigeren Niveau als die fünf d-Orbitale der M-Schale. Das heißt, wenn die Orbitale eines Atoms mit Elektronen belegt werden, sind zunächst mal die s- und p-Orbitale der N-Schale "dran". Erst wenn diese Orbitale mit je zwei Elektronen belegt sind, können die fünf d-Orbitale der M-Schale belegt werden.
So, das sollte jetzt auch für die Super-Experten zunächst mal reichen. Über den Schulstoff geht das schon weit hinaus.
Für alle Edelgase gilt: Die Außenschale der Atome ist voll besetzt. Die Atome der anderen Elemente haben eine Außenschale, die nicht voll mit Elektronen besetzt ist, ihnen fehlen Elektronen. Daher bezeichnet man eine vollständige Besetzung der Außenschale auch als Edelgaszustand.
Edelgaszustand
Wenn die Atome eines Elementes eine voll besetzte Außenschale haben, bezeichnet man dies als Edelgaszustand.
Die Oktettregel
Aber warum sind die Edelgase so reaktionsträge? Die Antwort auf diese Frage formuliert sich fast von selbst: Offensichtlich ist der Edelgaszustand, also der Besitz einer voll besetzten Außenschale, etwas, was die Edelgase "zufriedenstellt". Mit ihrer voll besetzten Außenschale haben sie überhaupt kein Verlangen mehr, Elektronen aufzunehmen oder abzugeben. Sie haben den optimalen (energetisch günstigsten) Zustand erreicht.
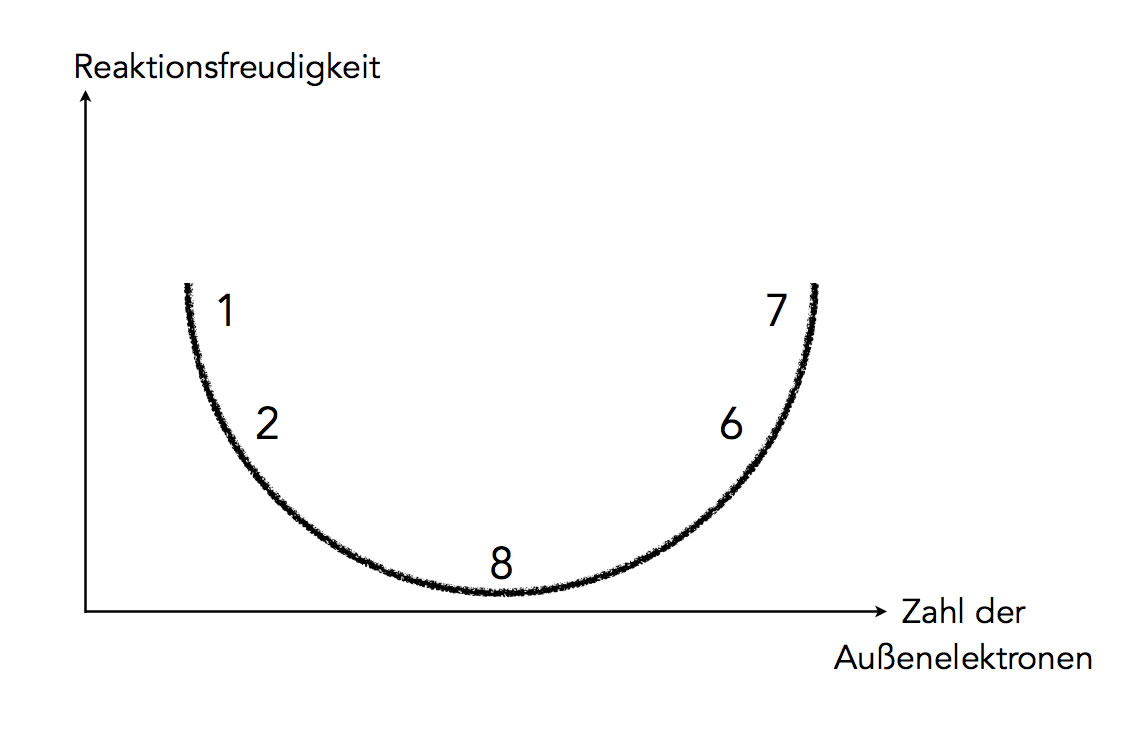
Veranschaulichung der Reaktionsfreudigkeit der Elemente
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das obige Bild versucht, die Reaktionsfreudigkeit der Elemente zu veranschaulichen. Man stelle sich eine Schüssel vor, der energetisch günstigste Zustand ist natürlich am Boden dieser Schüssel. Hier können wir uns nun den Zustand der Edelgase vorstellen, die eine mit acht Elektronen voll besetzte Außenschale haben.
Die Alkalimetalle wie Lithium, Natrium oder Kalium haben nur ein Außenelektron. Bekanntlich sind diese Metalle extrem reaktiv. In unserer Modellvorstellung (Schüssel) befinden sie sich daher am oberen Rand der Schüssel. Sie streben aber danach, ebenfalls auf dem Boden der Schüssel zum Liegen zu kommen. Dafür müssten sie aber eine voll besetzte Außenschale haben. Wie sie zu diesem erstrebenswerten Zustand kommen, werden wir gleich besprechen.
Die Halogene wie Fluor, Chlor oder Brom haben sieben Außenelektronen. Sie müssten nur noch ein einziges Elektron dazu bekommen, und schon wären sie in dem Edelgaszstand. Da sie "kurz davor" sind, verhalten sich diese Elemente ebenfalls äußerst reaktiv.
Die Erdalkalimetalle wie Magnesium oder Calcium haben zwei Außenelektronen, also nur eines mehr als die Alkalimetalle. Daher sind sie auch noch sehr reaktiv, aber nicht ganz so stark wie die Alkalimetalle. Entsprechendes gilt für die Elemente der Hauptgruppe IV, also Sauerstoff, Schwefel und so weiter. Ihnen fehlen nur zwei Außenelektronen, dann hätten sie den gleichen Zustand wie die rechts im Periodensystem stehenden Edelgase. Daher haben diese Elemente eine hohe Reaktionsfähigkeit, allerdings ist diese nicht ganz so stark ausgeprägt wie bei den Elementen der Hauptgruppe VII.
Die Elemente der anderen Hauptgruppen III, IV und V haben eine geringere Reaktionsfreudigkeit, daher sind sie in dieser Graphik nicht aufgeführt.
Oktettregel
Alle Elemente sind bestrebt, eine voll besetzte Außenschale zu haben und dadurch den Edelgaszustand zu erreichen.
Den Edelgaszustand können die Elemente durch Aufnahme oder Abgabe von Elektronen erreichen.
Aufnahme von Elektronen
Schauen wir uns mal ein Chlor-Atom näher an, dazu reicht eigentlich das Schalenmodell völlig aus. Chlor steht in der dritten Periode des Periodensystems, hat also drei Schalen. Gleichzeitig steht Chlor in der Hauptgruppe VII des Periodensystems, hat also sieben Außenelektronen. Die Elektronenkonfiguration des Chlors ist also K2L8M7.
Wie kann ein Chlor-Atom nun in den Edelgaszustand kommen? Ganz einfach: Das Atom muss nur ein zusätzliches Elektron aufnehmen. Dann hat es die gleiche Elektronenkonfiguration wie das Edelgas Argon, nämlich K2L8M8.
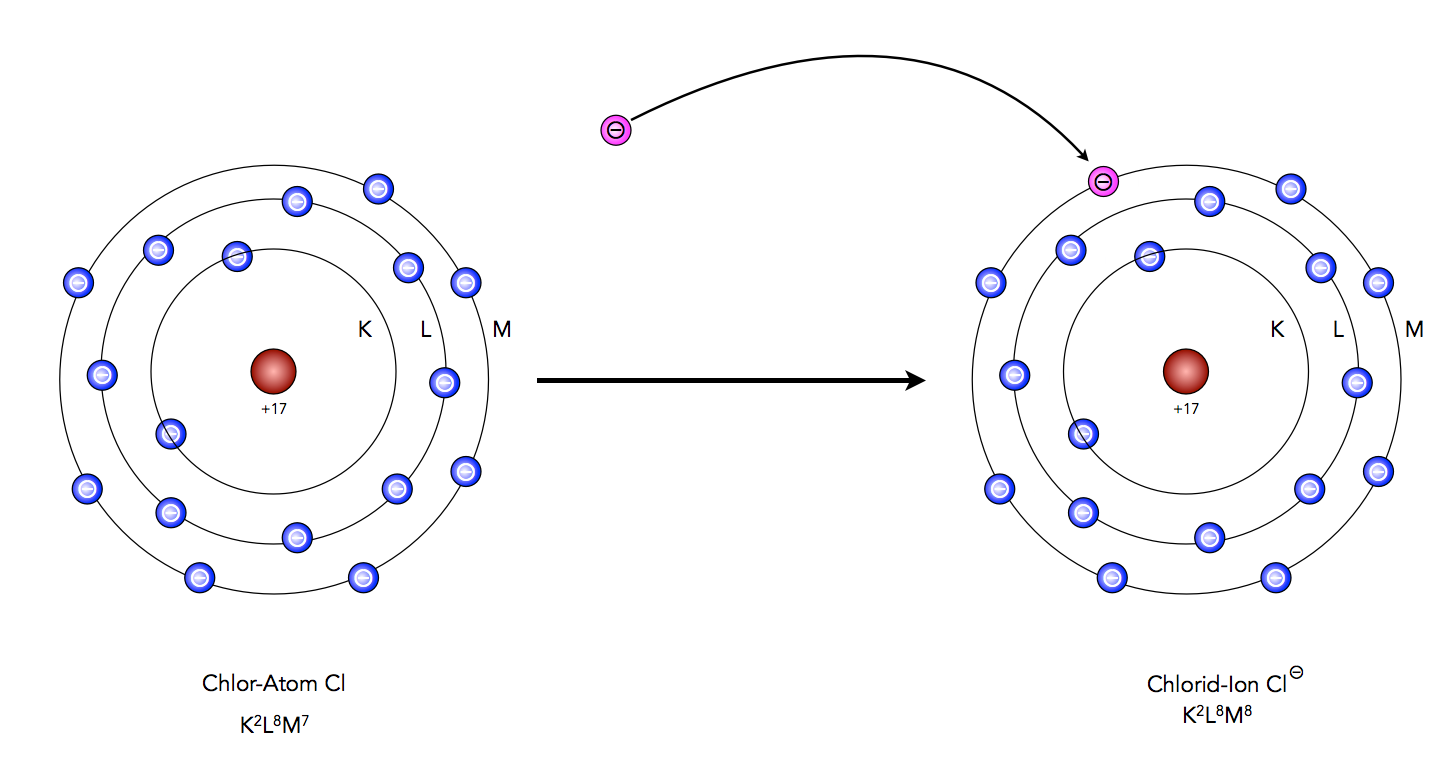
Chlor gelangt durch Aufnahme eines Elektrons in den Edelgaszustand
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Beim Sauerstoff wird es schon etwas schwieriger, weil hier zwei Elektronen aufgenommen werden müssen, um in den Edelgaszustand zu kommen.
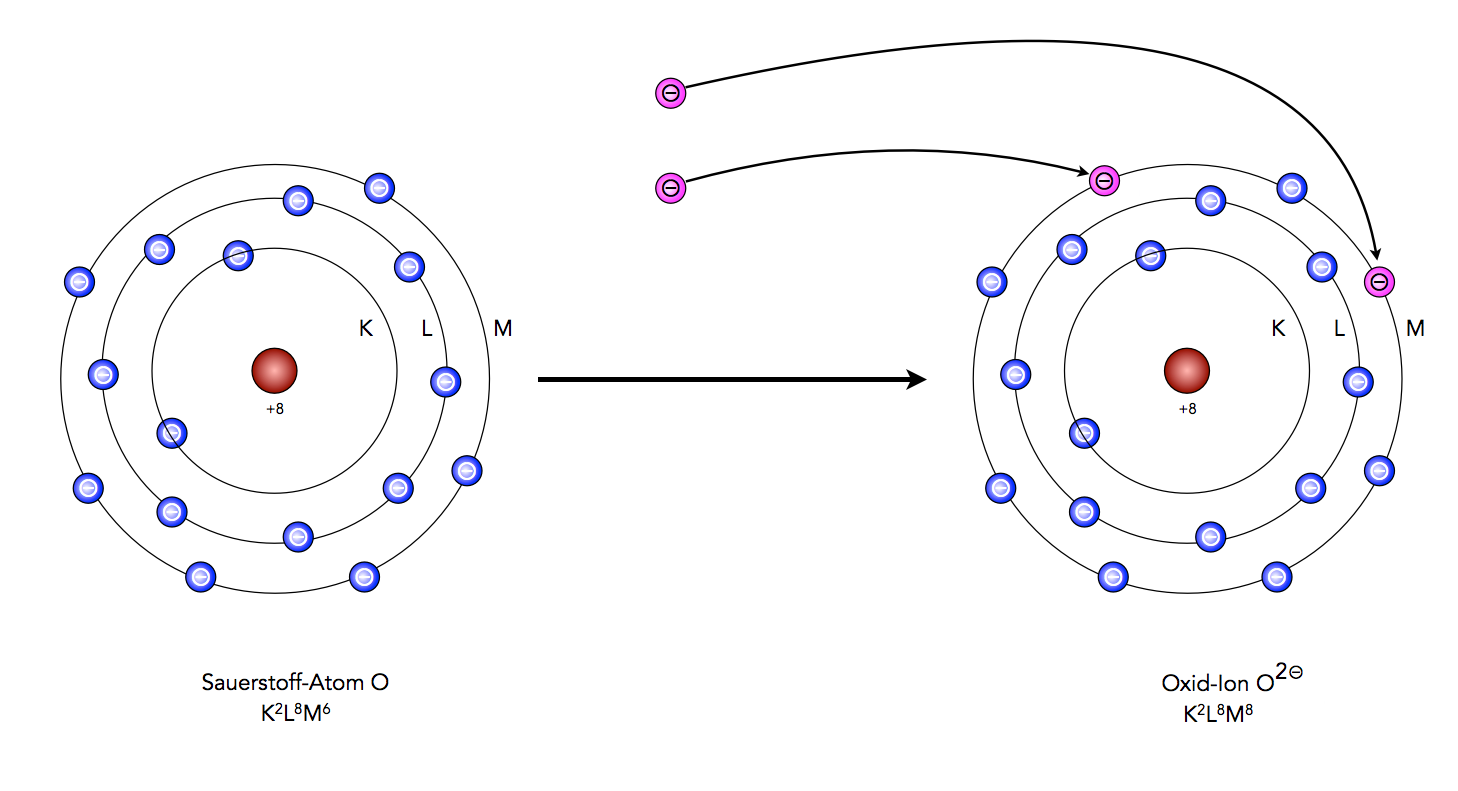
Sauerstoff gelangt durch Aufnahme von zwei Elektronen in den Edelgaszustand
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Atome des Elements Stickstoff müssen drei Elektronen aufnehmen, um in den Edelgaszustand zu gelangen, was aber durchaus noch möglich ist. Beim Kohlenstoff mit vier fehlenden Elektronen wird die Sache schon schwieriger. Darauf kommen wir aber später zu sprechen.
Abgabe von Elektronen
Wenden wir diese Oktettregel jetzt mal auf das Element Natrium an. Natrium hat ein einziges Elektron auf seiner Außenschale. Also müsste das Natrium-Atom sieben Elektronen aufnehmen, um in den Edelgaszustand zu gelangen. Das wäre energetisch aber nicht sehr günstig. Es gibt eine viel einfachere Lösung, die Sie sicherlich auch schon aus dem Unterricht der Sek. 1 kennen: Natrium gibt sein einziges Außenelektron einfach ab:
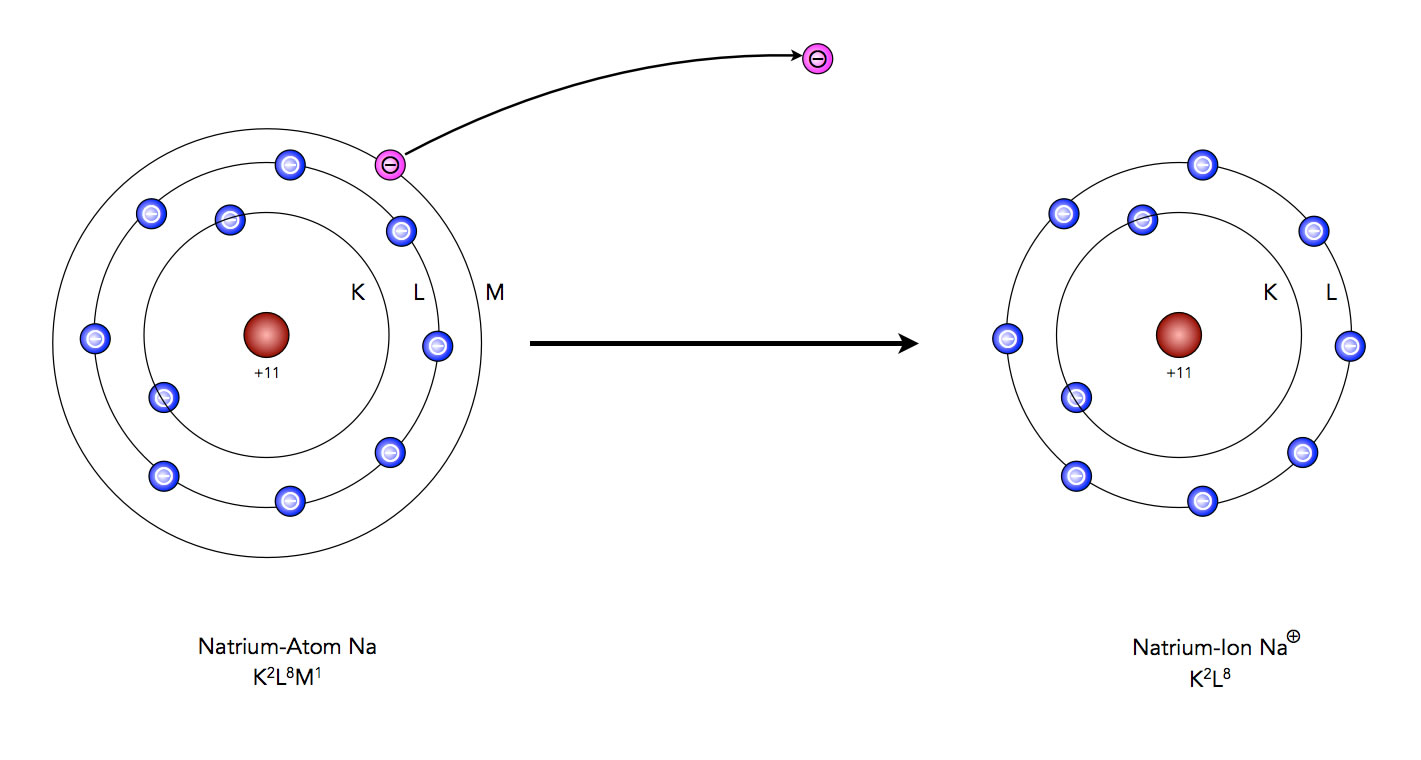
Natrium gelangt durch Abgabe eines Elektrons in den Edelgaszustand
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Entsprechend verhalten sich die anderen Alkalimetalle. Wenn Kalium ein Elektron abgibt, gelangt es in den Zustand des Edelgases Argon.
Die Erdalkalimetalle geben zwei Außenelektronen ab, um in den Edelgaszustand zu gelangen, sie sind chemisch ebenfalls recht reaktiv, aber lange nicht so reaktionsfreudig wie die Alkalimetalle. Die Abgabe von zwei Elektronen ist energetisch nicht mehr so günstig wie die Abgabe von nur einem Elektron, daraus erklärt sich die geringere Reaktivität der Erdalkalimetalle.
Ein Metall wie Aluminium müsste sogar drei Elektronen abgeben, um in den Edelgaszustand zu kommen. Das ist zwar möglich, aber energetisch noch ungünstiger.
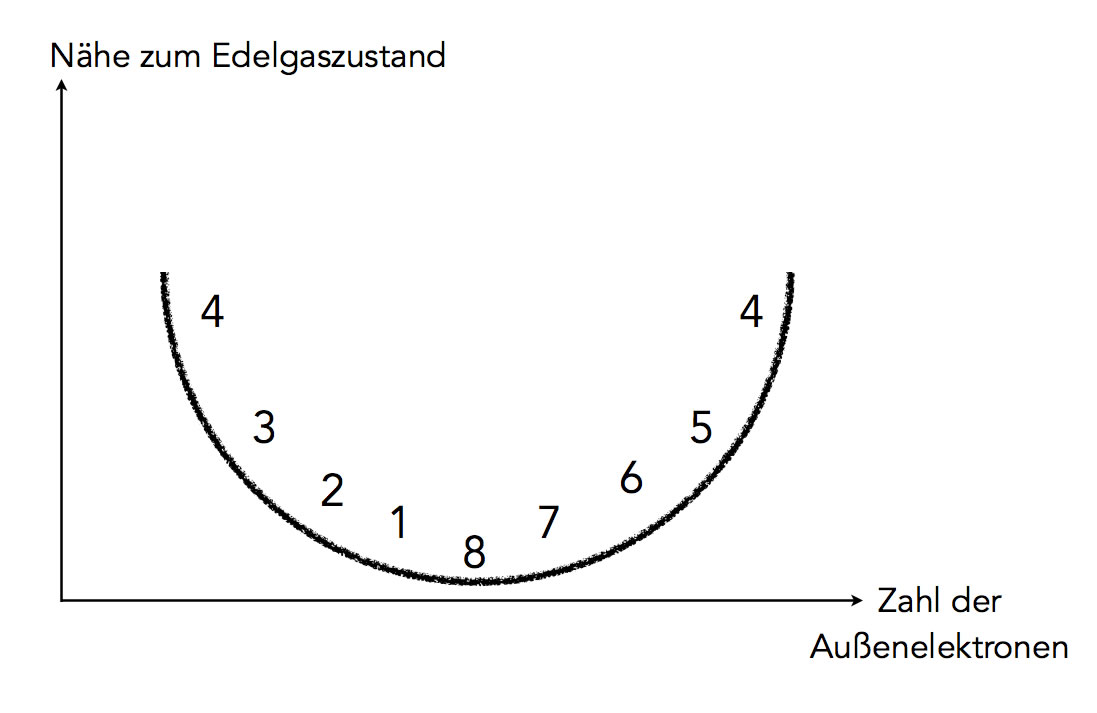
Die "Nähe zum Edelgaszustand" hängt von der Zahl der Außenelektronen ab
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Diese Graphik zeigt das Gesagte noch eimal anschaulicher. Die "Nähe zum Edelgaszustand", also der Aufwand, der getrieben werden muss, um in den Edelgaszustand zu gelangen, hängt von der Zahl der Außenelektronen ab.
Atome mit einem Außenelektron (Alkalimetalle) und Atome mit sieben Außenelektronen (Halogene) befinden sich ganz nah am Edelgaszustand. Sie müssen lediglich ein Elektron abgeben oder aufnehmen.
Atome mit zwei Außenelektronen (Erdalkalimetalle) und Atome mit sechs Außenelektronen (Sauerstoff, Schwefel etc.) müssen nur zwei Elektronen abgeben bzw. aufnehmen. Sie befinden sich auch noch nahe am Edelgaszustand.
Bei Atomen mit drei oder fünf Außenelektronen wird es schon kritischer, und Atome mit vier Außenelektronen haben jetzt echt ein Problem, das wir aber gleich lösen werden.
Die chemische Bindung als Lösung des Edelgasproblems
Wir haben eben gesehen, dass es für Elemente, die nicht zu den Edelgasen gehören, zwei Wege gibt, den Edelgaszustand zu erreichen: Aufnahme von fehlenden Elektronen oder Abgabe von überschüssigen Elektronen. Die Elemente der Hauptgruppen VI und VII wählen den ersten Weg, weil er der einfachste ist, und die Elemente der I. und II. Hauptgruppe wählen den zweiten Weg, weil dieser der einfachste ist.
Beispiel Natrium und Chlor
Es ist für das Natrium-Atom viel einfacher (weniger energieaufwändig), sein einziges Außenelektron abzugeben, als alternativ sieben weitere aufzunehmen. Und für das Chlor-Atom ist es viel einfacher, das fehlende Elektron aufzunehmen, als die sieben Elektronen der Außenschale abzugeben.
Das Problem ist jetzt nur Folgendes: Das Natrium "möchte" ein Elektron abgeben, muss dazu aber einen Partner finden, der ihm das Elektron abnimmt. Um dieses Ziel zu erreichen, gibt es drei Wege.
Kleines Problemchen...
Jetzt gibt es aber bei der Sache ein kleines Problemchen. Das Natrium "möchte", wie wir eben gesehen haben, sein Außenelektron abgeben. Natrium ist ein sogenannter Elektronen-Donator (Donator = Spender). Aber wohin mit dem abgegebenen Elektron? Diese Elektronen-Abgabe funktioniert nur dann, wenn ein geeigneter Elektronen-Akezptor verfügbar ist, also ein Atom oder ein Molekül, das in der Lage ist, Elektronen aufzunehmen.
Umgekehrt "möchte" das Chlor-Atom ein zusätzliches Elektron aufnehmen. Aber woher nehmen wenn nicht stehlen? Also muss ein Elektronen-Donator wie Natrium verfügbar sein, der ein solches Elektron zur Verfügung stellt.
Damit wären wir also schon beim Thema "Ionenbindung", dass Sie sicherlich schon in der Sekundarstufe I behandelt haben. Auf der EF-Seite zur Ionenbindung wird diese wichtige chemische Bindung näher vorgestellt.
Elemente der Hauptgruppen I und II sowie der Hauptgruppen VI und VII gehen vorzugsweise solche Ionenbindungen ein, weil sie ja nur ein oder zwei Elektronen abgeben oder aufnehmen müssen.
Elemente wie der Kohlenstoff haben aber vier Außenelektronen und befinden sich damit quasi in einer Art Zwickmühle. Sollen sie jetzt vier Elektronen abgeben, um den Edelgaszustand zu erreichen, oder lieber vier Elektronen aufnehmen? Beides wäre energetisch sehr ungünstig. In der Natur wird dieses Problem nun mit Hilfe der kovalenten Bindung gelöst, die auch als Elektronenpaarbindung, Molekülbindung oder Atombindung bezeichnet wird. Auf dieser Website wird aber der Begriff "kovalente Bindung" bevorzugt.
Auch die kovalente Bindung sollten Sie bereits in der Sekundarstufe I kennengelernt haben. Ich habe aber eine Extra-Seite für die Stufe EF geschrieben, wo Sie sich noch einmal auf Oberstufen-Niveau über die Elektronenpaarbindung informieren können.
Die Ionenbindung ist typische für Salzkristalle wie Natriumchlorid, die kovalente Bindung ist typisch für Molekül-Verbindungen wie Wasser, Methan, Ammoniak, Ethanol und so weiter. Was aber hält die Atome von Metallen wie Natrium, Magnesium und so weiter zusammen? Damit wären wir bei der metallischen Bindung, die Sie vielleicht noch nicht in der Sek. I behandelt haben.
Kommentar
Damit wären wir am Ende dieser langen Seite. Gehen Sie jetzt - wenn Sie noch Informationsbedarf haben - auf die Spezialseiten zur Ionenbindung, zur kovalenten Bindung und zur metallischen Bindung, um sich dort näher zu informieren.
Seitenanfang -
Weiter mit der Ionenbindung ...