Vorbemerkung
Das Daltonsche Atommodell von 1803 ist nicht das erste Atommodell, das Menschen erfunden haben. Die alten Griechen, vor allem Leukipp und sein Schüler Demokrit (460 - 370 v. Chr.) waren ihrer Zeit damals weit voraus, auch sie dachten über Atommodelle nach, die aber heutigen wissenschaftlichen Ansprüchen nicht mehr genügen, darum breiten wir den Mantel des Schweigens um diese frühen Versuche einer atomaren Vorstellung aus (ich selbst habe sogar eine Philosophie-Prüfung zu diesem Thema abgelegt, also daher finde ich das Thema sehr interessant, aber leider gehört es nicht in den modernen Chemie-Unterricht, daher breche ich jetzt einfach mal mitten im ...
Die Atom-Theorie von Dalton
Nach Dalton (1766 - 1844) bestehen Elemente aus Atomen. Jedes Element besteht dabei aus einer eigenen Atomsorte. Da es 118 Elemente gibt (Stand 2020, siehe auch Seite der GdCh, Gesellschaft deutscher Chemiker), existieren auch 118 Atomsorten auf der Erde (Isotope sind dabei noch nicht mitgerechnet).
Atome sind nach der Vorstellung von Dalton extrem klein und kugelförmig. Sie haben eine bestimmte Größe und eine bestimmte Masse. Vor allem aber sind Atome unteilbar. Daher haben sie auch ihren Namen (griechisch atomos = unteilbar).
Hier zunächst die Original-Definition der Atom-Theorie von John Dalton [1]
John Dalton's Atomic Theory
- All matter is comprised of tiny, definite particles called atoms.
- Atoms are indivisible und indestructible.
- All atoms of a particular element share identical properties, including weight.
- Atoms of different elements contain different mass.
- Atoms of different elements combine in fixed, whole number ratios when forming compounds.
Versuchen wir einmal, das zu übersetzen:
Das Daltonsche Atommodell
- Die gesamte Materie besteht aus winzigen Teilchen, sogenannten Atomen.
- Atome sind unteilbar und unzerstörbar.
- Alle Atome eines bestimmten Elements teilen sich identische Eigenschaften, einschließlich Gewicht.
- Atome verschiedener Elemente besitzen unterschiedliche Massen.
- Atome verschiedener Elemente verbinden sich in festgelegten ganzzahligen Verhältnissen, wenn sie Verbindungen bilden.
Und hier die Version, die man heute in den meisten Schulbüchern findet:
Das Daltonsche Atommodell
- Atome bestehen aus kleinen, massiven, unteilbaren Kugeln.
- Jedes Element besteht aus einer eigenen Atomsorte. Es gibt also genau so viele Atomsorten, wie es Elemente gibt.
- Jede Atomsorte hat einen bestimmten Radius und eine bestimmte Masse.
- Chemische Reaktionen sind Teilchenumgruppierungen: Bei einer Reaktion gruppieren sich die Atome der Ausgangsstoffe lediglich um. Weder werden Atome vernichtet, noch entstehen neue.
Leistungsfähigkeit des Dalton-Modells
So primitiv wie das Dalton-Modell auch ist, man kann es immer noch gut verwenden, um zahlreiche Naturphänomene zu erklären.
Verbindungen
Nach Dalton bestehen Verbindungen wie Wasser oder Zucker zwar auch aus Atomen, die Atome haben sich aber zu Molekülen verbunden. Allerdings hat Dalton den Begriff "Molekül" selbst noch nicht benutzt. Er sprach von "zusammengesetzten Atomen" (compound atoms). Nach heutigem Wissenstand definieren wir den Begriff "Molekül" so:
Moleküle sind kleinste Teilchen, die aus mindestens zwei (gleichen oder verschiedenen) Atomen bestehen.
Verbindungen bestehen aus Molekülen, die mindestens zwei verschiedene Atome enthalten, also Atome von zwei verschiedenen Elementen.
Verbindungen wie Wasser, Ammoniak oder Methan bestehen aus Molekülen, nicht aus einzelnen Atomen. Ein Wasser-Molekül besteht aus einem Sauerstoff-Atom und zwei Wasserstoff-Atomen: H2O. Ein Ammoniak-Molekül setzt sich aus einem Stickstoff-Atom und drei Wasserstoff-Atomen zusammen: NH3. Ein Methan-Molekül schließlich enthält ein Kohlenstoff-Atom und vier Wasserstoff-Atome: CH4. Bromwasserstoff besteht aus einem Brom-Atom und einem Wasserstoff-Atom: HBr.
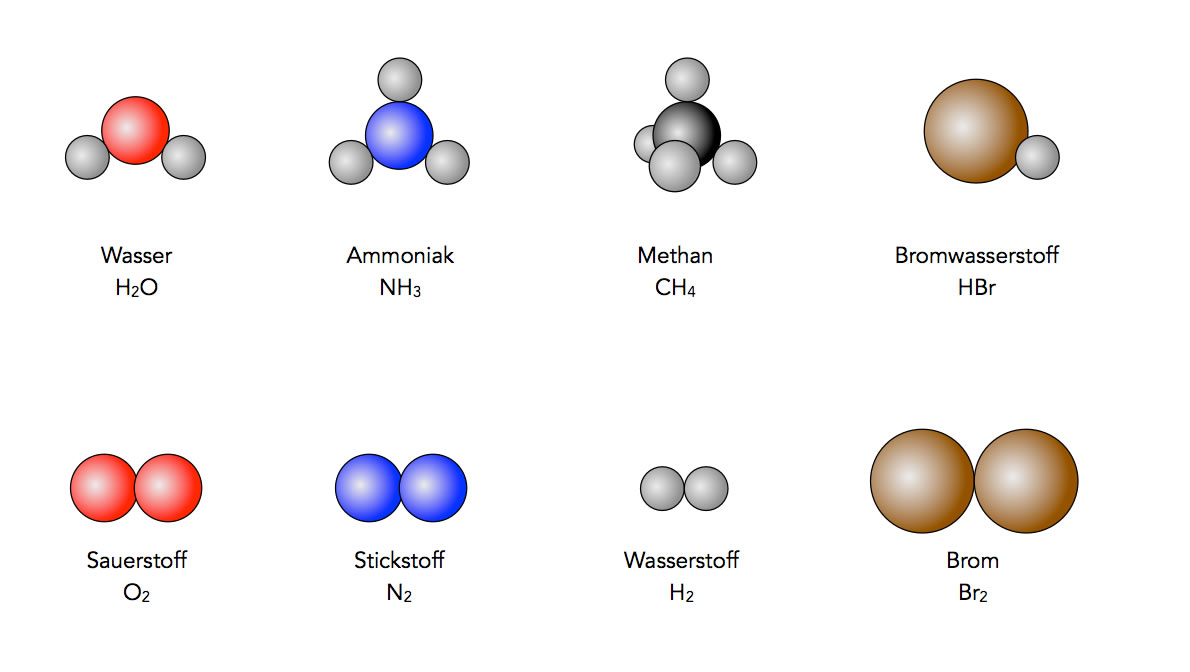
Ein paar wichtige Moleküle. Oben: Verbindungen Wasser, Ammoniak, Methan und Bromwasserstoff. Unten: Elemente Sauerstoff, Stickstoff, Wasserstoff und Brom.
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Es gibt aber auch Elemente, deren kleinste Teilchen in Form von Molekülen organisiert sind. Sauerstoff beispielsweise besteht aus Molekülen, die aus jeweils zwei Sauerstoff-Atomen bestehen, daher schreibt man auch O2 für Sauerstoff. Auch Stickstoff, Wasserstoff, Chlor, Brom oder Iod kommen in Form zweiatomiger Moleküle vor: N2, H2, Cl2, Br2, I2.
Gemische
Wie würde Dalton Bromwasser darstellen, also eine Lösung von Brom in Wasser?
Wasser H2O ist eine Verbindung, während Brom Br2 ein Element ist, dessen kleinste Teilchen Moleküle aus je zwei Brom-Atomen sind.
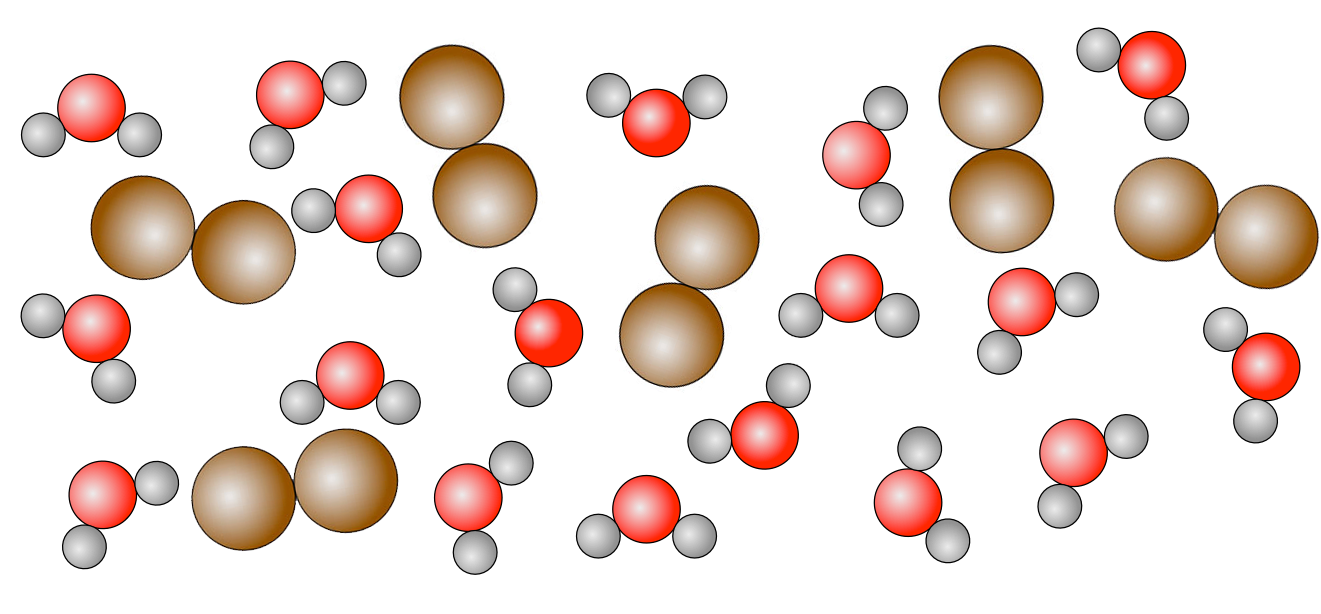
Ein Wasser-Brom-Gemisch
Mit dem Daltonschen Atommodell kann man also gut die Existenz und die Eigenschaften von Stoffgemischen erklären - auch hierzu braucht man kein quantenmechanisches Atommodell oder die String-Theorie.
Damit wären wir auch schon beim nächsten Punkt, der Leistungsfähigkeit des Daltonschen Atommodells.
Aggregatzustände und Zustandsänderungen
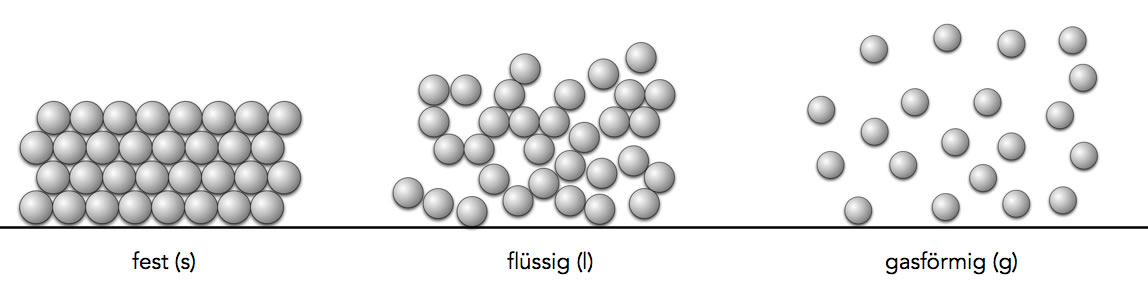 Ein Metall im festen, flüssigen und gasförmigen Zustand
Ein Metall im festen, flüssigen und gasförmigen Zustand
Autor: Ulrich Helmich, Lizenz: Public domain
Im festen Zustand befinden sich die Atome oder Moleküle in einer dichten Packung, daher sind feste Stoffe eben "fest" und haben eine hohe Dichte. Im flüssigen Zustand sind die kleinsten Teilchen (Atome oder Moleküle) recht locker angeordnet, berühren sich aber noch. Daher sind Flüssigkeiten "flüssig" und haben eine geringere Dichte. Im gasförmigen Zustand schließlich berühren sich die kleinsten Teilchen nicht mehr, sie flitzen mit hoher Geschwindigkeit durch den Raum. Dies erklärt die geringe Dichte eines Gases.
Ausdehnung von Körpern
Erhitzt man einen festen, flüssigen oder gasförmigen Körper, so dehnt sich dieser aus, weil sich die Abstände zwischen den Atomen oder Molekülen vergrößern.
Gesetz von der Erhaltung der Masse
Dieses Gesetz kann mit Hilfe der Atommassen leicht erklärt werden. Bei chemischen Reaktionen entstehen keine neuen Atome, noch gehen vorhandene Atome verloren. Die vorhandenen Atome der Ausgangsstoffe ordnen sich "lediglich" zu neuen Molekülen an, dabei geht natürlich keine Masse verloren. Die Gesamtmasse der Produkte nach einer chemischen Reaktion ist identisch mit der Gesamtmasse der Ausgangsstoffe vor der Reaktion.
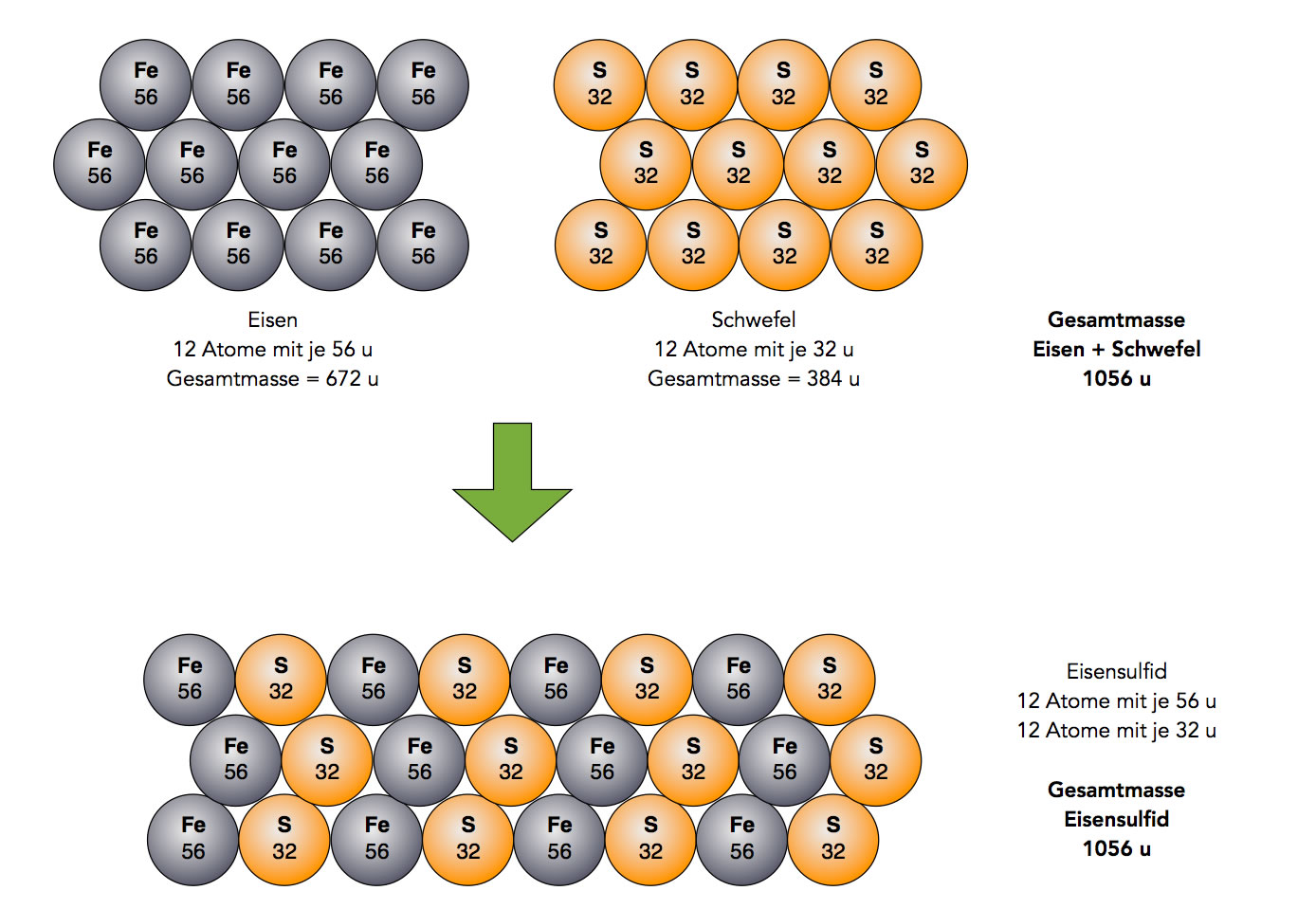
Erklärung des Gesetzes von der Erhaltung der Masse nach Dalton
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Gesetz der konstanten Proportionen
Schon lange vor Dalton hatte man festgestellt, dass sich Elemente stets in bestimmten Verhältnissen - in konstanten Proportionen - miteinander verbinden. Das schauen wir uns am Beispiel Eisensulfid mal näher an. Aus dem Chemieunterricht der Sek. I kennen Sie sicherlich noch den Versuch, bei dem man eine bestimmte Menge Eisenpulver und eine bestimmte Menge Schwefelpulver abwiegt, im Mörser gut zusammenmischt und dann in ein Reagenzglas gibt. Wenn man das Stoffgemisch erhitzt, bildet sich in einer exothermen Reaktion der blauschwarze und spröde Stoff Eisensulfid. Dabei reagieren stets 7 g Eisenpulver mit genau 4 g Schwefelpulver.
Dalton und andere Chemiker hatten schon recht früh die Atommassen der Elemente bestimmt, nicht so genau wie man das heute weiß, aber für die damalige Zeit hatte man schon recht eindrucksvolle Werte ermittelt. Heute wissen wir, dass die Atommasse von Eisen 56 u und die von Schwefel 32 u beträgt, und dass bei der Reaktion von Eisen mit Schwefel immer ein Eisen-Atom mit einem Schwefel-Atom reagiert. Das heißt, 56 u vereinigen sich mit 32 u zu 88 u. Und acht mal 56 u - so wie in der Abbildung oben - vereinigen sich mit acht mal 32 u zu acht mal 88 u. Entsprechend reagieren 10 Millionen Eisen-Atome mit einer Masse von 560 Millionen u mit genau 10 Millionen Schwefel-Atomen, die zusammen eine Masse von 320 Millionen u haben.
Zwischen den Einheiten u (Unit) und g (Gramm) besteht eine lineare Beziehung, ähnlich wie beispielsweise zwischen den Einheiten Zoll und Meter. Daher kann man sagen, dass 56 Gramm Eisen immer mit 32 Gramm Schwefel reagieren, oder 7 Gramm Eisen mit 4 Gramm Schwefel und so weiter.
Volumenreduktion
Diesen Versuch führe ich immer im Unterricht der Klasse 7 durch, die Schüler sind stets beeindruckt. Man misst sehr genau 50 ml Wasser und 50 ml Ethanol in zwei verschiedenen Messzylindern ab, dann mischt man die beiden Reinstoffe in einem 100 ml - Messzylinder. Und jetzt geschieht das Unglaubliche: Man hat am Ende nur 97 oder 98 ml Stoffgemisch! Wo ist der Rest geblieben?
Diese Volumenreduktion kann man ganz leicht mit dem Kugelteilchenmodell von Dalton erklären.
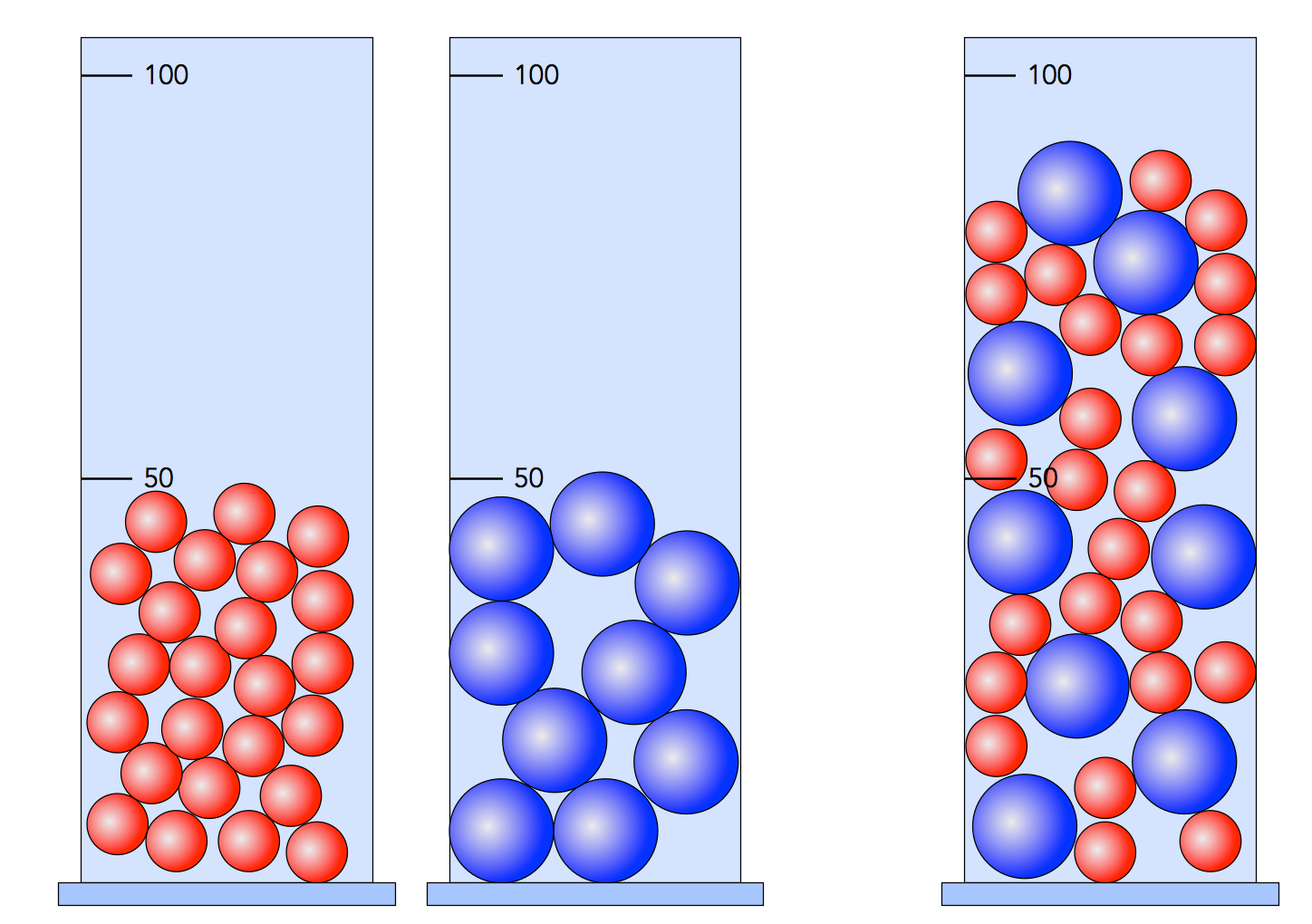
Volumenreduktion bei Wasser und Alkohol
Wasser und Alkohol bestehen aus Molekülen. Da die Alkohol-Moleküle aus wesentlich mehr Atomen bestehen als die Wasser-Moleküle, sind sie auch viel größer. Das Mischen von Alkohol und Wasser kann man recht schön mit Erbsen und Senfkörnern veranschaulichen. Die Senfkörner verschwinden fast komplett in den Lücken zwischen den Erbsen, und auf analoge Weise verschwinden die Wasser-Moleküle in den Lücken zwischen den Alkohol-Molekülen. Natürlich nicht ganz so extrem wie die Senfkörner, schließlich gehen ja nur ein paar Prozent des Volumens verloren.
Dies waren nur fünf Beispiele für Phänomene aus dem Alltag oder dem Chemielabor, die man sehr einfach mit dem Daltonschen Atommodell erklären kann. Und das sollte man auch tun. Um Schülern oder anderen Leuten die Volumenreduktion oder das Gesetz von der Erhaltung der Masse zu erklären, brauche ich kein Orbitalmodell oder Kugelwolkenmodell, sondern das Daltonsche Atommodell reicht völlig aus.
Schwächen des Modells von Dalton
Offensichtlich kann man aber nicht alles mit dem Modell von Dalton erklären. Sonst hätte man sich ja kaum die Arbeit gemacht, komplexere Atommodelle zu entwickeln. Die Frage, warum sich ein Schwefel-Atom stets mit zwei Kupfer-Atomen zu Cu2S verbindet, kann das Dalton-Modell nicht erklären. Auch einen Versuch wie die Elektrolyse von Kupferbromid kann man nach diesem Modell nicht deuten. Warum wandern die Kupfer-Atome zum Minuspol, die Brom-Atome aber zum Pluspol? Wieso sind Lithium, Natrium und Kalium so extrem reaktionsfreudig, und die Edelgase wie Helium und Neon überhaupt nicht?
All diese Fragen kann man nur mit komplexeren Atommodellen erklären. Das ist der Grund, warum Sie in der Sekundarstufe 1 das Schalenmodell und hoffentlich auch schon das Kugelwolkenmodell kennengelernt haben.
Quellen:
- Britannica, Artikel "John Dalton - Atomic theory"
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
Weiter mit dem
Rosinenkuchenmodell ...