Ionenbindung, eine Rekapitulation
Die Atome der Elemente, die im Periodensystem links stehen, geben leicht Elektronen ab. Beispiele hierfür sind die Metalle Natrium, Kalium, Magnesium, Calcium, Aluminium etc. Der Grund dafür ist einfach: Element links im PSE haben nur ein, zwei oder drei Außenelektronen. Die Atome dieser Elemente müssen diese wenigen Außenelektronen abgeben, und schon befinden sie sich im Edelgaszustand (siehe: Oktettregel).
Umgekehrt nehmen die Atome der Elemente rechts im Periodensystem sehr leicht Elektronen auf. Beispiele für solche Elemente sind die Halogene wie Fluor und Chlor, außerdem Sauerstoff, Stickstoff und so weiter. Auch hier ist der Grund recht einfach: Die Atome dieser Elemente müssen nur ein, zwei oder drei Elektronen aufnehmen, und schon ist ihre Außenschale vollständig gefüllt und sie haben den Edelgaszustand erreicht.
Das alles ist nichts Neues für Sie, falls Sie das Kapitel über die Ionenbindung durchgearbeitet haben.
Probleme
Was ist aber mit den Elementen, die ungefähr in der Mitte des PSE stehen. Was müssen Elemente wie Kohlenstoff oder Silicium (4. Hauptgruppe) machen, um in den Edelgaszustand zu gelangen?
Um in den Edelgaszustand zu gelangen, müssen die Atome von Kohlenstoff oder Silicium entweder
- vier Elektronen aufnehmen oder
- vier Elektronen abgeben.
Würde Kohlenstoff vier Elektronen abgeben, so wäre das erstens sehr energieaufwendig und zweitens würde der Kohlenstoff dann als vierwertig positives Kation vorliegen. Kohlendioxid wäre dann eine Ionenverbindung - und was für eine! Die vierwertig positiven Kohlenstoff-Ionen würden die zweiwertig negativen Sauerstoff-Ionen extrem stark anziehen. Kohlendioxid wäre dann bei Zimmertemperatur ein extrem harter Feststoff! Wie wir aber wissen, ist CO2 bei Zimmertemperatur gasförmig. Also kann an der "Ionenhypothese" irgendetwas nicht stimmen. Was macht das C-Atom aber dann, um in den Genuss eines Edelgaszustandes zu kommen?
Die Lösung dieses Problems heißt: Elektronenpaarbindung.
Elektronenpaarbindung
Das C-Atom ist mit seinen vier Außenelektronen schon recht komplex aufgebaut. Wir wollen das Prinzip der Elektronenpaarbindung (auch kovalente Bindung oder Molekülbindung genannt) an dem denkbar einfachsten Beispiel kennenlernen, dem Wasserstoff-Molekül.
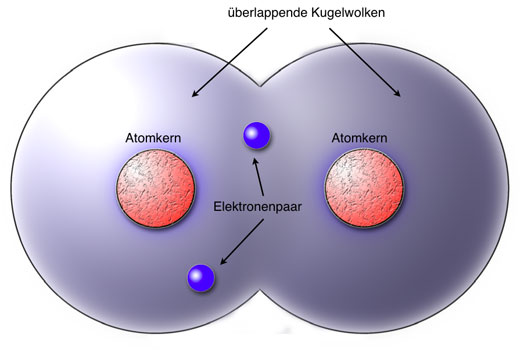
Zwei Wasserstoff-Atome teilen sich zwei Elektronen
Autor: Ulrich Helmich, Lizenz: Public domain.
Bei der Elektronenpaarbindung nähern sich zwei H-Atome so weit an, dass ihre Kugelwolken überlappen. Es bildet sich eine gemeinsame Kugelwolke. Da jedes H-Atom ein Elektron besitzt, befinden sich in dieser gemeinsamen Kugelwolke jetzt genau zwei Elektronen. Jedes Elektron kann sich in der gesamten Kugelwolke aufhalten, gehört also zu beiden Atomen.
Wenn Mr. Johnson 1000 Pfund auf ein Konto überweist, dass er mit Mrs. Johnson teilt, und wenn Mrs. Johnson ebenfalls 1000 Pfund auf dieses Konto überweist, dann befinden sich 2000 Pfund auf diesem Konto. Mr. Johnson hat dann Zugriff auf 2000 Pfund, Mrs. Johnson ebenfalls. Aber besitzen dann beide zusammen 4000 Pfund? Nein, natürlich nicht. Aber genau diese Argumentation wurde Ende des 19. Jahrhunderts von Kritikern der Theorie des gemeinsamen Elektronenpaares vorgebracht.
Jedes H-Atom besitzt nun - zumindest formal - zwei Elektronen und befindet sich daher im Zustand des Edelgases Helium.
Was hält jetzt das Molekül zusammen?
Betrachten wir dazu das nächste Bild:
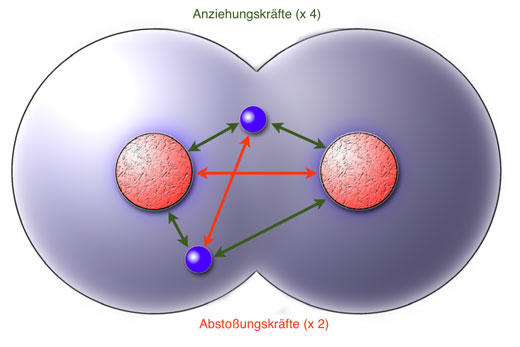
Bei der Elektronenpaarbindung überwiegen die Anziehungskräfte
Autor: Ulrich Helmich, Lizenz: Public domain.
In diesem Bild sind die Anziehungs- und Abstoßungskräfte hervorgehoben, die in dem aus zwei Protonen und zwei Elektronen bestehendem H2-Molekül herrschen. Die Anziehungskräfte überwiegen, daher resultiert insgesamt eine Anziehung der beiden Atome. Da diese Anziehung durch ein Elektronenpaar hervorgerufen wird, bezeichnet man diese Art der Bindung zwischen zwei Atomen auch als Elektronenpaarbindung. Andere Bezeichnungen dafür sind kovalente Bindung oder Molekülbindung. Die beiden Elektronen, die sich in der gemeinsamen Kugelwolke aufhalten und für die Bindung verantwortlich sind, werden Bindungselektronen, gemeinsames Elektronenpaar oder bindendes Elektronenpaar genannt.
Kovalente Bindung im Chlor-Molekül
Der Begriff "kovalente Bindung" ist etwas flexibler als der Begriff "Elektronenpaarbindung", obwohl beide ja das Gleiche bedeuten. Aber in der Chemie (und auch der Biologie) ist oft von "kovalenten Zuständen", "Aufhebung der Kovalenz", "kovalenter Charakter der Bindung" und so weiter die Rede. Daher sollten wir lieber von "kovalenter Bindung" sprechen als von "Elektronenpaarbindung", obwohl das ja auch nicht falsch ist.
Betrachten wir nun einen etwas komplizierteren Fall, nämlich das Element Chlor. Vom Chlor wissen wir, dass die Atome "gern" ein zusätzliches Elektron aufnehmen, um in den Argon-Zustand zu gelangen. Allerdings muss dazu ein passender Elektronendonator anwesend sein. Gibt man Chlor mit Natrium in ein Gefäß, so ist das kein Problem. Natrium gibt sofort sein einziges Außenelektron ab, und die Chlor-Atome nehmen das abgegebene Elektron auf (Donator-Akzeptor-Prinzip). Die Natrium- und die Chlorid-Ionen, die auf diese Weise entstehen, ziehen sich sofort gegenseitig an und bilden ein festes Kristallgitter (Ionenbindung).
Was aber, wenn kein Elektronendonator wie Natrium vorhanden ist? Wenn die Chlor-Atome nur unter sich sind?
Was dann passiert, sehen wir in den nächsten beiden Bildern:
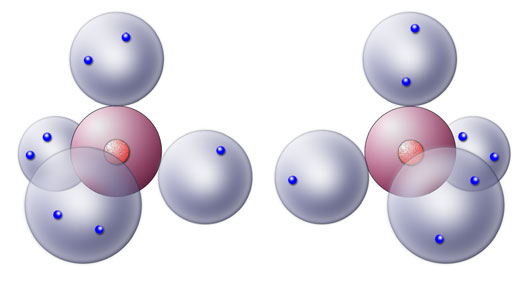
Zwei Chlor-Atome, strategisch geschickt gezeichnet
Autor: Ulrich Helmich, Lizenz: Public domain.
Hier sehen wir zwei Chlor-Atome. Jedes Chlor-Atom besitzt eine nur einfach besetzte Kugelwolke. Das erinnert doch irgendwie an die beiden H-Atome, die ebenfalls je eine einfach besetzte Kugelwolke besitzen...
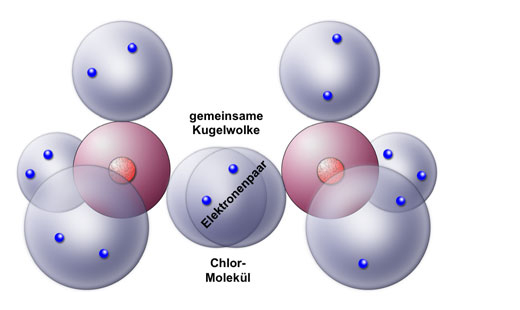
Elektronenpaarbindung zwischen zwei Chlor-Atomen
Autor: Ulrich Helmich, Lizenz: Public domain.
Genau wie die Kugelwolken der beiden H-Atome überlappen hier die beiden einfach besetzten Kugelwolken der Chlor-Atome, so dass eine gemeinsame Kugelwolke mit einem Elektronenpaar entsteht. Ein Chlor-Molekül ist entstanden.
Kovalente Bindung im Wasser-Molekül
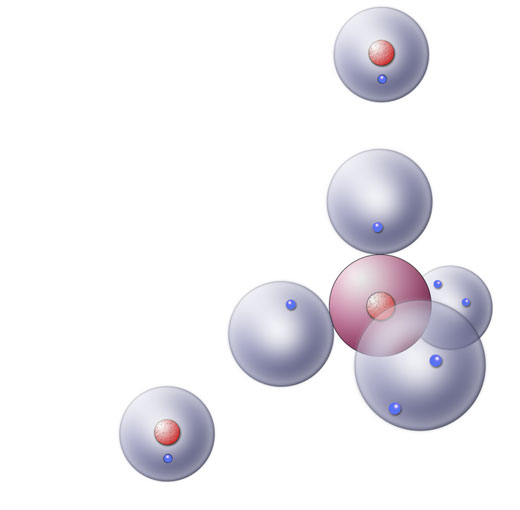
Ein Sauerstoff-Atom und zwei Wasserstoff-Atome
Autor: Ulrich Helmich, Lizenz: Public domain.
In diesem Bild sehen wir ein Sauerstoff-Atom und zwei Wasserstoff-Atome. Das O-Atom besitzt zwei einfach besetzte Kugelwolken. Jede dieser beiden Kugelwolken kann nun mit der einfach besetzten Kugelwolke eines H-Atoms überlappen:
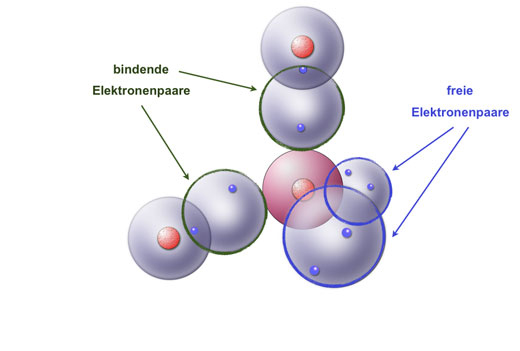
Bildung eines Wasser-Moleküls
Autor: Ulrich Helmich, Lizenz: Public domain.
So bildet sich ein H2O-Molekül.
Energetische Betrachtungen
Lässt man gasförmigen Wasserstoff mit gasförmigem Sauerstoff in einem Gefäß reagieren, so setzt eine exotherme chemische Reaktion ein, es bildet sich Wasser nach der bekannten Reaktionsgleichung
$2 H_{2_{(g)}} + O_{2_{(g)}} \to 2 H_{2}O_{(l)}$
Gasförmiger Wasserstoff und gasförmiger Sauerstoff treten also immer in Form von zweiatomigen Molekülen auf. In diesem Zustand befinden sich die H- und O-Atome aber bereits in dem idealen Edelgaszustand. Was bewegt nun die Atome der Ausgangsstoffe, ihre energetisch günstige Situation aufzugeben und sich zu Wasser-Molekülen umzulagern?
Um diese Frage zu klären, müssen wir uns näher mit den Bindungsdissoziationsenergien beschäftigen, die zwischen den Atomen eines Moleküls bestehen.
Eine kleine Rechnerei
Um die beiden H-Atome in einem H2-Molekül zu trennen, ist eine Bindungsdissoziationsenergie von 436 kJ/mol notwendig. Die Bindungsdissoziationsenergie für ein O2-Molekül beträgt 498 kJ/mol. Um ein "halbes" O2-Molekül zu zerlegen, sind also 249 kJ/mol notwendig. Bei der Bildung von Wasser aus Wasserstoff und Sauerstoff müssen wir also bisher 436 + 249 = 685 kJ/mol an Bindungsdissoziationsenergie aufwenden.
Betrachten wir nun das entstehende Wasser-Molekül. Hier haben wir zwei O-H-Bindungen vorliegen. Die Bindungsdissoziationsenergie für eine solche O-H-Bindung beträgt 463 kJ/mol, beide OH-Bindungen zusammen haben also einen Wert von 926 kJ/mol.
Nun müssen wir bei der Bildung eines Wasser-Moleküls aber keine O-H-Bindungen trennen, sondern im Gegenteil, es bilden sich zwei dieser OH-Bindungen. Das heißt, bei der Entstehung von Wasser-Molekülen werden 926 kJ/mol freigesetzt. Das ist ein deutlich höherer Energiebetrag als die 685 kJ/mol, die wir zum Spalten der H-H- bzw. O-O-Bindungen aufwenden mussten. Insgesamt beträgt die Reaktionsenergie der Wasserbildung also 685 - 926 = -241 kJ/mol.
Die Bildung von Wasser ist energetisch sehr günstig
Offensichtlich ist für die H- und O-Atome der Zustand "Wasser" energetisch günstiger als der Zustand "Mischung aus H2 und O2". Tatsächlich ist Wasser eines der stabilsten Moleküle überhaupt. Dies ist auch der Grund dafür, dass es zahlreiche chemische Reaktionen gibt, bei denen Wasser-Moleküle entstehen. Denken Sie beispielsweise nur an die Reaktion von Glucose und Fructose zu Saccharose, aus den beiden Monosacchariden bildet sich unter Abgabe von Wasser ein Disaccharid. Oder aus zwei Aminosäuren bildet sich unter Abgabe von Wasser ein Dipeptid. Solche Kondensationsreaktionen kommen sehr häufig in der organischen Chemie vor, unter anderem auch bei der Esterbildung, wo sich ein Alkohol und eine Carbonsäure zu einem Ester-Molekül vereinigen - unter Austritt eines Wasser-Moleküls.
Ammoniak und Methan
Und ganz am Ende dieses Abschnitts noch zwei weitere wichtige Moleküle, die uns in der Chemie immer wieder begegnen, Ammoniak und Methan.
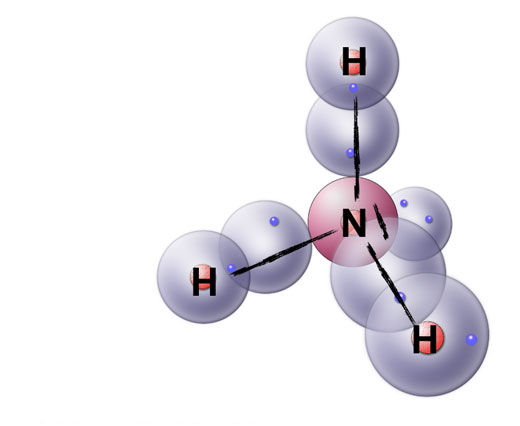
Das Ammoniak-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain.
Hier das Ammoniak-Molekül. Die Strukturformel wurde auf das Kugelwolkenmodell aufgezeichnet, damit Sie sich schon einmal an die einfachere LEWIS-Schreibweise gewöhnen. Bindende Elektronenpaare werden hier durch Striche zwischen den Atomen dargestellt, freie Elektronenpaare durch kurze Striche an den Atomen. Beim N-Atom ist das freie Elektronenpaar gut zu erkennen.
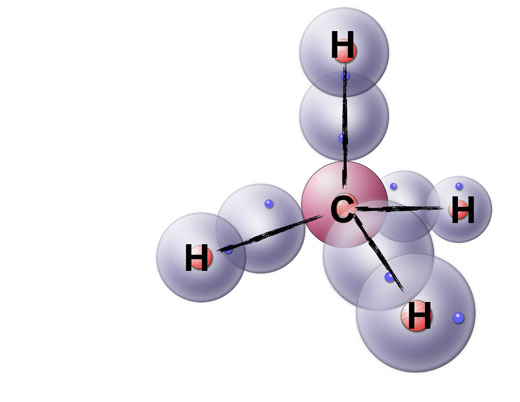
Das Methan-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain.
Und hier schließlich das Methan-Molekül mit seiner LEWIS-Strukturformel. Freie Elektronenpaare sind am C-Atom nicht zu finden, alle vier Kugelwolken sind einfach besetzt und überlappen mit den Kugelwolken von vier H-Atomen.
Energetische Betrachtungen zum Ammoniak und Methan
Wir gehen noch einmal zur Wikipedia-Seite mit den Bindungsdissoziationsenergien. Dort finden wir alle wichtigen Daten. Wir wollen nun Methan aus den Elementen bilden:
$C + 2H_{2} \to CH_{4}$
Es müssen also zwei H-H-Bindungen gespalten werden (2 x 436 kJ/mol = 872 kJ/mol Aufwand). Gebildet werden vier C-H-Bindungen (4 x 413 kJ/mol = 1252 kJ/mol). Also ist auch hier der Zustand " CH4" energetisch günstiger als der Zustand "C + 2 H2".
Aufgabe für Sie:
Berechnen Sie nun die Energiebilanz für die Bildung von Ammoniak aus gasförmigem Stickstoff N2 und Wasserstoff H2. Die Bindungsdissoziationsenergie für die N-N-Bindung beträgt 945 kJ/mol (Dreifachbindung!).
Die polare kovalente Bindung
Unter der Elektronegativität versteht man die Neigung eines Atoms, Bindungselektronen anzuziehen. Das Element mit der größten Elektronegativität ist das Fluor, sein EN-Wert (EN ist die halb-offizielle Abkürzung für Elektronegativität) wurde willkürlich auf den Wert 4,0 festgelegt. Wasserstoff hat dagegen einen recht geringen EN-Wert, nämlich nur 2,1. Das heißt, ein Wasserstoff-Atom zieht Elektronen einer kovalenten Bindung zwar auch an, aber lange nicht so stark wie ein Fluor-Atom das tut. Die beiden Bindungselektronen halten sich also mit einer höheren Wahrscheinlichkeit eher in der Nähe des Fluor-Atoms auf als in der Nähe des Wasserstoff-Atoms. Die kovalente Bindung hat daher ein eher negatives Ende und auf der Wasserstoff-Seite ein eher positives Ende. Man spricht dann von einer polaren kovalenten Bindung oder noch kürzer: von einer polaren Bindung.
Weitere Einzelheiten zur Elektronegativität und wie die Art der chemischen Bindung von der Elektronegativitäts-Differenz zweier Atome aussieht, erfahren Sie auf dieser Seite.
Seitenanfang -
Weiter mit der Metallbindung ...