Das Daltonsche Atommodell kann eine ganze Reihe von alltäglichen und auch chemischen Phänomenen gut erklären, aber viele andere Erscheinungen lassen sich mit dem doch recht einfachen Modell nicht mehr deuten.
Betrachten wir dazu einmal die Elektrolyse von Kochsalz, bei der am Minuspol Natrium bzw. Natronlauge und Wasserstoff und am Pluspol Chlor entstehen. Daltons Modell sagt nichts aus über elektrische Ladungen; die Atome (und Moleküle) von Dalton sind elektrisch neutral bzw. nicht geladen. Mit Hilfe des Dalton-Modells könnte man also nicht erklären, wieso Natrium-Teilchen zum Minuspol, Chlor-Teilchen dagegen zum Pluspol wandern.
Das Magnesium-Atom nach Thomson
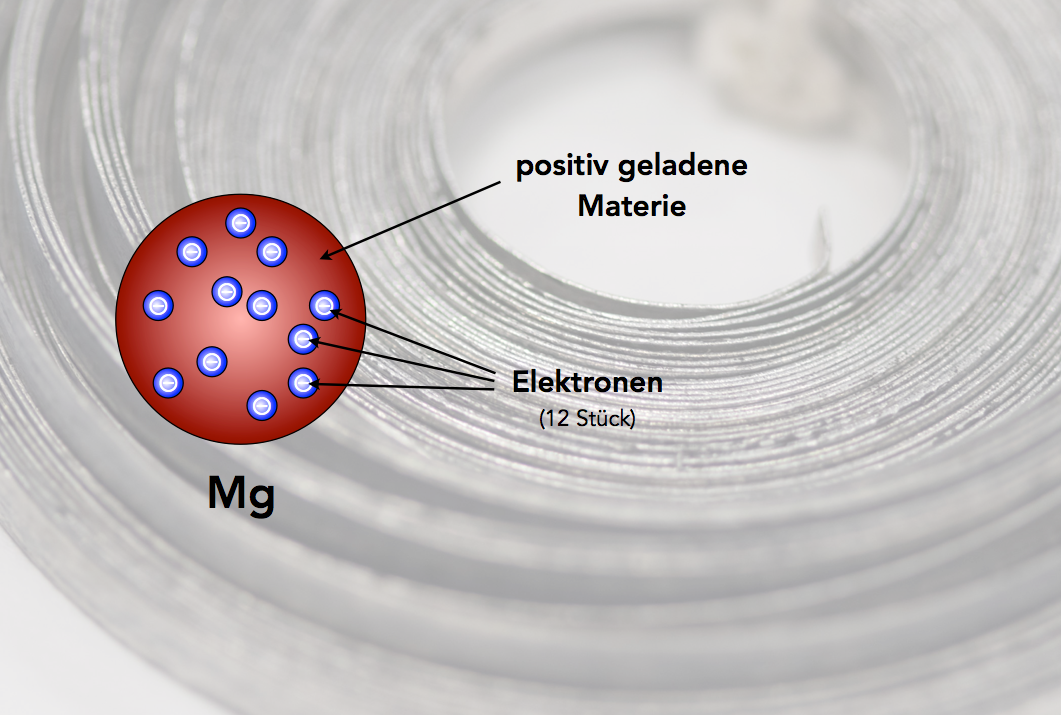
Ein Atom des Elements Magnesium (12) nach dem Rosinenkuchenmodell in drei Varianten
Hier sehen wir ein Magnesium-Atom (Element Nr. 12), wie es sich der britische Physiker Sir Joseph John THOMSON (1856 - 1940) ungefähr vorgestellt hatte.
Im Jahr 1897 fand J.J.Thomson bei einem Experiment mit Kathodenstrahlen in seinem Labor in Cambridge ein Teilchen, das negativ geladen war. Das war eigentlich noch nichts Besonderes. Negativ und positiv geladene Teilchen kannte man ja schon länger, man konnte nur nicht erklären, wie sie aufgebaut waren. Sensationell war dagegen die Tatsache, dass dieses Teilchen viel viel leichter war als das leichteste bisher bekannte Atom, nämlich das Wasserstoff-Atom. Thomson überlegte zunächst, ob vielleicht ein Atom in kleinere Teilchen zerfallen war, und dass die Elektronen - so nannte er diese winzigen Teilchen - in den Atomen der Kathode bereits enthalten waren.
Thomson entwickelte dann 1903 ein Atommodell, das dann von seinen Kritikern (von denen es viele gab) abfällig als "plum pudding model" bezeichnet wurde, auf Deutsch also so etwas wie "Rosinenkuchen-Modell".
Anfänglich nahem Thomson an, dass ein Atom unzählig viele Elektronen besitzt. Im Wasserstoff-Atom vermutete er 1.800 Elektronen [3]. Auf diese Zahl kam Thomson, als der die Masse eines H-Atoms mit der Masse eines Elektrons verglich. Von Protonen und Neutronen hatten die Chemiker der damaligen Zeit ja noch keine Ahnung, die Chemikerinnen übrigens auch nicht.
Thomson entwickelte sein Modell dann aber schnell weiter. In der Version von 1906 sollte ein Atom aus einer amorphen positiv geladenen Materie bestehen, in die die winzigen negativ geladenen Elektronen eingebettet sind. Die Zahl der Elektronen entsprach nunl der Ordnungszahl des Elementes. Magnesium-Atome sollten also 12 Elektronen enthalten.
Teils nahm Thomson sogar schon etwas das Kern-Hülle-Modell vorweg, indem er sagte, dass die Elektronen kreisförmig in einen runden "Pudding positiver Ladung" eingebettet sind.
1909 wurde der berühmte Rutherfordsche Streuversuch durchgeführt, der dann zu einem verfeinertem Atommodell führte, dem Kern-Hülle-Modell.
Das Rosinenkuchenmodell kennt Ionen
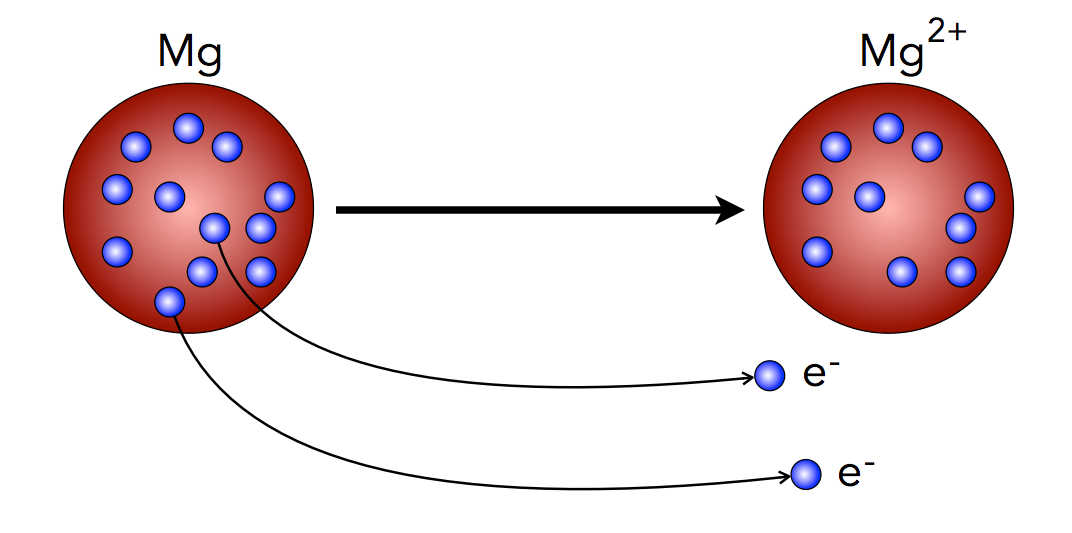
Bildung eines Magnesium-Kations nach dem Rosinenkuchenmodell
Die Zeichnung oben stellt ein Magnesium-Atom (Ordnungszahl = 12) nach dem Rosinenkuchenmodell von Thomson dar. In eine amorphe Masse mit zwölf positiven Ladungen (+12) sind zwölf Elektronen eingebettet, die zusammen zwölf negative Ladungen besitzen (-12). Nach außen hin ist das Mg-Atom also elektrisch neutral.
Nun verlassen zwei Elektronen dieses Atom, übrig bleibt weiterhin die amorphe Masse mit der Ladung +12, aber es fehlen zwei Elektronen, die negative Ladung beträgt nur noch -10. Die Ladung dieses Atoms hat jetzt den Wert +2. Solche geladenen Atome werden als Ionen bezeichnet, genauer gesagt als Kationen, wenn die Ladung positive Werte hat.
Befinden sich Kationen in einer wässrigen Lösung oder in einer Schmelze, so können sie von einer negativ geladenen Elektrode angezogen werden. Dies passiert beispielsweise bei der Elektrolyse von Kochsalz-Lösung. Die in der Lösung vorhandenen Natrium-Ionen Na+ werden von der negativen Elektrode angezogen und nehmen dort das fehlende Elektron wieder auf. Aus den Natrium-Ionen werden wieder "richtige" Natrium-Atome.
Auch die Existenz negativer Ionen, der sogenannten Anionen, kann man mithilfe des Thomson-Modells gut erklären.
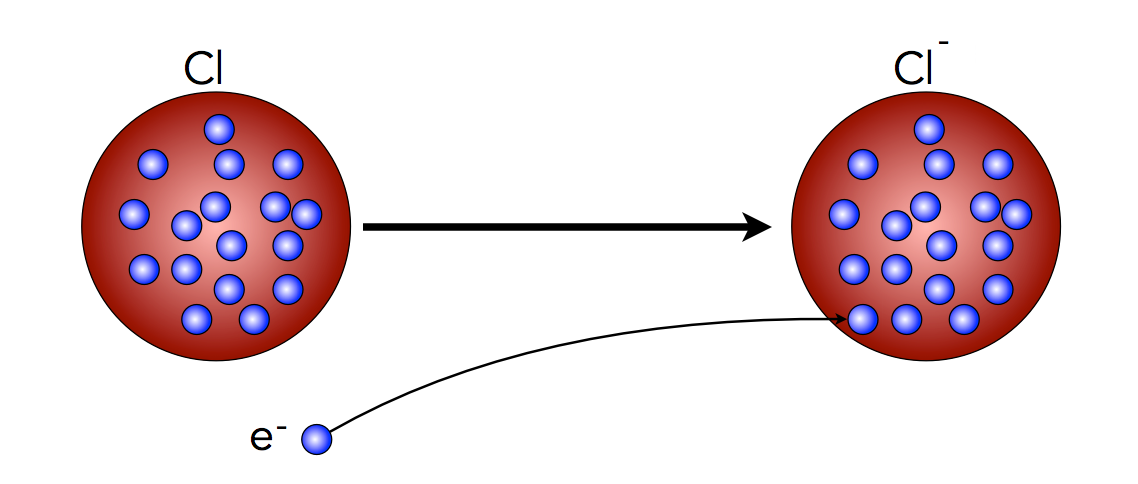
Die Bildung eines Chlorid-Ions nach dem Rosinenkuchenmodell
Hier sehen wir Chlor-Atom mit 17 Elektronen. Durch Aufnahme eines weiteren Elektrons entsteht ein einfach negativ geladenes Chlorid-Ion Cl- mit 18 Elektronen.
Befinden sich Anionen in einer wässrigen Lösung oder in einer Schmelze, so können sie von einer positiv geladenen Elektrode angezogen werden. Bei der Elektrolyse einer Kochsalz-Lösung wandern die Chlorid-Ionen zur positiven Elektrode und geben dort ihr überschüssiges Elektron ab. So entstehen aus den Chlorid-Ionen wieder "normale" Chlor-Atome.
Ionenbindung
Auch die Bildung chemischer Bindungen kann man mit dem Atommodell von Thomson gut erklären. Das Modell von Dalton kann das noch nicht.
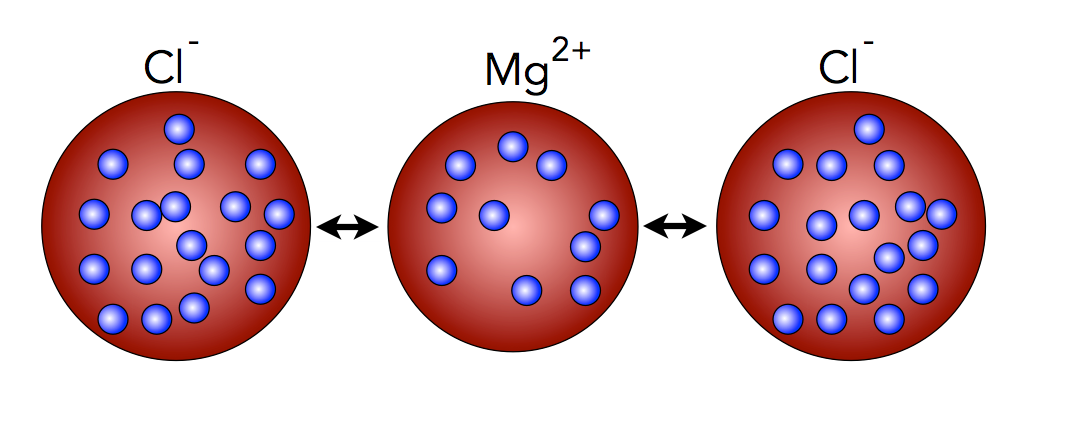
Ionenbindung nach Thomson
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das zweifach positiv geladene Magnesium-Ion zieht die einfach negativ geladenen Chlorid-Ionen elektrisch an. Ein jedes Magnesium-Atom kann dabei zwei Chlor-Atome mit Elektronen "versorgen", denn jedes Mg-Atom kann zwei Elektronen abgeben, jedes Cl-Atom kann aber nur ein Elektron aufnehmen.
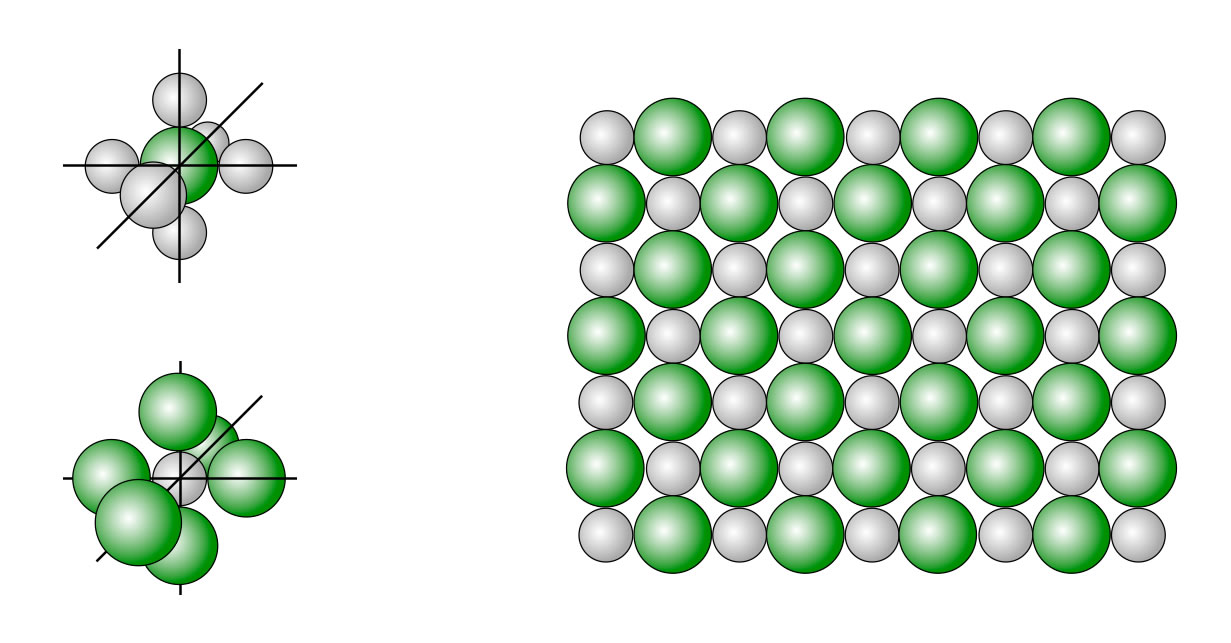
Bildung eines Salzkristalls
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Links oben sehen wir ein Anion, das von sechs Kationen umgeben ist. Darunter der umgekehrte Fall, also ein Kation, das von sechs Anionen umgeben ist. Rechts sehen wir eine "Schicht" aus einem Salzkristall. Auch hier ist jedes Anion von sechs Kationen umgeben und jedes Kation von sechs Anionen. Da nur eine Schicht aus diesem Kristall dargestellt ist, sieht man natürlich nur je vier Nachbarn und nicht sechs.
Zusammenfassung
Das Rosinenkuchenmodell
- Alle Aussagen von Dalton sind weiterhin gültig, allerdings sind die Atome nicht mehr massiv, sondern
- bestehen aus einer amorphen positiven Masse, in die so viele negativ geladene Elektronen eingebettet sind, so dass die Atome nach außen hin elektrisch neutral sind.
- Die Zahl der Elektronen entspricht der Ordnungszahl des Elementes.
- Atome können Elektronen abgeben und werden dann zu Kationen oder
- Atome können Elektronen aufnehmen und werden dann zu Anionen.
Wie Sie sehen, ist das Rosinenkuchenmodell eine Erweiterung des Kugelteilchenmodells von Dalton. Das Dalton-Modell wurde nicht "umgeworfen" oder ersetzt, sondern ergänzt. Für einfache Phänomene wie beispielsweise das Gesetz von der Erhaltung der Masse kann man weiterhin das Dalton-Modell verwenden. Komplexere Phänomene wie zum Beispiel die Elektrolyse einer Magnesiumchlorid-Lösung, wo Kationen und Anionen beteiligt sind, kann man allerdings nicht mehr mit dem Dalton-Modell erklären.
Schwächen des Rosinenkuchenmodells
Das Rosinenkuchenmodell hat natürlich auch noch Schwächen und kann viele Erscheinungen nicht erklären. Warum z.B. geben Natrium-Atome immer genau ein Elektron ab, Magnesium-Atome aber stets zwei? Solche Fragen können von dem Thomson-Modell nicht zufriedenstellend erklärt werden.
Allerdings spielt das Rosinenkuchenmodell für den modernen Chemieunterricht keine Rolle mehr, man könnte es auch ganz weglassen und gleich zum Schalenmodell übergehen. Dann würde man aber den Weg der Chemiker und Chemikerinnen etwas vernachlässigen, die in mühseliger Kleinarbeit die Atommodelle immer mehr verfeinert haben. Auch trägt die Beschäftigung mit solchen Atommodellen zum grundlegenden Verständnis des Modellcharakters bei. Es soll ja immer noch Schüler geben, die fragen, welches Atommodell denn nun das richtige ist. Vielleicht helfen solche historischen Betrachtungen etwas dabei, solche Fragen in Zukunft zu vermeiden.
Quellen:
- Brock, Viewegs Geschichte der Chemie, Braunschweig 1997.
- Britannica, Artikel "Thomson atomic model".
- Wikipedia, Artikel "Thomsonsches Atommodell".
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
weiter mit dem Kern-Hülle-Modell ...