Ernest Rutherford (1871 - 1937) wollte überprüfen, ob Atome wirklich so aufgebaut sind, wie sein Kollege Joseph John Thomson (1856 - 1940, Nobelpreis für Physik 1906) angenommen hatte. Dazu beschoss er eine dünne Folie aus Gold-Atomen mit alpha-Strahlen. Diese Strahlen entstehen beim radioaktiven Zerfall bestimmter Elemente wie Uran und bestehen aus zweifach positiv geladenen Helium-Atomen (also aus zwei Protonen und zwei Neutronen, wie man heute weiß).
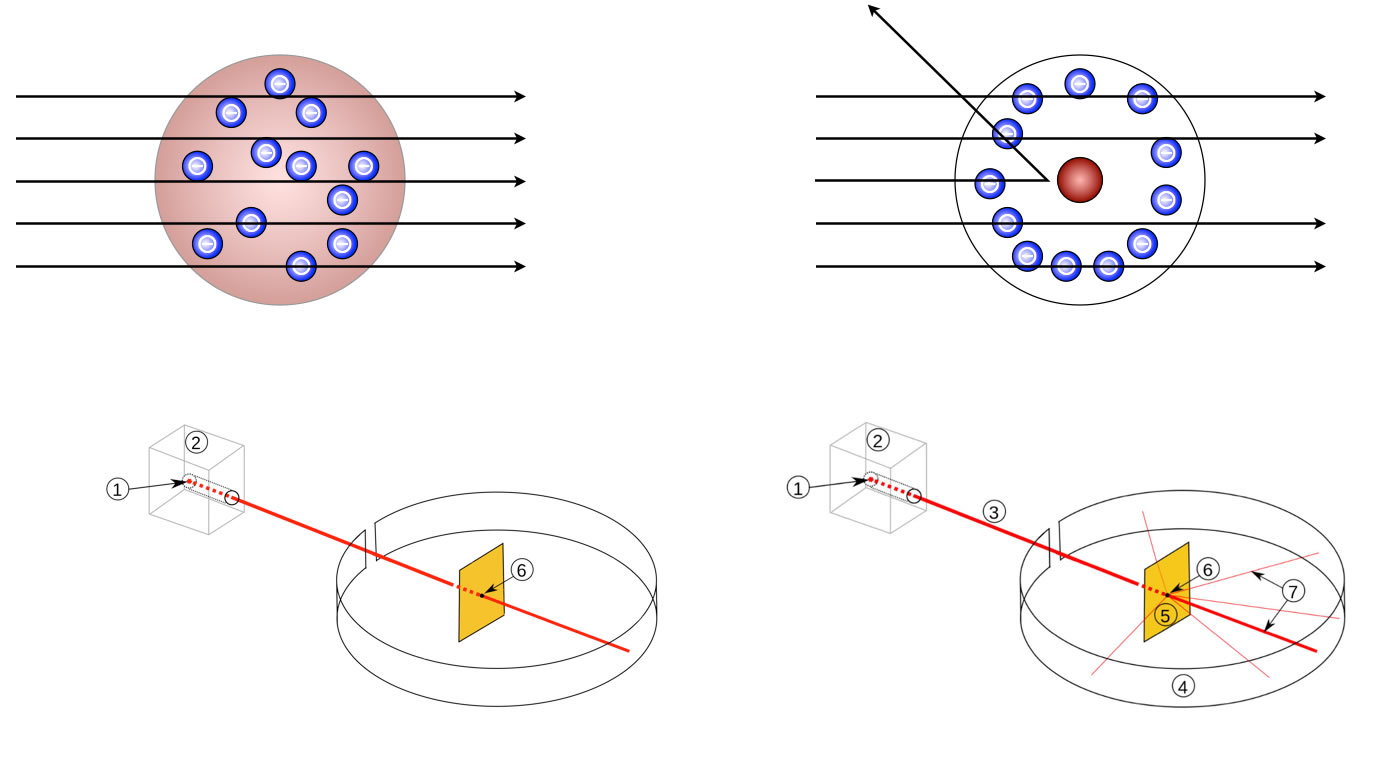
Der Streuversuch von Rutherford et al.
1: Radioaktives Radium, 2: Bleimantel zur Abschirmung, 3: Alpha-Teilchenstrahl, 4: Leuchtschirm bzw. Fotografieschirm 5: Goldfolie 6: Punkt, an dem die Strahlen auf die Folie treffen, 7: Teilchenstrahl trifft den Schirm, nur wenige Teilchen werden abgelenkt.
Autor: Ulrich Helmich (Atome) / Sundance Raphael (Versuchsanordnung, Quelle: Wikipedia), Lizenz: public domain
Wären die Gold-Atome so aufgebaut, wie von Thomson angenommen, so sollten sämtliche α-Teilchen ungehindert die amorphe positive Masse der Atome durchdringen. Diese Annahme ist in der obigen Abbildung links zu sehen. Die Elektronen sind hier nicht maßstabsgetreu gezeichnet, man muss sie sich viel kleiner vorstellen.
Die Versuchsergebnisse von Rutherford et al. sahen aber völlig anderes aus. Nur ca. 99% der α-Teilchen gingen ungehindert und geradlinig durch die 4000 Schichten von Gold-Atomen durch, aus denen die dünne Folie bestand. Ein paar der massiven α-Teilchen wurden jedoch abgelenkt oder sogar vollständig reflektiert.
Rutherford staunte nicht schlecht, als er diese Ergebnisse sah. Ich zitiere aus der englischen Wikipedia: "It was quite the most incredible event that has ever happened to me in my life. It was almost as incredible as if you fired a 15-inch shell at a piece of tissue paper and it came back and hit you."
Rutherfords Schlussfolgerung aus diesem berühmten Streuversuch: Atome bestehen keineswegs aus einer leicht durchdringbaren amorphen positiven Masse, in die Elektronen eingebettet sind, sondern die gesamte positive Ladung ist in einem extrem winzigen Atomkern konzentriert, während sich die Elektronen in der Atomhülle frei bewegen können.
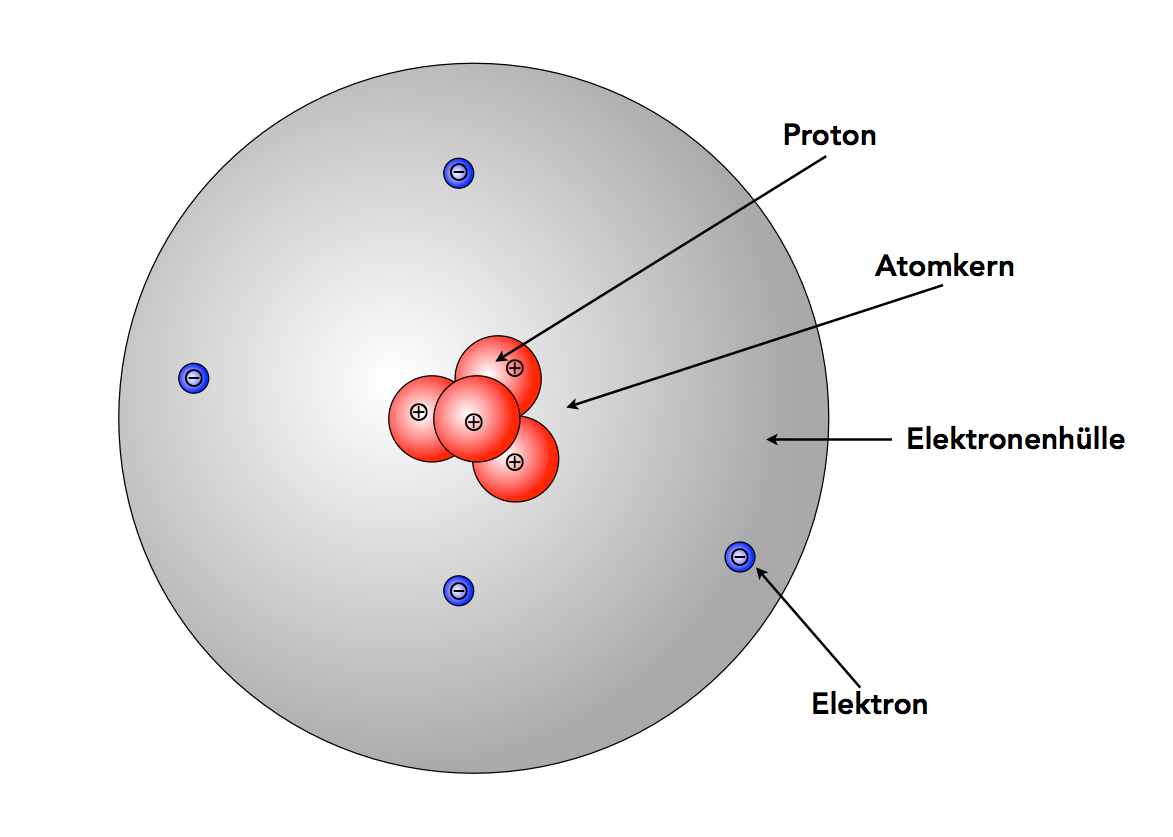
Ein Beryllium-Atom nach dem Kern-Hülle-Modell. Elektronen und Protonen sind viel zu groß gezeichnet, aber bei maßstabsgerechter Darstellung würde man nichts sehen können.
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier sieht man ein Beryllium-Atom (4 Protonen, 4 Elektronen) nach dem Kern-Hülle-Modell von Rutherford gezeichnet.
Das Kern-Hülle-Modell
- Fast alle Aussagen des Thomson-Modells, allerdings
- sind die Protonen in einem winzigen Atomkern konzentriert, die Elektronen befinden sich in einer Elektronenhülle.
Im Vergleich zum THOMSONschen Modell musste nicht viel geändert werden; fast alle Aussagen können übernommen werden. Nur die Existenz von Protonen ist neu, und die Tatsache, dass sich die Protonen in einem Atomkern konzentrieren.
Neutronen
Das Kern-Hülle-Modell kann nun um die Existenz von Neutronen erweitert werden, das sind elektrisch ungeladene Kernteilchen mit ungefähr gleicher Größe und Masse wie ein Proton. Neutronen wurden erst 1932 von James Chadwick entdeckt. Beryllium hat eine Atommasse von 9u. Da die vier Protonen zusammen eine Masse von nur 4u haben, müssen also fünf Neutronen im Atomkern vorhanden sind, um die Masse von 9u zu erklären.
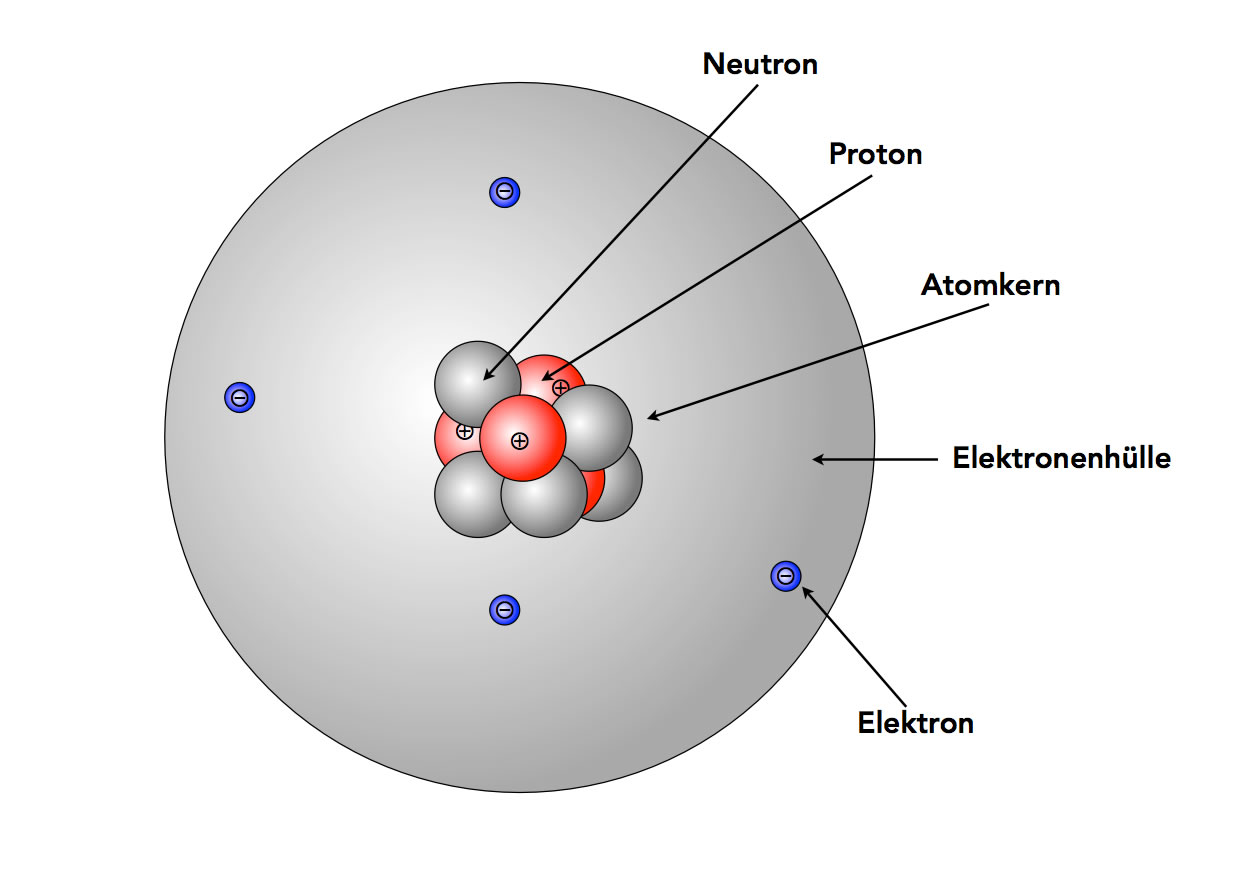
Ein Beryllium-Atom mit Neutronen nach dem Kern-Hülle-Modell
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier sehen wir das Beryllium-Atom mit vier Protonen und fünf Neutronen im Atomkern. Die Atommasse bzw. Kernmasse beträgt daher 9u.
Isotope
Die Existenz von Isotopen ist auf fehlende oder zusätzliche Neutronen im Atomkern zurückzuführen. Von vielen Elementen gibt es mehrere Isotope. Es gibt beispielsweise Wasserstoff-Atome, deren Atomkern aus einem Proton und einem Neutron besteht. Chemisch handelt es sich immer noch um das Element Wasserstoff, allerdings sind die physikalischen Eigenschaften des Stoffes Deuterium etwas anderes als die des Stoffes Wasserstoff, denn immerhin sind die Atome von Deuterium jetzt doppelt so schwer wie die Atome von Wasserstoff. Die Dichte von Deuterium beträgt zum Beispiel 0,17 kg/m3, während die Dichte von Wasserstoff nur 0,09 kg/m3 beträgt.
Seitenanfang -
Weiter mit dem Schalenmodell ...