Ernst Brücke hat bereits 1843 den Begriff "Membranpore" geprägt, als er über osmotische Prozesse schrieb.
Wilhelm Oswald (Chemie-Nobelpreis 1909) vermutete dann, dass die Zelle Ionen gezielt mit Hilfe von Kanälen durch die Membran transportiert. Allerdings hatte man damals noch keine Ahnung vom Aufbau der Membranen.
Frühe Erkenntnisse
a) Struktur
Durch chemische Analysen war schon Ende des 19. Jahrhunderts bekannt, dass Biomembranen aus Lipiden, also fettähnlichen Stoffen, bestehen. Die Anordnung der Lipidmoleküle, die Struktur der Biomembran also, wurde jedoch erst 1923 - 1925 von Gorter und Grendel aufgeklärt. Die beiden Forscher erkannten, dass die Lipide eine Doppelschicht bilden, bei der die hydrophilen "Köpfchen" nach außen bzw. zum Cytoplasma hin gerichtet sind, während sich die hydrophoben Fettsäurereste im Innern der Doppelschicht verbergen (lipid-bilayer-model).
b) Funktion
Durch Plasmolyse-Versuche oder Experimente wie dem Ionenfallen-Versuch wusste man, dass Biomembranen für bestimmte Teilchen undurchlässige Barrieren sind. Ungeladene Moleküle wie z.B. Wasser werden leicht durchgelassen, ebenso viele kleine bis mittelgroße lipophile Moleküle. Elektrisch geladene Ionen (Na+, K+, Neutralrot-Ion etc.) können die Membran jedoch nicht passieren.
Da die Struktur der Biomembranen noch nicht aufgeklärt war, konnte man sich Anfang des 20. Jahrhunderts diese selektive Permeabilität nicht erklären. Bereits mit dem Verständnis des Wassertransports bei den Plasmolyse-Versuchen hatte man Schwierigkeiten. Wie konnten bei einer Plasmolyse Wasser-Moleküle durch die Biomembran aus dem Zellinnern austreten?
Eine Lipid-Doppelschicht besteht bekanntlich aus drei Schichten: Im Zellinnern befinden sich die hydrophilen "Köpfe" der Phospholipide der inneren Lipidschicht. Ganz außen sind die hydrophilen "Köpfe" der Phospholipide der äußeren Lipidschicht. Und in der Mitte der Membran befinden sich die hydrophoben Fettsäuren der beiden Lipidschichten. Wasser-Moleküle, die die Membran von innen nach außen passieren wollen, müssen zunächst an der hydrophile Schicht der Zellinnenseite vorbei, was ja eigentlich kein Problem sein sollte. Dann kommt aber die innere Schicht der Biomembran, die ja aus hydrophoben Fettsäuren besteht. Hier haben die Wasser-Moleküle so gut wie keine Chance, sie werden von den hydrophoben Fettsäuren abgewiesen.
Der Wiener Physiologe Ernst Brücke schlug 1843 ein Modell vor, nach dem die Biomembran Poren enthält, die den Durchtritt von Wasser erlauben, größere Moleküle jedoch nicht passieren lassen. Mit diesem Modell konnte man die Versuche zur Plasmolyse und Osmose gut erklären.
Über die chemische Natur der postulierten Poren wusste Brücke natürlich noch nicht Bescheid; man kannte zwar bereits Proteine als chemische Verbindungen, hatte aber noch keine Ahnung davon, dass Proteine Bestandteile der Zellmembran sind.
Hodgkin et al. wiesen 1949 experimentell nach, dass während eines Aktionspotenzials die Permeabilität für Natrium-Ionen stark zunimmt, so dass Natrium-Ionen in das Axon einströmen können. Die Wissenschaftler stellten die Hypothese auf, dass die Membran der Nervenzelle winzige Poren enthält, durch die Na+-Ionen in die Zelle einströmen können.
Heute kennt eine Vielzahl von Ionen-Kanälen, die sich als integrale Proteine durch die Membran einer Zelle ziehen. Man kann sogar einzelne Ionenkanäle experimentell untersuchen, indem man sie mit einer winzigen Pipette ansaugt und manipuliert.
Das Filtermodell
Manche Ionen-Kanäle lassen nur Na+-Ionen passieren, andere Ionen-Kanäle lassen nur K+-Ionen durch. Wieder andere Ionen-Kanäle sind für Ca2+- oder Cl--Ionen zuständig. Um die unterschiedliche Permeabilität (Durchlässigkeit) der verschiedenen Ionen-Kanäle zu erklären, entwickelte man zunächst ein sehr einfaches Filtermodell: Poren mit kleinem Durchmesser lassen nur kleine Ionen durch, Poren mit größerem Durchmesser entsprechend größere.
Die Funktionsweise von Natrium-Kanälen kann man mit diesem Filtermodell leicht erklären: Natrium-Ionen sind wesentlich kleiner als Kalium-Ionen, da sie eine Elektronenschale weniger haben. Daher ist es klar, dass Poren, die Natrium-Ionen durchlassen, für die größeren Kalium-Ionen nicht permeabel sind.
Schwieriger wird die Erklärung für die Existenz der Kalium-Kanäle. Diese lassen nämlich die großen Kalium-Ionen durch, während Natrium-Ionen nicht passieren können, obwohl sie kleiner sind. Mit dem einfachen Filtermodell konnte man diese Beobachtung zunächst nicht erklären.
Irgendwann entdeckt man jedoch, dass Kalium-Kanäle nur hydratisierte Ionen durchlassen, nicht jedoch "nackte" Ionen, also Ionen, die nicht von einer Hülle aus Wasser-Molekülen (einer Hydrathülle) umgeben sind.
Nun ist es so, dass hydratisierte Kalium-Ionen kleiner sind als hydratisierte Natrium-Ionen. Das liegt daran, dass bei einem Natrium-Ion die positive Ladung auf ein sehr kleines Volumen verteilt ist, die Ladungsdichte eines Natrium-Ions ist sehr groß. Bei einem Kalium-Ion ist die positive Ladung auf ein sehr viel größeres Volumen verteilt, die Ladungsdichte eines Kalium-Ions ist also kleiner als die Ladungsdichte eines Natrium-Ions.
Zwischen der Ladungsdichte und der Größe der Hydrathülle besteht aber ein wichtiger Zusammenhang: Je größer die Ladungsdichte eines Ions, desto mehr Wasser-Moleküle können angelagert werden. Aus diesem Grund ist also die Hydrathülle eines Kalium-Ions kleiner als die eines Natrium-Ions.
Bald mehrten sich aber Beobachtungen, die man nicht mehr mit einem einfachen Filtermodell erklären konnte. Es wurden verschiedene Paare von Stoffen entdeckt, deren Moleküle oder Ionen zwar genau gleich groß sind (auch in hydratisierter Form), bei denen aber trotzdem nur der eine Stoff durchgelassen wird, der andere aber nicht. Mit Poren oder Kanälen konnte man solche Beobachtungen nicht erklären, es wurde ein besseres Modell notwendig, das Carriermodell des Membrantransports.
Das Carriermodell
Nach diesem Modell strömen die Ionen nicht mehr einfach durch einen Kanal, sondern binden sich spezifisch - nach dem Schlüssel-Schloss-Prinzip - an ein spezielles Transportprotein, einen sogenannten Carrier. Dieser Carrier transportiert das Ion dann durch die Membran. Die hohe Selektivität erklärt sich aus der spezifischen Bindung zwischen Ion und Carrierprotein.
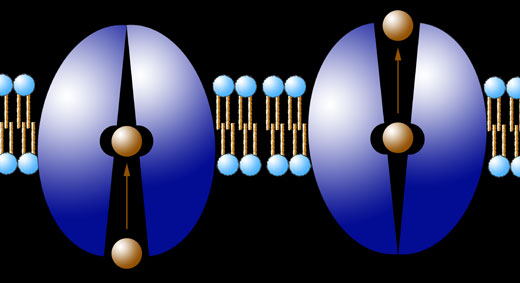
Transport von Teilchen nach dem Carrier-Modell
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Links sehen wir, wie sich ein Molekül von der Zellinnenseite dem Carrierprotein nähert und sich dann in eine spezifische Bindungsstelle hineinsetzt (Schlüssel-Schloss-Prinzip). Rechts ändert das Carrierprotein seine Konformation (Raumstruktur), das Protein "klappt" um, so dass sich die Bindungsstelle plötzlich auf der Zellaußenseite befindet: Das bisher gebundene Molekül kann nun in das Außenmedium abwandern.
Das Carriermodell hatte sehr viele Befürworter. Man hatte nämlich die chemische Struktur der Enzyme aufgeklärt und wusste, dass viele Enzyme hochselektiv arbeiten. Man wusste auch, dass Enzyme ein aktives Zentrum haben, mit denen sie ein Substrat sehr spezifisch binden können. Man wusste, dass Proteine (und damit auch Enzyme) ihre Konformation (räumliche Struktur) reversibel ändern können. Und auf ähnliche Weise, so stellte man sich vor, sollten auch die Carrier funktionieren.
Das moderne Porenmodell
In den 70er Jahren des 20. Jahrhunderts erkannte man, dass ein einzelner Ionenkanal sehr viele Ionen pro Zeiteinheit passieren lässt. Man ermittelte Werte von zehn Millionen Ionen pro Sekunde für einen einzigen Kanal. Ein Carrier, der für jedes einzelne Ion in der Membran seine Konformation durch Umklappen oder Drehen ändern muss, ist für eine solche Leistung viel zu langsam. Poren bzw. Kanäle hätten dagegen überhaupt kein Problem, so viele Ionen pro Sekunde zu transportieren. Musste nun das alte Porenmodell wiederbelebt werden?
Vergleichen wir noch einmal die beiden bisher vorgestellten Transportmodelle der Zellmembran:
| Eigenschaft | Porenmodell | Carriermodell |
| Selektivität bei gleich großen Teilchen | sehr gering | sehr groß |
| Selektivität bei unterschiedlich großen Teilchen | sehr groß | sehr groß |
| Geschwindigkeit des Transports | sehr groß | sehr klein |
Beide Modelle haben also ihre Vor- und Nachteile. Für den selektiven Transport vieler Ionen pro Sekunde wäre ein Mechanismus vorteilhaft, der die Selektivität von Carrierproteinen mit der hohen Transportgeschwindigkeit von Porenproteinen vereint. Ein solcher Mechanismus ist das modifizierte Porenmodell.
Modifiziertes Porenmodell
Die Moleküle oder Ionen strömen mit hoher Geschwindigkeit durch einen Kanal. Im Innern dieses Kanals befindet sich ein recht kleiner Selektivitätsfilter, an den die Teilchen kurzzeitig (für Bruchteile von Mikrosekunden) spezifisch (also nach dem Schlüssel-Schloss-Prinzip) andocken müssen. Gelingt dies, werden die Teilchen zum anderen Ende des Kanals weitergeleitet. Andernfalls können die Teilchen nicht passieren.
Ein solches modifiziertes Porenmodell nimmt man z.B. für den Transport von Natrium-Ionen an: Natrium-Ionen strömen in hydratisierter Form mit hoher Geschwindigkeit durch den wassergefüllten Kanal. Im Innern des Kanals befindet sich ein elektrisch geladenes aktives Zentrum, an dem die Ionen für eine extrem kurze Zeit (weniger als eine Mikrosekunde) andocken. Dazu müssen sie allerdings ihre Hydrathülle abstreifen. Nur das nackte Ion kann sich an das geladene Zentrum binden.
In dem Natriumkanal ist dieser Selektivitätsfilter so beschaffen, dass sich nur nackte Natriumionen an ihn binden können. Die nackten Kaliumionen sind zu groß dafür.
Nach dem Bindungsprozess werden die Natriumionen sofort wieder freigesetzt und sie umgeben sich mit einer neuen Hydrathülle. Aufgrund der herrschenden Konzentrations- und Ladungsgefälle gelangen sie dann auf die andere Seite der Membran.
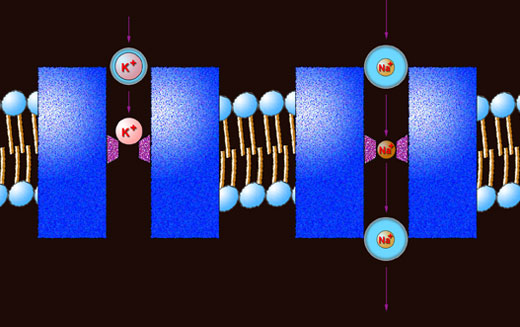
Transport von Ionen nach dem modifizierten Porenmodell
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Hier sieht man das Ganze noch einmal im Bild. Ein hydratisiertes Kalium-Ion gelangt in den Natrium-Kanal, wo es seine Hydrathülle verliert. Das nackte Kalium-Ion wird von dem Selektivitätsfilter nicht durch gelassen, weil es zu groß ist.
Das hydratisierte Natrium-Ion gelangt ebenfalls in den Natrium-Kanal und wird dehydratisiert. Das nackte Natrium-Ion passt durch den Selektivitätsfilter. Nach dem Passieren desselben erlangt es eine neue Hydrathülle und tritt in das Cytoplasma über.
Auf dieser Lexikon-Seite habe ich ausführlich die neueren Erkenntnisse zur Funktionsweise spannungsgesteuerter Kalium-Kanäle dargelegt.
Spannungsgesteuerte Ionenkanäle
Erst mit diesem modernen Porenmodell konnte man auch die Existenz elektrisch und chemisch gesteuerter Ionenkanäle erklären (in den modernen Schulbüchern spricht man jetzt übrigens von spannungsgesteuerten und ligandengesteuerten Ionenkanälen). Mit dem einfachen Porenmodell wäre das nicht gegangen, und Carrier sind wie bereits gesagt viel zu langsam für einen Ionenkanal.
Allgemeine Quellen:
- Sebastian Schütze, Die Funktion von KCNQ Kanälen bei Schmerz- und Tastempfinden. Dissertation im Fachbereich Biologie, Chemie, Pharmazie der Freien Universität Berlin, März 2016.
- Kandel, Schwartz, Jessel, Neurowissenschaften, Heidelberg, Berlin, Oxford 1996.
- Dudel, Menzel, Schmidt: Neurowissenschaft, Heidelberg 2001.
- R. F. Schmidt: Grundriss der Neurophysiologie, 6. Auflage, Springer-Verlag Berlin Heidelberg New York 1987