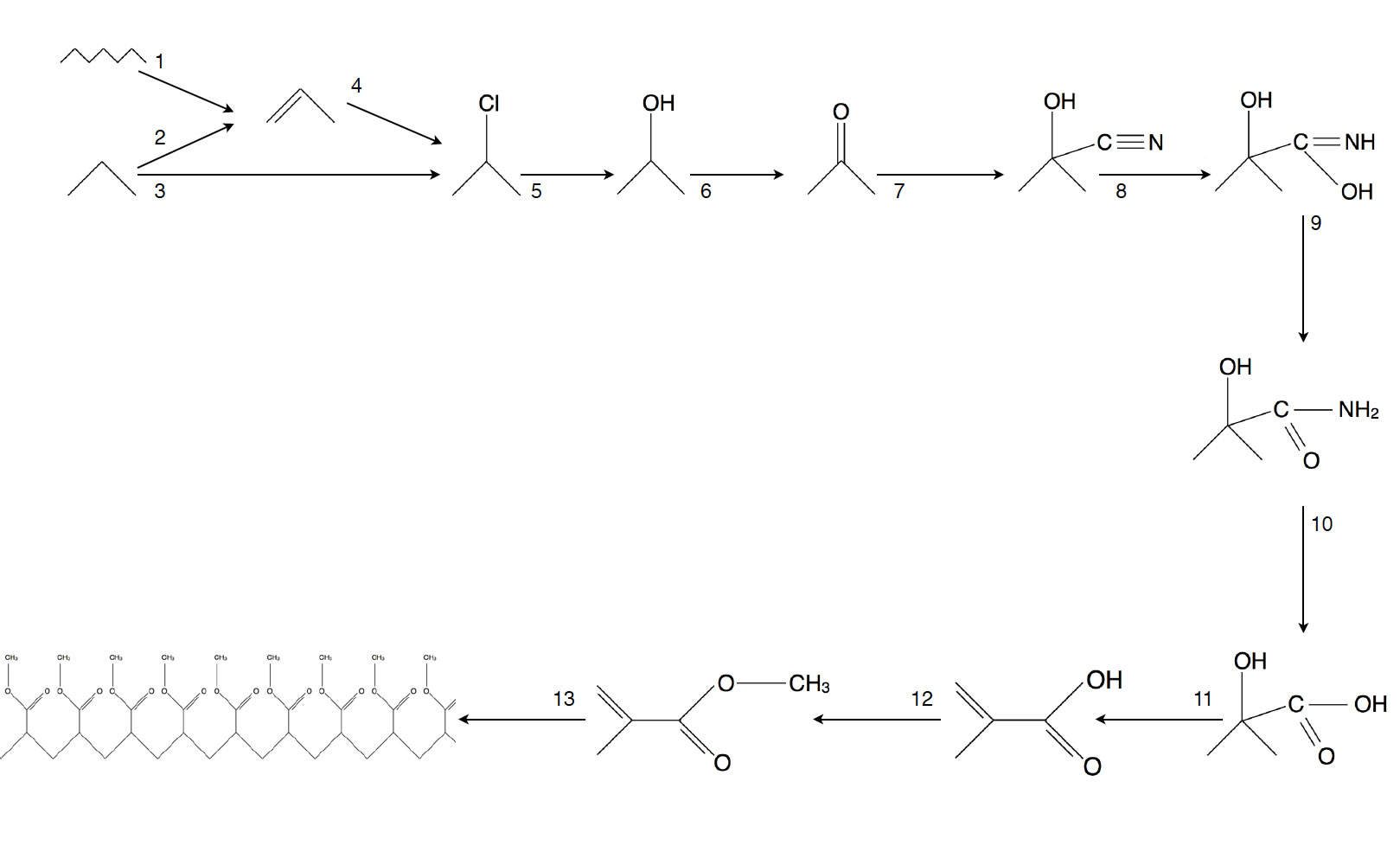
Organische Reaktionsketten sind ein wichtiges Thema beim schriftlichen Chemie-Abitur in NRW. Auch die meisten aktuellen Schulbücher haben sich darauf eingestellt, komplexe Reaktionsketten zu thematisieren. Eine dieser Reaktionsketten ist die Herstellung von Plexiglas aus einfachen Ausgangsstoffen wie Propan. Ich habe diese Reaktionskette auf dieser Seite in 13 Einzelschritte "zerlegt". Hauptquelle war der Buchner-Band Chemie 2000+, mit dem an meiner Schule vor einigen Jahren gearbeitet wurde, bevor wir auf den Schroedel-Band Chemie heute umgestiegen sind.
Zu dieser komplexen Reaktionskette habe ich eine Präsentation entwickelt, die Sie gerne hier herunterladen können. Einzelne Bilder dieser Präsentation werde ich im Folgenden besprechen. Schüler können sich auch ein Arbeitsblatt herunterladen, auf dem die 13 Schritte übersichtlich dargestellt sind, allerdings ohne nähere Angaben zu den Reaktionen, weil das sollen die S. ja selbst erarbeiten.
Reaktion 1-4: Herstellung von 2-Chlor-propan
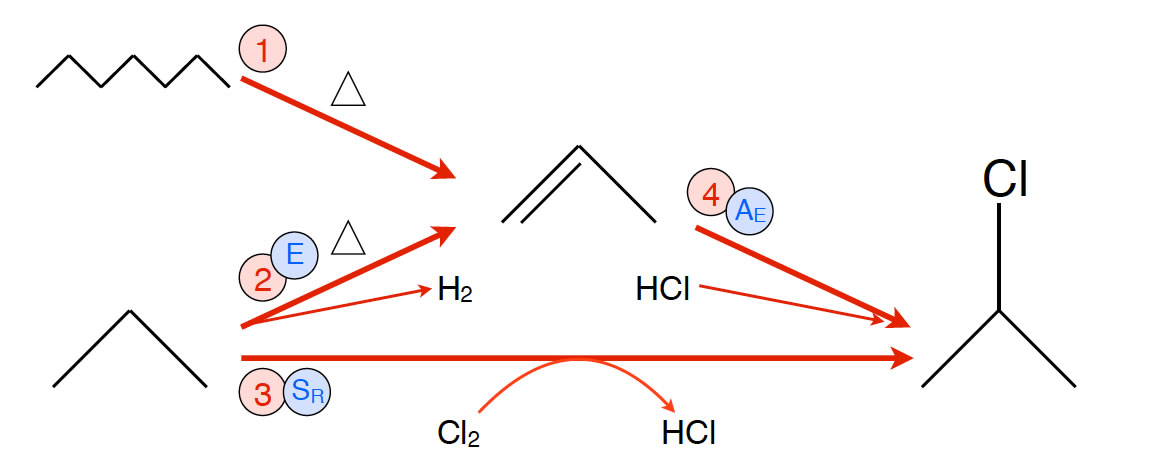
- Reaktion 1: Steamcracken von Erdöl liefert unter anderem Propen
- Reaktion 2: Dehydrierung von Propan liefert Propen
- Reaktion 3: Chlorierung von Propan liefert 2-Chlor-propan
- Reaktion 4: Hydrochlorierung von Propen liefert 2-Chlor-propan.
Der direkteste Weg wäre die Reaktion 3. In einer radikalischen Substitution wird Propan, das man leicht aus Erdgas gewinnen kann, mit Chlor umgesetzt und erhält in hoher Ausbeute das 2-Chlor-propan und als Nebenprodukt 1-Chlor-propan.
"2-Chlorpropan kann durch Chlorierung von Propan erhalten werden, wobei abhängig von der Temperatur zu großen Teilen auch 1-Chlorpropan entsteht (siehe auch Markownikow-Regel)."
Quelle: Wikipedia, Artikel "2-Chlorpropan"
Geht man den Weg über Reaktion 2 und 4, erhält man fast nur 2-Chlor-propan, weil sich bei der Hydrochlorierung (4) das Proton des Chlorwasserstoffs nach der Markownikow-Regel an das primäre C-Atom anlagert, so dass das stabilere sekundäre Carbenium-Ion entsteht. Allerdings ist dieser Weg etwas aufwendiger, da er ja aus zwei Reaktionen besteht. Zur Frage, wie jetzt tatsächlich in der Industrie 2-Chlor-propan gewonnen wird, findet man in der Wikipedia und auch in anderen Internet-Quellen keine weiteren Hinweise.
Reaktion 5-6: Herstellung von Aceton
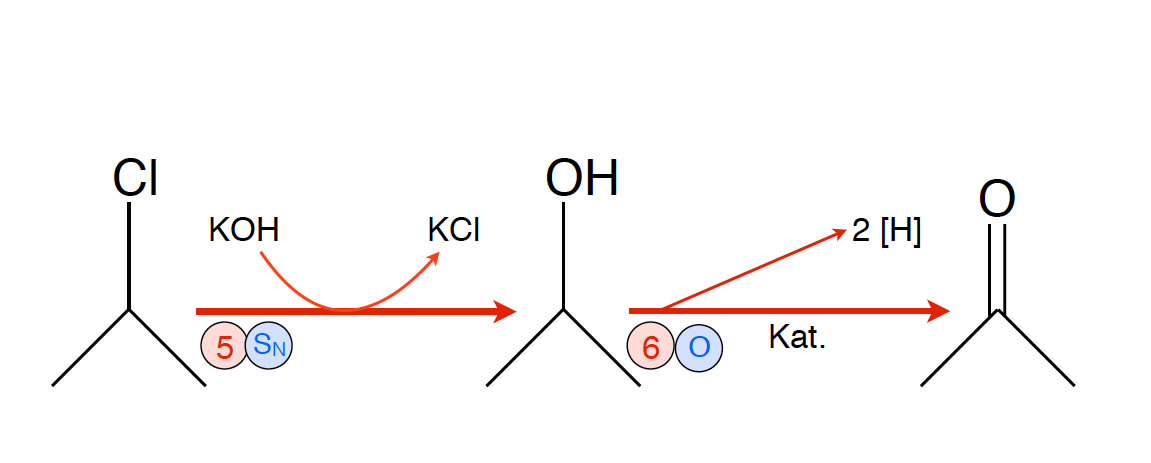
- Reaktion 5: Nucleophile Substitution, zum Beispiel mit KOH, liefert Propan-2-ol
- Reaktion 6: Oxidation des Propan-2-ol liefert Aceton
So zumindest wird das Verfahren in gängigen Schulbüchern dargestellt. Ob das industriell benötigte Aceton tatsächlich so hergestellt wird, ist fraglich.
"Das wichtigste Herstellungsverfahren von Aceton ist heutzutage das Cumolhydroperoxid-Verfahren, das auch als Phenolsynthese nach Hock bekannt ist".
Quelle: Wikipedia, Artikel "Aceton"
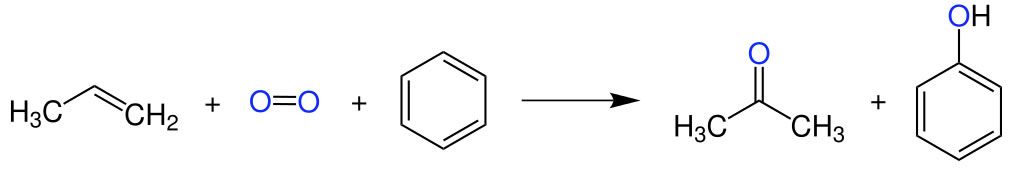
Das Cumol-Verfahren. Bild aus der Wikipedia.
Dieses Bild aus der Wikipedia zeigt in vereinfachter Weise das Cumol-Verfahren zur Aceton-Herstellung. Auf meiner eigenen Aceton-Seite habe ich dieses Verfahren ausführlicher dargestellt. In einigen Betrieben wird Aceton aber auch heute noch tatsächlich nach dem in der Präsentation beschriebenen Verfahren hergestellt, indem man Propan-2-ol oxidiert.
Reaktion 7: Bildung von Acetoncyanhydrin
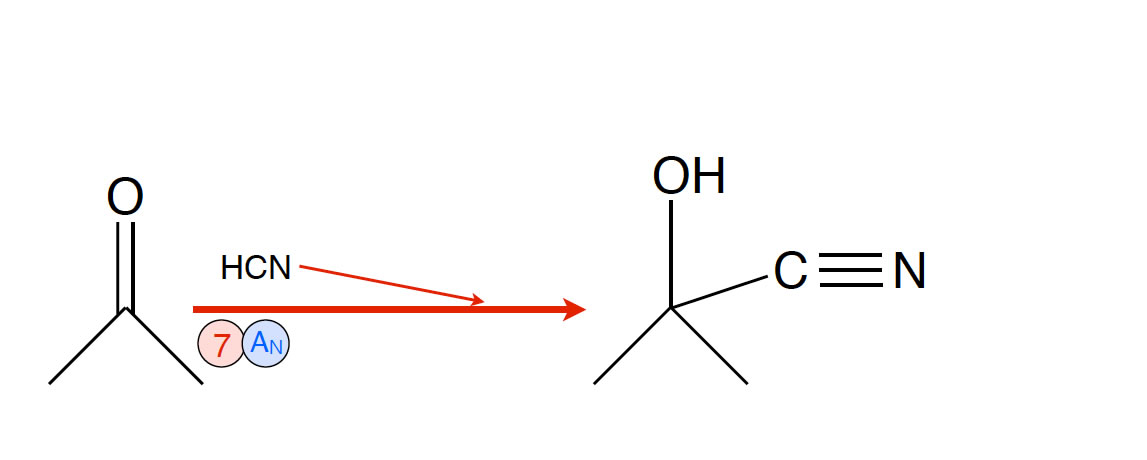
- Reaktion 7: Nucleophile Addition von Cyanwasserstoff (Blausäure) an Aceton. Es bildet sich ein Cyanhydrin als Zwischenprodukt, nämlich Acetoncyanhydrin.
Diese Verbindung ist ein wichtiges industrielles Zwischenprodukt, ein sogenannter C4-Baustein. Industriell wird Acetoncyanhydrin tatsächlich durch Addition von Cyanwasserstoff an Aceton hergestellt.
Reaktion 8-10: Bildung von 2-Carboxy-2-hydroxy-propanon
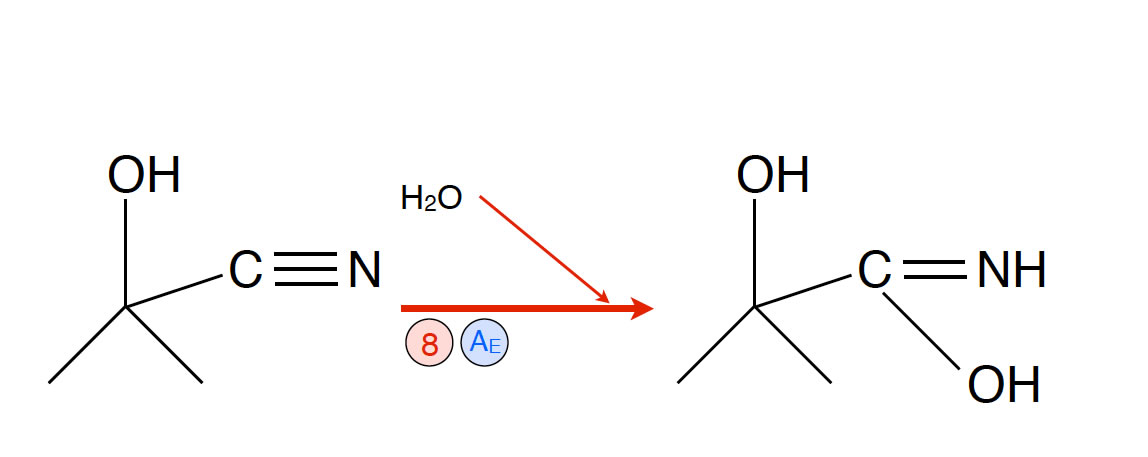
- Reaktion 8: Elektrophile Addition von Wasser das Cyanhydrin. Es bildet sich ein instabiles Zwischenprodukt.
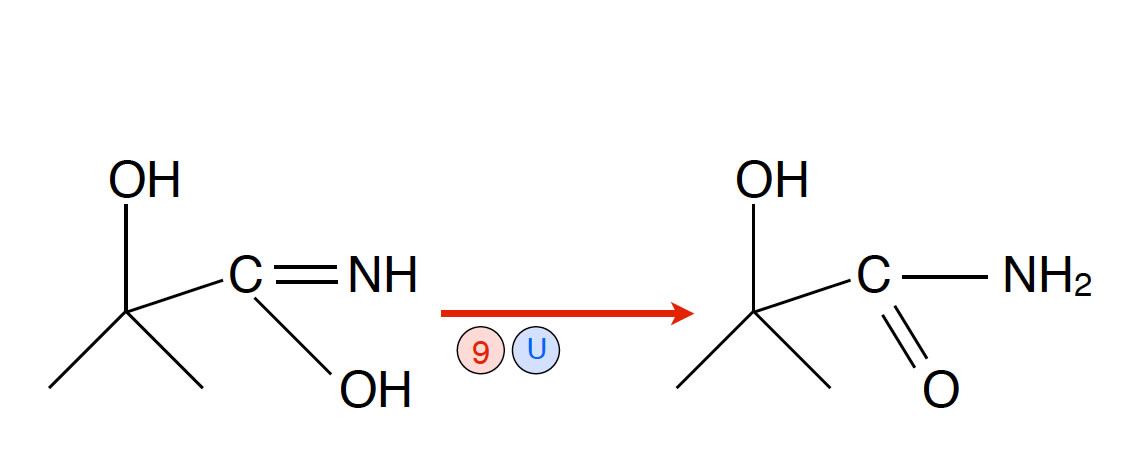
- Reaktion 9: Das instabile Zwischenprodukt lagert sich um in ein etwas stabileres Zwischenprodukt, das Methacrylamid. In der Industrie wird dazu Schwefelsäure als Katalysator eingesetzt.
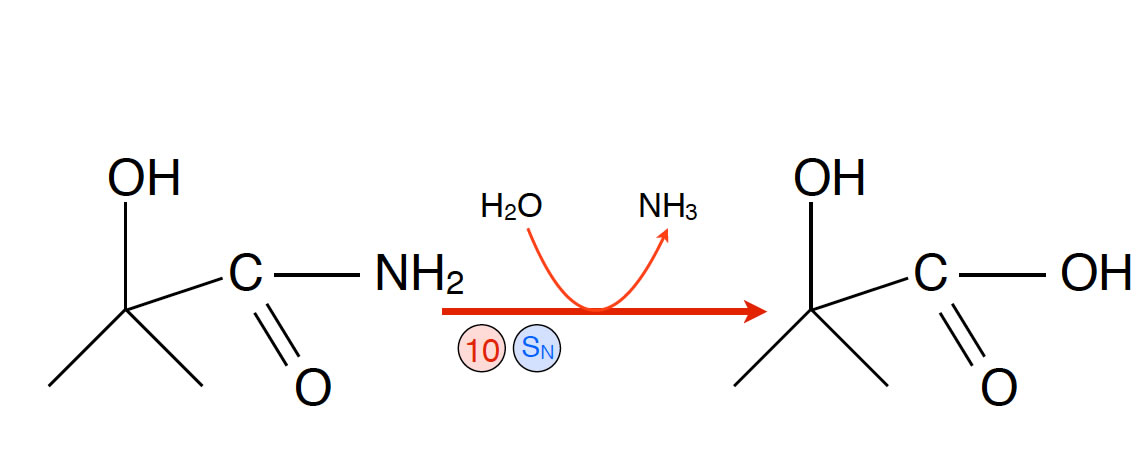
- Reaktion 10: Nucleophile Substitution der Aminogruppe durch eine Hydroxygruppe. Aus der CN-Gruppe des Cyanhydrins ist jetzt eine Carboxygruppe geworden.
Nach Schritt 10 hat man endlich wieder ein stabiles Produkt gewonnen, eine Hydroxy-Carbonsäure mit dem Namen 2-Carboxy-2-hydroxy-propan. Besser allerdings müsste man die Verbindung als Derivat der Propansäure benennen: 2-Hydroxy-2-methyl-propansäure. Die Bezeichnung in der Wikipedia ist 2-Hydroxy-isobuttersäure.
Reaktion 11: Bildung der Methacrylsäure
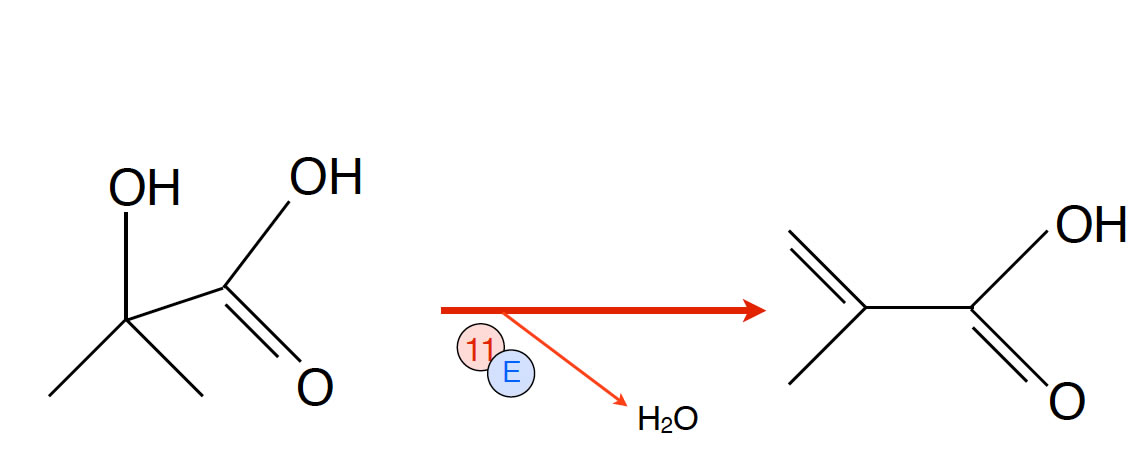
- Reaktion 11: Eliminierung von Wasser, auch Dehydratisierung genannt. Es entsteht das wichtige industrielle Zwischenprodukt Methacrylsäure.
Die Frage, die sich immer wieder stellt, wenn man Schulbücher betrachtet, ist die: Wird das Produkte in der Industrie tatsächlich so hergestellt wie im Buch beschrieben, oder hat man hier einen einfacheren didaktischen Ansatz gewählt, um die Schüler nicht zu überfordern?
"Mehr als 3 Millionen Tonnen Methacrylsäure werden jährlich
produziert, wobei ein erheblicher Teil von Synthesen anderer chemischer
Verbindungen ebenfalls über die Zwischenstufe Methacrylsäure gehen.
Industriell wird sie aus Isobutylen und tert-Butanol hergestellt, welche erst zu Methacrolein und dieses dann weiter zu Methylmethacrylat oxidiert werden. Synthetisch kann sie ebenfalls durch Hydrolyse von Acetoncyanhydrin und anschließende Wasserabspaltung hergestellt werden."
Quelle: Wikipedia, Artikel "Methacrylsäure"
Reaktion 12: Bildung des Methyl-Esters
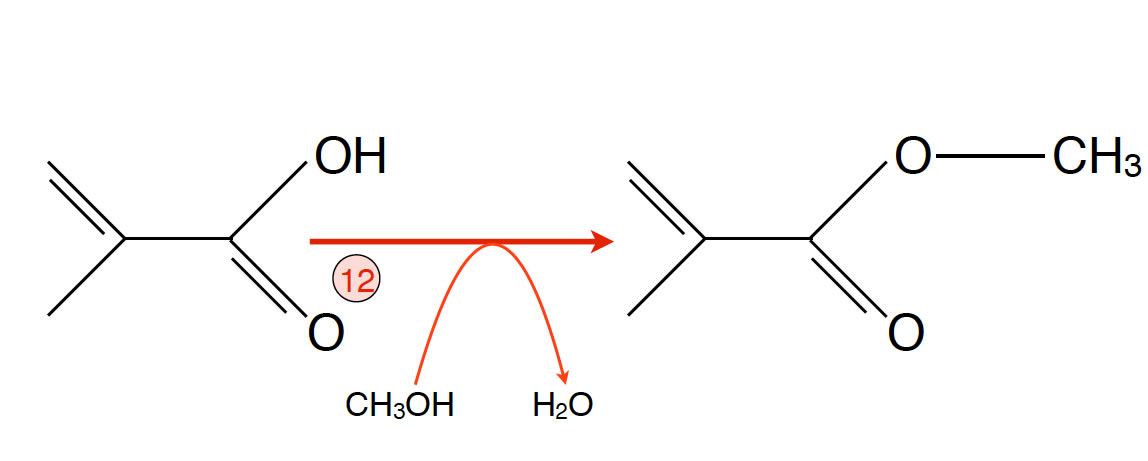
- Reaktion 12: Die Methacrylsäure wird jetzt mit Methanol verestert.
Das Produkt dieses Schrittes ist das Monomer des Plexiglases, der Methacrylsäure-methylester.
In der Industrie wird das Plexiglas-Monomer tatsächlich nach diesem Schulbuch-Verfahren dargestellt. Allerdings gibt es seit 2008 ein einfacheres Verfahren zur Synthese von Methacrylsäure-methylester, das von Ethen ausgeht. Zunächst wird Ethen mit Kohlenmonoxid und Methanol in einem Schritt umgesetzt, und es entsteht mit hoher Effizienz Propansäure-methylester. In einem zweiten Reaktionsschritt wird dieser Propansäure-methylester mit Methanal (Formaldehyd) zur Reaktion gebracht und dann dehydratisiert, dabei entsteht Methacrylsäure-methylester. Nähere Einzelheiten dazu siehe "Methacrylsäuremethylester" in der Wikipedia.
Reaktion 13: Synthese von Plexiglas
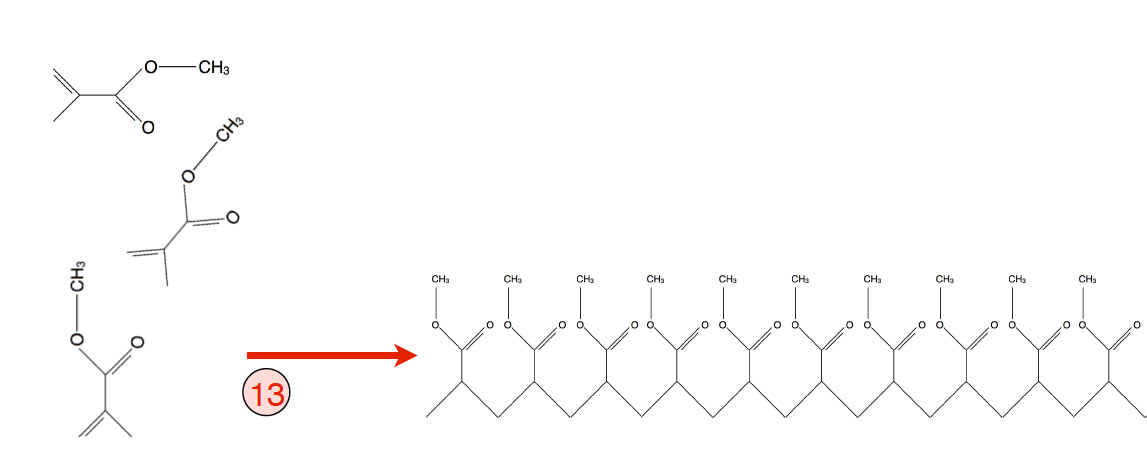
- Reaktion 13: In einer radikalischen Polymerisation entsteht jetzt das Endprodukt dieser Reaktionskette, das Plexiglas.
Man sollte allerdings bedenken, dass "Plexiglas" ein Markenname ist. An sich heißt das Polymer Acrylglas oder Polymethylmethacrylat.
Der Inhaber der Marke "Plexiglas" ist die Evonik Röhm GmbH, eine Tochtergesellschaft der Evonik Industries AG (Wikipedia).
Zusammenfassung
Als Zusammenfassung habe ich hier einen Screenshot des Arbeitsblattes eingefügt. Die genauen Angaben müssen die Schüler in das Arbeitsblatt noch eintragen.
Anwendungen
Wenn Sie überlegen, das Fach Chemie zu studieren, dann werden Sie dieser Reaktionsfolge wahrscheinlich noch des Öfteren begegnen. In seiner Fortgeschrittenen-Vorlesung zur Organischen Chemie stellt Prof. Dyker beispielsweise seinen Studierenden die folgende Denkaufgabe:
Aufgabe
Wie kann man die folgende Reaktion realisieren:

Mit den in der Unterrichtsreihe "Vom Propan zum Plexiglas" gelernten Fakten sollten Sie mit dieser Aufgabe eigentlich keine Schwierigkeiten haben.
Lösung
Hier ist die Lösung, die Prof. Dyker seinen Studierenden an die Kreidetafel geschrieben hat (richtig gelesen, an den Universitäten setzt man auch heute noch riesige Kreidetafel ein - neben modernen digitalen Medien).

Die beiden ersten Schritte zeigen die Elektrophile Addition von HBr an die C=C-Doppelbindung des Cyclohexens. Das Proton setzt sich so an die Doppelbindung, dass ein relativ stabiles tertiäres Carbenium-Ion entsteht (Markownikoff-Regel).
Im nächsten Schritt wird das Brom-Atom gegen eine Cyanid-Gruppe ausgetauscht (Nucleophile Substitution), diese wird dann durch Hydrolyse in eine Carboxy-Gruppe umgewandelt.