Fluorierung
Die Fluorierung eines Alkans ist grundsätzlich möglich. Beide Kettenfortpflanzungsschritte sind stark exotherm. Beim ersten Kettenfortpflanzungsschritt werden 163 kJ/mol freigesetzt, beim zweiten Kettenfortpflanzungsschritt sogar 388 kJ [1]. Die Reaktion setzt damit sehr große Energiemengen in kurzer Zeit frei. Aus diesem Grund ist die direkte Fluorierung mit elementarem Fluor äußerst gefährlich und kann leicht zu unkontrollierten Reaktionen, Überhitzung oder Explosionen führen.
Aus diesen Gründen führt man eine Fluorierung meistens nicht mit elementarem Fluor durch, sondern man nimmt spezielle Fluor-Verbindungen. Der Römpp listet hier Alkalifluoride, Cobalt(III)-fluorid, Halogenfluoride, Antimonfluoride, Molybdänfluoride, Fluorwasserstoff, Xenonfluoride, und Schwefeltetrafluorid auf [2]. Als typische Reaktion wird hier die Swarts-Reaktion genannt, die in der Wikipedia gut beschrieben ist [3].
Unerwünschte Nebenprodukte
Die Fluorierung von Alkanen ist häufig wenig sinnvoll, da sie zu einer Vielzahl unerwünschter Nebenprodukte führt.
Betrachten wir ein Alkan-Molekül, beispielsweise Ethan oder Propan. Welche Bindungen in diesem Molekül sind besonders schwach? Zur Abtrennung eines primären H-Atoms werden ca. 423 kJ/mol benötigt, zur Abtrennung eines sekundären H-Atoms nur 412 kJ/mol. Viel leichter lässt sich aber eine C-C-Einfachbindung auflösen, die Bindungsdissoziationsenthalpie beträgt hier nur 372 kJ/mol.
Rein energetisch betrachtet wäre es also günstiger, eine C–C-Bindung zu spalten als ein Wasserstoff-Atom zu abstrahieren. Dennoch dominieren bei der Chlorierung und Bromierung normalerweise H-Abstraktionen. Der Grund dafür liegt in sterischen Effekten: Die C–C-Bindungen im Inneren eines Alkan-Moleküls sind durch die umgebenden Wasserstoff-Atome abgeschirmt und für größere Halogen-Radikale nur schwer zugänglich.
Bei der Fluorierung ändert sich diese Situation jedoch. Fluor-Radikale sind sehr klein und können diese sterische Abschirmung deutlich besser überwinden. Dadurch werden bei der Fluorierung häufig auch C–C-Bindungen gespalten. Dies führt zu Fragmentierungen des Kohlenstoff-Gerüsts und damit zu einer Vielzahl unerwünschter Reaktionsprodukte, die mit einer gezielten Substitution wenig zu tun haben.
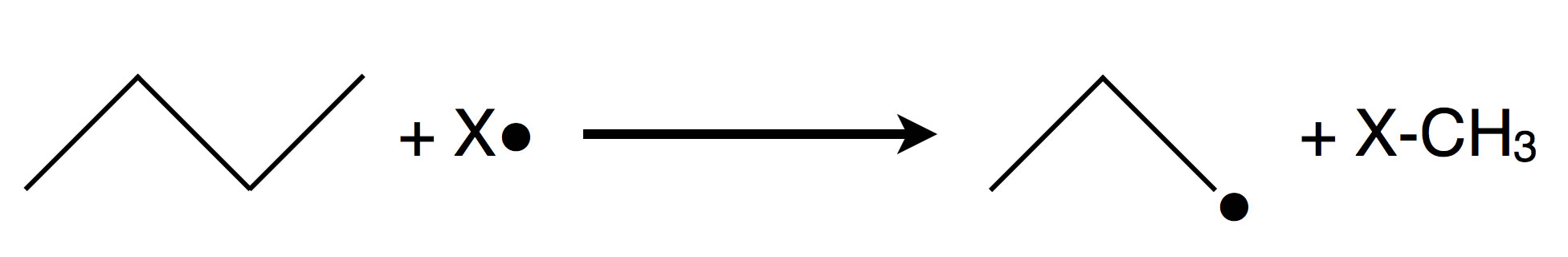
Ein freies Halogen-Atom spaltet eine C-C-Einfachbindung
Das Ergebnis einer Fluorierung - wenn sie dann wie geplant erfolgt und nicht viele Nebenprodukte liefert - sind Fluoralkane, die aber keine so besonders große Bedeutung haben. Eine größere technische und wirtschaftliche Bedeutung haben die Fluorchlor-Kohlenwasserstoffe, kurz FCKWs, die man durch Fluorierung von Chlor-Alkanen mit Fluorwasserstoff erhält. Hier sehen wir eine solche Reaktion [4]:
$CHCl_{3} + 2 \ HF \to CHClF_{2} + 2 HCl$
Heute ist die Herstellung und Verwendung vieler FCKW aufgrund ihrer ozonschädigenden Wirkung stark eingeschränkt oder verboten.
Iodierung
Auch die Iodierung eines Alkans ist prinzipiell möglich. Im Gegensatz zur Fluorierung verlaufen die Kettenfortpflanzungsschritte jedoch energetisch ungünstig. Für die beiden Fortpflanzungsschritte der radikalischen Iodierung müssen insgesamt etwa 29 kJ/mol aufgewendet werden. Die Reaktion ist damit endotherm und thermodynamisch nicht begünstigt [1].
Hoher Energiebedarf
Der hohe Energiebedarf liegt nicht an der Spaltung des Iod-Moleküls. Im Gegenteil: Aufgrund der relativ geringen Bindungsdissoziationsenthalpie lässt sich ein Iod-Molekül sogar leichter homolytisch spalten als ein Chlor- oder Brom-Molekül.
| Molekül | Bindungsdissoziationsenthalpie |
| F-F | 159 kJ/mol |
| Cl-Cl | 242 kJ/mol |
| Br-Br | 193 kJ/mol |
| I-I | 151 kJ/mol |
Das eigentliche Problem bei der Iodierung ist die Bildung des Iodwasserstoffs HI. Der Energiegewinn bei der HI-Bildung beträgt nur 295 kJ/mol, das ist sehr wenig im Vergleich zur Bildung von HBr (366 kJ/mol) oder HCl (431 kJ/mol) [6]. Dadurch ist der Energiegewinn der Reaktion zu gering, um die Kettenreaktion effektiv aufrechtzuerhalten.
Iod als Inhibitor
Ein Alkyl-Radikal kann durchaus mit einem Iod-Molekül reagieren. Es entsteht dann ein Iodalkan-Molekül und ein Iod-Radikal.
$I_2 \ + \ \bullet CH_3 \to I \bullet \ + \ I \text{-} CH_3 $
Das gebildete Iod-Radikal ist jedoch kaum in der Lage, die Kettenreaktion fortzusetzen. Die Abstraktion eines Wasserstoff-Atoms aus einem Alkan durch ein Iod-Radikal ist endotherm und damit energetisch ungünstig. Aus diesem Grund wirkt Iod in radikalischen Reaktionen häufig sogar als Inhibitor.
Alternative Wege
Möchte man gezielt ein bestimmtes Iodalkan synthetisieren, beschreitet man meistens andere Wege, zum Beispiel über die nucleophile Substitution eines Chloralkans mit Iodid-Ionen (Finkelstein-Reaktion) oder die Addition von Iod I2 oder Iodwasserstoff HI an ein Alken.
Finkelstein-Reaktion
Hierbei handelt es sich um eine klassische nucleophile Substitution.
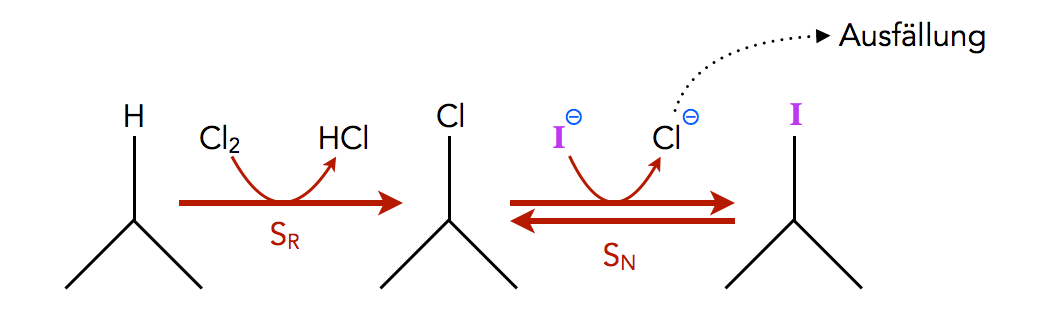
Propan wird erst chloriert, dann wird in einer nucleophilen Substitution das Chlor durch Iod ersetzt
Autor: Ulrich Helmich 2022, Lizenz: Lizenz: CC BY-NC-SA 4.0
An einem Chloralkan wird das Chlor-Atom durch ein Iod-Atom ersetzt. Als Nucleophil setzt man dazu Natriumiodid ein, das in Aceton gelöst wurde. Die Reaktion verläuft nach einem SN2-Mechanismus, bei dem das Iodid-Ion das Halogen-Atom von der Rückseite angreift und verdrängt.
Um die Gleichgewichtslage der Reaktion auf die Produktseite zu verschieben, fällt man das entstandene Chlorid aus der Lösung aus, so dass dessen Konzentration stets gering gehalten wird (Prinzip des kleinsten Zwangs) [5].
Quellen:
- Fox, M. A.; Whitesell, J. K.: Organische Chemie – Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage. Heidelberg: Spektrum Akademischer Verlag, 1995.
- Falbe, J.; Regitz, M. (Hrsg.): Römpp Chemie Lexikon. 9. Auflage. Stuttgart, New York: Georg Thieme Verlag, 1989–1992.
- Wikipedia, Artikel "Swarts-Reaktion"
- Wikipedia, Artikel "Fluorchlorkohlenwasserstoffe"
- Wikipedia, Artikel "Finkelstein-Reaktion"
- Organikum: Organisch-chemisches Grundpraktikum. 22. Auflage. Weinheim: Wiley-VCH, 2004.