Molekülorbitale am Beispiel H2
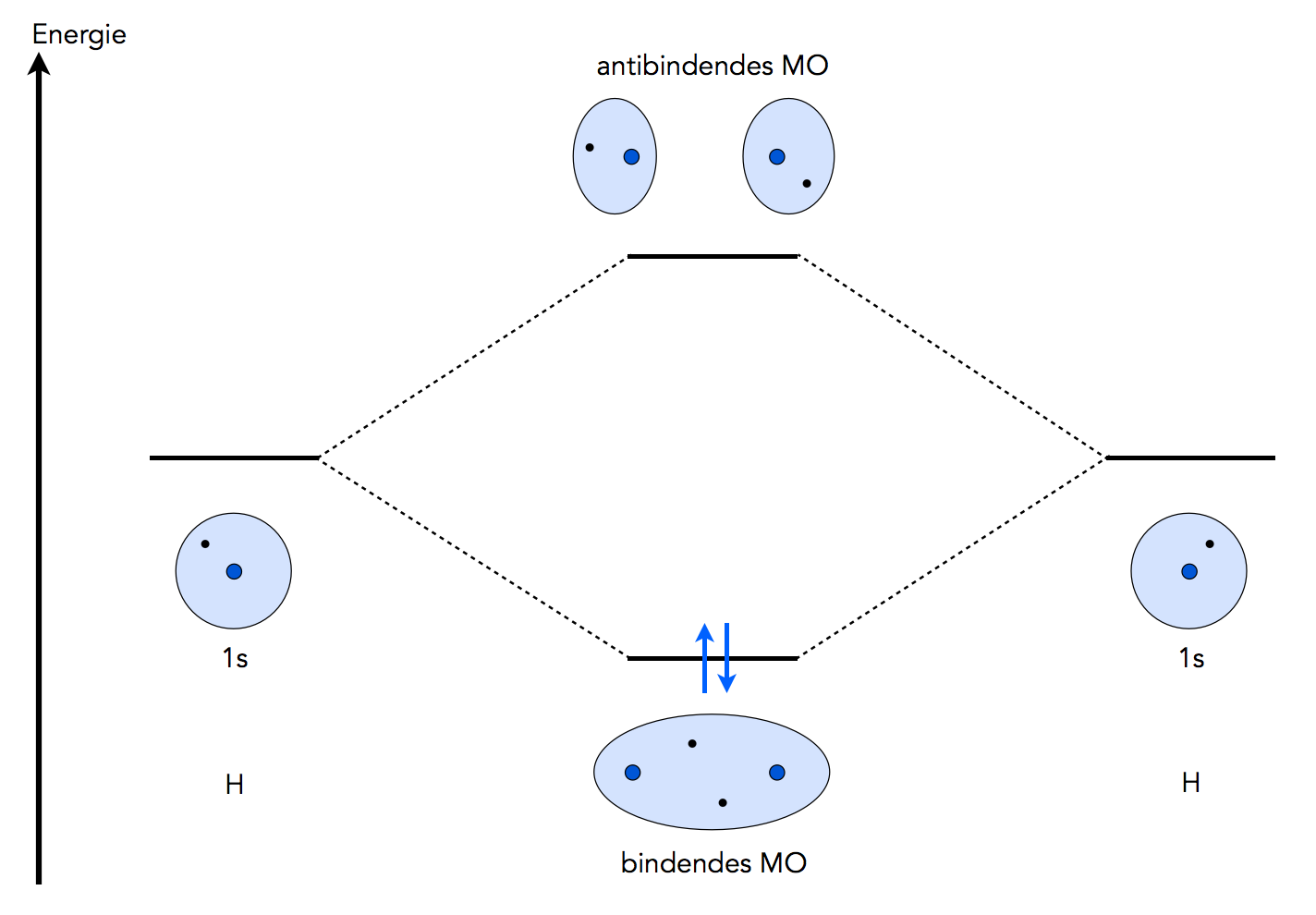
Molekülorbitale (MOs) des H2-Moleküls
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Dieses Bild zeigt, wie die kovalente Bindung zwischen zwei H-Atomen in einem H2-Molekül nach der Molekülorbital-Theorie (MO-Theorie) zustande kommt.
Das 1s-Orbital des einen H-Atoms kann mit dem 1s-Orbital eines zweiten H-Atoms ein energieärmeres, bindendes Molekülorbital (kurz: MO) bilden. Man kann sich leicht vorstellen, dass sich die beiden Bindungselektronen die meiste Zeit ungefähr in der Mitte zwischen den beiden Atomkernen aufhalten und daher durch ihre negative Ladung die beiden Kerne zusammenhalten.
In dem Diagramm in Abbildung 1 sind die Energieniveaus dieser Orbitale eingezeichnet. Eine direkte Messung des Energieniveaus eines einzelnen Atomorbitals ist nicht möglich, man kann aber messen, wie viel Energie bei der Bildung des Molekülorbitals freigesetzt wird. Man weiß daher, dass das entstandene, mit zwei Elektronen besetzte MO energetisch deutlich tiefer liegt als die 1s-Atomorbitale der beiden Wasserstoff-Atome. Das ist ja auch der Grund, warum diese Reaktion - Bildung von H2 aus zwei H-Atomen - überhaupt stattfindet.
Wir sehen aber noch etwas anderes, total Interessantes in diesem Diagramm. Neben dem bindenden MO existiert auch noch ein sogenanntes antibindendes Molekülorbital. Hier weichen die beiden Atomorbitale sozusagen voreinander aus, die Elektronen befinden sich nicht zwischen den Atomkernen, sondern auf entgegengesetzten Seiten. Das antibindende MO ist normalerweise nicht mit Elektronen besetzt, weil das Energieniveau dieses MOs sehr hoch ist, sehr viel höher als die Energieniveaus der Atomorbitale. Darum sind in dem Diagramm auch keine Pfeile in dem antibindenden MO eingezeichent.
Was hat das Ganze nun mit der radikalischen Substitution zu tun?
Das ist eine gute Frage, die sogleich beantwortet werden soll. Aber haben Sie noch etwas Geduld. Betrachten Sie zunächst das folgende Bild:
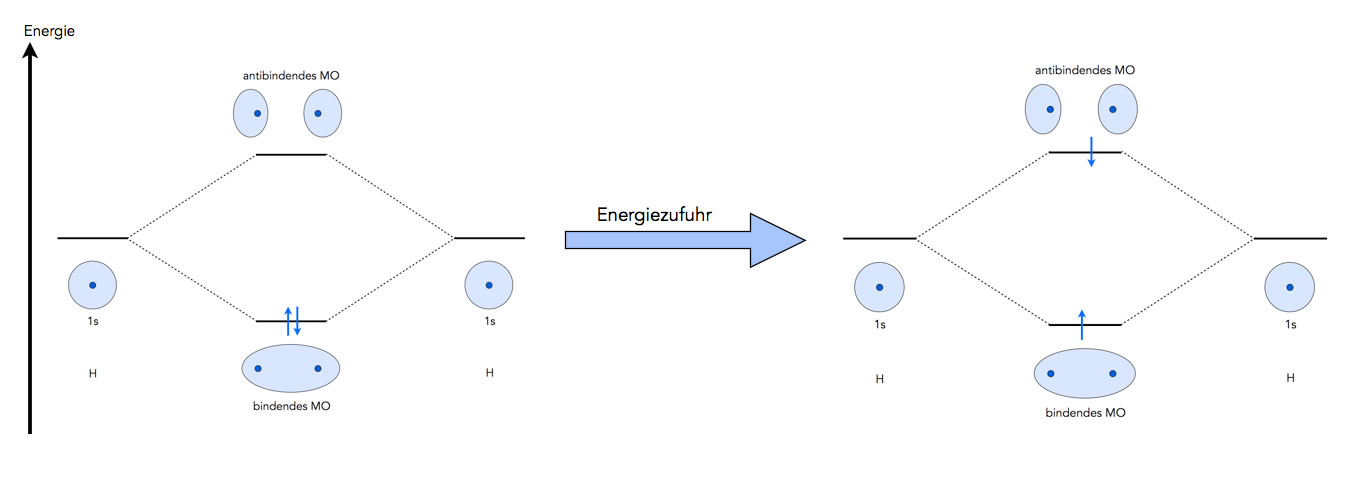
Trennung der H-H-Bindung durch Energiezufuhr
Autor: Ulrich Helmich 2022, Lizenz: Public domain
H2-Moleküle werden durch Zufuhr von viel Energie in ihre Atome gespalten. Nach der MO-Theorie funktioniert diese Spaltung folgendermaßen: Die Energie, die zugeführt wird, promoviert (befördert) eines der beiden Bindungselektronen aus dem bindenden MO in das antibindende MO.
Jetzt haben wir also ein bindendes MO mit nur noch einem Elektron, und gleichzeitig ein antibindendes MO, ebenfalls mit einem Elektron. Die Wirkungen von bindendem und antibindendem MO heben sich aber gegenseitig auf. Das ist quasi so, als wären beide MOs gar nicht mehr vorhanden. Und genau das ist ja der Zustand, in dem sich zwei einzelne H-Atome befinden.
Startreaktion der radikalischen Substitution
Bei der Photolyse von Chlor- oder Brom-Molekülen findet ebenfalls eine Energiezufuhr statt, welche die beiden Moleküle in die einzelnen Atome zerlegt. Diese homolytische Bindungsspaltung funktioniert im Prinzip genau so, wie eben für die Spaltung des Wasserstoff-Moleküls beschrieben. Nur dass hier die Molekülorbitale viel komplexer sind als beim Wasserstoff-Molekül, schließlich hat Chlor drei Elektronenschalen mit der Elektronenkonfiguration 1s2, 2s2, 2px2, 2py2, 2pz2, 3s2, 3px2, 3py2, 3pz1. Und beim Brom ist es noch "schlimmer", hier sind vier Elektronenschalen vorhanden. Also müsste man eigentlich unzählige Molekülorbitale in das MO-Diagramm einzeichnen, worauf wir hier aber aus Übersichtlichkeitsgründen verzichten wollen. Das ändert aber nichts an der Tatsache, dass die Spaltung des Chlor- oder Brom-Moleküls im Prinzip auf die gleiche Weise geschieht wie die Spaltung des Wasserstoff-Moleküls, nur dass viel weniger Energie notwendig ist, sichtbares Licht reicht für die Photolyse aus.
Quellen und Literatur-Empfehlungen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.