IMPP-Gegenstandskatalog: "Erkennen von Aldehyden..., typische Reaktionen (z. B. Addition von Nukleophilen, ..., Aldehyde als histologische Fixationsmittel)"
Allgemeines
Aldehyde sind eine Stoffgruppe der organischen Chemie, die bereits im Chemieunterricht der Sek. II behandelt wird, ebenso wie die eng verwandte Stoffgruppe der Ketone.
Diese Webseite über Aldehyde ist recht lang, daher ist hier eine kleine Gliederung in Abschnitte sinnvoll.
Aldehyde und Alkanale
Wenn man primäre Alkohole oxidiert, erhält man Aldehyde (Alkohol - dehydriert). Handelt es sich bei dem primären Alkohol um ein Alkanol, also den Abkömmling eines Alkans, so wird der gebildete Aldehyd auch als Alkanal bezeichnet.
Aldehyde = organische Verbindungen mit einer Aldehydgruppe -CH=O.
Alkanale = Aldehyde, die sich von einem Alkan ableiten lassen.
Die Aldehydgruppe CH=O
Die Aldehydgruppe -CH=O ist die funktionelle Gruppe der Aldehyde - hier ein paar Beispiele:
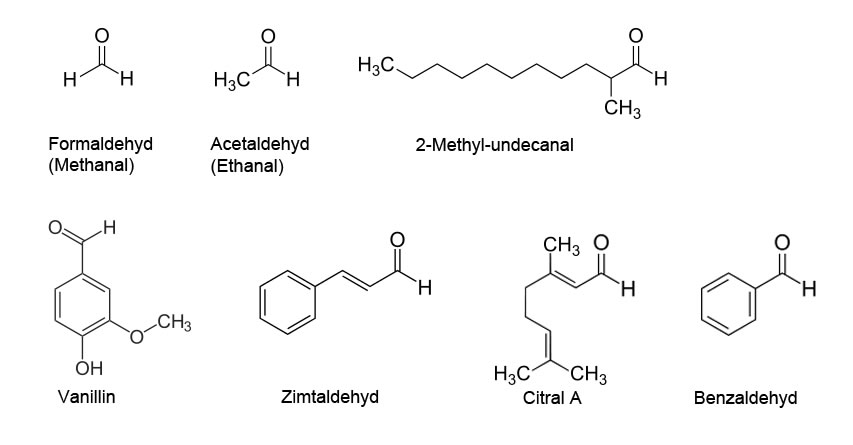
Einige Aldehyde
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Die Aldehydgruppe besteht aus einer Carbonylgruppe, die mit einem Wasserstoff-Atom verbunden ist. Daher ist die Aldehydgruppe oxidierbar; durch Oxdiation der Aldehydgruppe entsteht die Carboxygruppe, die typisch für Carbonsäuren ist. Aus Formaldehyd (Methanal) entsteht so die Ameisensäure (Methansäure), aus Acetaldehyd (Ethanal) die Essigsäure (Ethansäure).
Die Carbonylgruppe C=O
Die Eigenschaften der Aldehydgruppe werden weitgehend durch die Carbonylgruppe bestimmt.
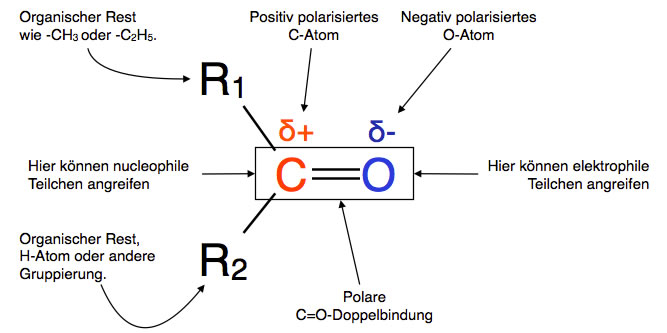
Allgemeine Strukturformel einer Carbonylverbindung mit der Carbonylgruppe im Zentrum
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Wegen des negativ polarisierten O-Atoms kann die Carbonylgruppe gut von elektrophilen Stoffen wie zum Beispiel Carbenium-Ionen, Protonen etc. angegriffen werden. Andererseits kann die Carbonylgruppe aber auch von nucleophilen Stoffen wie zum Beispiel Bromid- oder Cyanid-Ionen am positiv polarisierten C-Atom angegriffen werden. Damit stehen den Carbonylverbindungen (Aldehyde, Ketone, Carbonsäuren, Carbonsäureestern etc.) eine Vielzahl elektrophiler und nucleophiler Additionen und auch Substitutionen offen.
Bei der Carbonylgruppe sind beide Atome, sowohl das C-Atom wie auch das O-Atom, sp2-hybridisiert. Das heißt, die beiden Atome sind sowohl durch eine starke sigma-Bindung wie auch durch eine schwache pi-Bindung miteinander verknüpft. Außerdem betragen die R1-C-R2-Bindungswinkel wegen der sp2-Hybridisierung 120 Grad, und alle vier Gruppen (R1, R2, C und O) liegen in einer Ebene.
Physikalische Eigenschaften der Aldehyde
Die Carbonylgruppe ist auch für die physikalischen Eigenschaften der Aldehyde verantwortlich. Die C=O-Gruppe ist stark polarisiert, daher sind auch Aldehyde recht stark polare Verbindungen, wenn der Rest R1 nicht allzu groß ist (R2 ist bei Aldehyden ja ein H-Atom, spielt also keine Rolle).
Siedepunkte
Allerdings können Aldehyde untereinander keine H-Brücken bilden, so dass die Siedepunkte der Aldehyde grundsätzlich niedriger sind als die der entsprechenden primären Alkohole. Hier zum Vergleich (Daten aus der Wikipedia, Zahlen gerundet):
- Ethanol: 78 ºC
- Ethanal: 20 ºC
- Propan-1-ol: 97 ºC
- Propanal: 49 ºC
Wasserlöslichkeit
Wegen des negativ polarisierten O-Atoms mit den beiden freien Elektronenpaaren können die Aldehyde allerdings H-Brücken mit H2O-Molekülen ausbilden, so dass die Wasserlöslichkeit bei einem kleinen Rest R1 durchaus vorhanden ist. Je größer R1 bei den Alkanalen wird, desto geringer ist die Wasserlöslichkeit, weil die Aldehydgruppe gegenüber dem Alkylrest an Einfluss verliert.
- Methanal, Ethanal: unbegrenzt mischbar
- Propanal: 679 g/l
- Butanal: 71 g/l
- Pentanal: 14 g/l
Die entsprechenden Alkohole sind allerdings etwas besser wasserlöslich, Pentan-1-ol löst sich beispielsweise mit 22 g/l in Wasser.
Addition von Nucleophilen
Auch die chemischen Eigenschaften der Aldehyde werden weitgehend von der Carbonylgruppe bestimmt. Das positiv polarisierte C-Atom der C=O-Gruppe wird gern von nucleophilen Teilchen angegriffen, wenn das sterisch möglich ist.
Addition von Wasser
Die Addition von Wasser ist die einfachste Form der Nucleophilen Addition an die C=O-Doppelbindung.
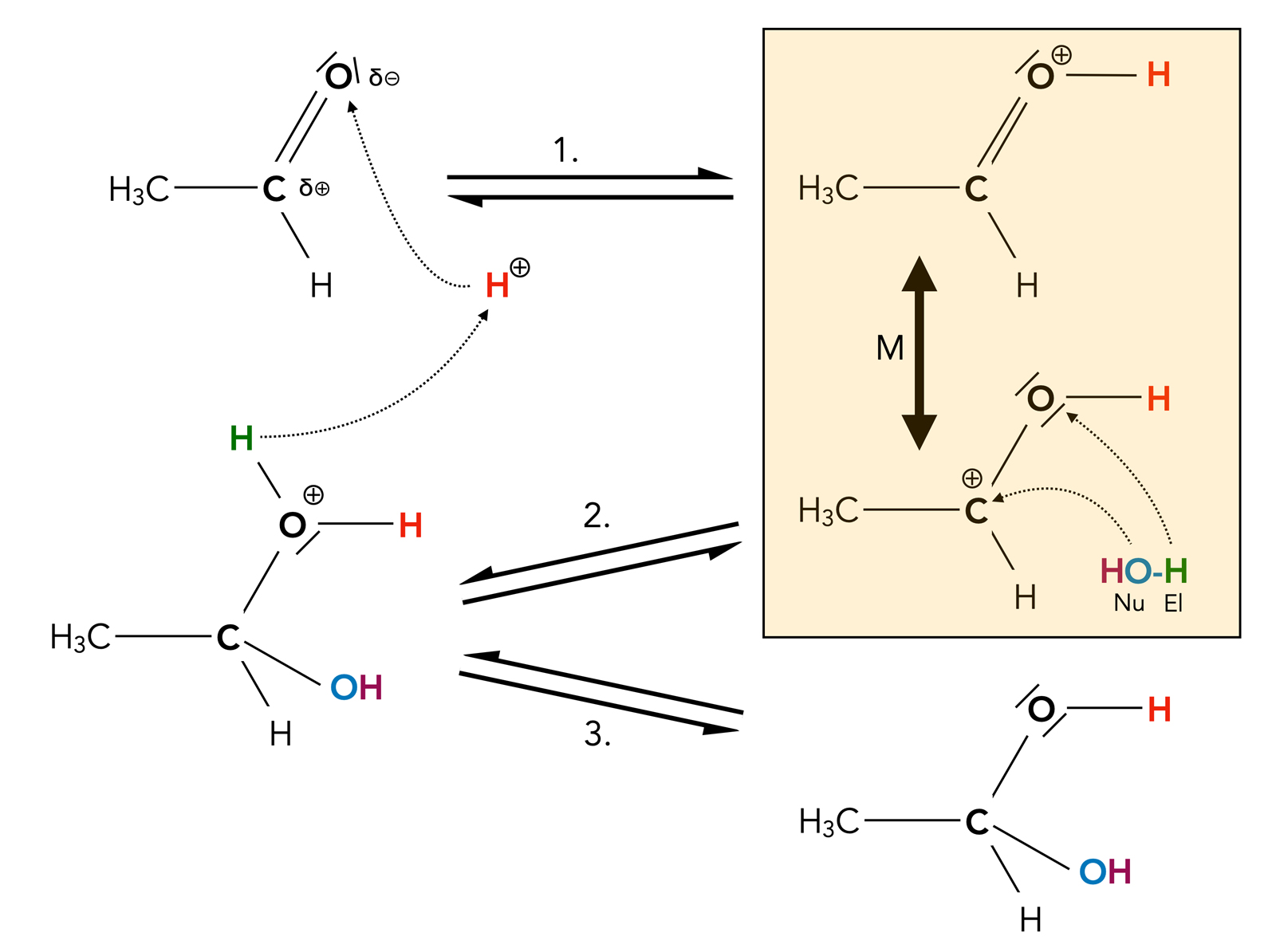
Mechanismus der Addition von Wasser unter saurer Katalyse
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Hier sehen wir den Mechanismus der Wasser-Addition unter saurer Katalyse.
- Interessant ist hier, dass nicht das positiv polarisierte C-Atom zuerst angegriffen wird, sondern das negativ polarisierte O-Atom der C=O-Gruppe. Im Schritt 1 setzt sich ein Proton an dieses Sauerstoff-Atom, das positive Zwischenprodukt ist dann mesomeriestabilisiert.
- Im zweiten Schritt wird dann die Grenzstruktur mit dem positiven C-Atom von einem Wasser-Moleküle nucleophil angegriffen. Die OH-Gruppe des H2O-Moleküls setzt sich an das C-Atom, das H-Atom an das O-Atom. Dieses Zwischenprodukt ist noch recht instabil.
- Durch Abspaltung eines Protons entsteht dann eine Verbindung, die als Hydrat bezeichnet wird, genauer gesagt, als Aldehydhydrat. Solche Aldehydhydrate sind aber sehr instabil und können nur in Ausnahmefällen isoliert werden.
Addition eines Alkohols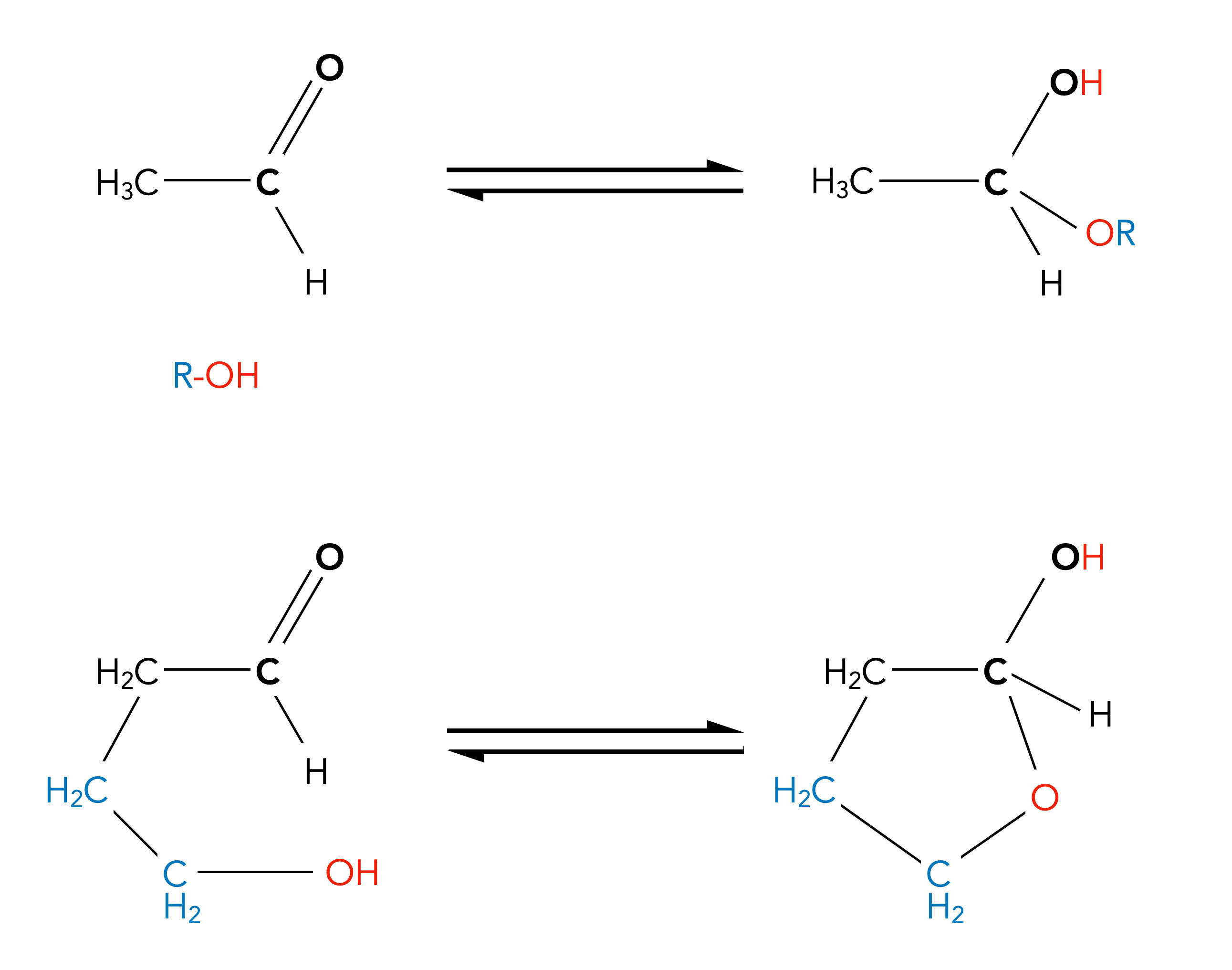
Bildung eines cyclischen Halbacetals
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Auf diesem Bild sehen wir die Bildung eines sogenannten Halbacetals als Ergebnis der Addition eines Alkohols R-OH an die C=O-Gruppe von Ethanal. Diese Verbindung ist ähnlich wie ein Aldehydhydrat recht instabil, da das C-Atom mit zwei O-Atomen verbunden ist.
In der unteren Reihe der Abbildung wird es interessanter. Hier entsteht nämlich ein cylisches Halbacetal. Die OH-Gruppe von 4-Hydroxy-butanal reagiert mit der C=O-Gruppe des eigenen Moleküls. Dabei entsteht ein aus fünf Atomen bestehender Ring, der etwas an das Fructose- oder Ribose-Molekül erinnert.
Tatsächlich spielen solche Ringbildungs-Reaktionen eine wichtige Rolle bei den Kohlenhydraten, genauer gesagt, bei Monosacchariden wie Glucose und Fructose.
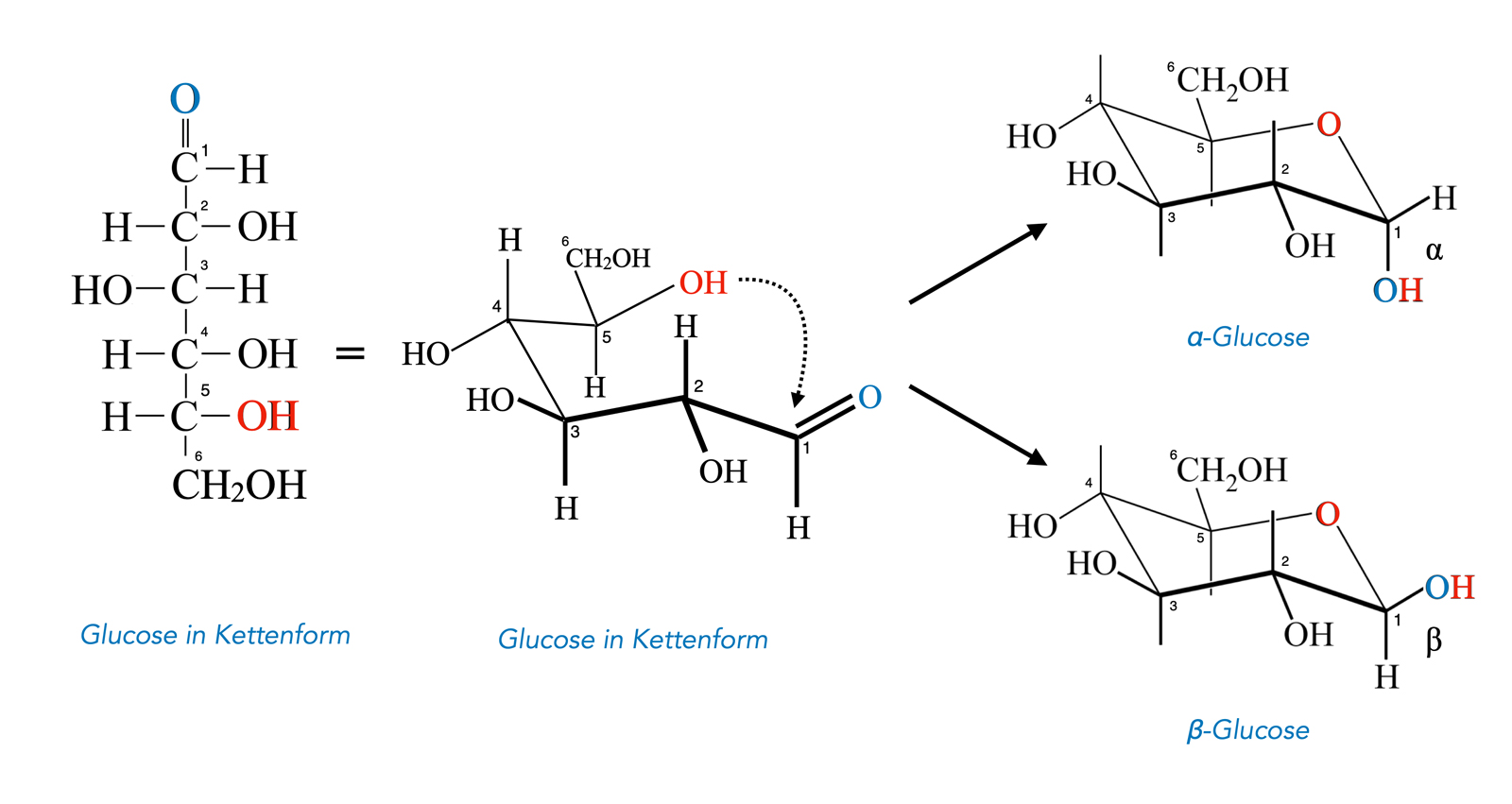
Glucose als Halbacetal
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Links auf dem Bild sehen wir die Glucose in der Kettenform, in der Mitte der Abbildung wurde die Kette so zurecht gebogen, dass man den entstehenden Ring schon ahnen kann, und rechts sehen wir die beiden möglichen Produkte der Ringbildung, nämlich die α- und die β-Glucose.
Addition von Blausäure
Dies ist eine der wichtigsten Reaktionen der Aldehyde. Die gebildeten Cyanhydrine sind wichtige Zwischenprodukte in der industriellen organischen Synthese, zum Beispiel von Plexiglas.
Das Cyanid-Ion der Blausäure HCN besteht aus einem negativ geladenem C-Atom, das über eine Dreifachbindung mit einem N-Atom verbunden ist: -:C≡N:. Angegriffen wird das positiv polarisierte C-Atom des Aldehyds mit dem freien Elektronenpaar des negativen C-Atoms, dadurch entsteht eine neue C-C-Einfachbindung. Die Bildung solcher C-C-Einfachbindungen ist immer ein wichtiger Schritt bei der Synthese größerer organischer Moleküle aus kleineren Bausteinen.
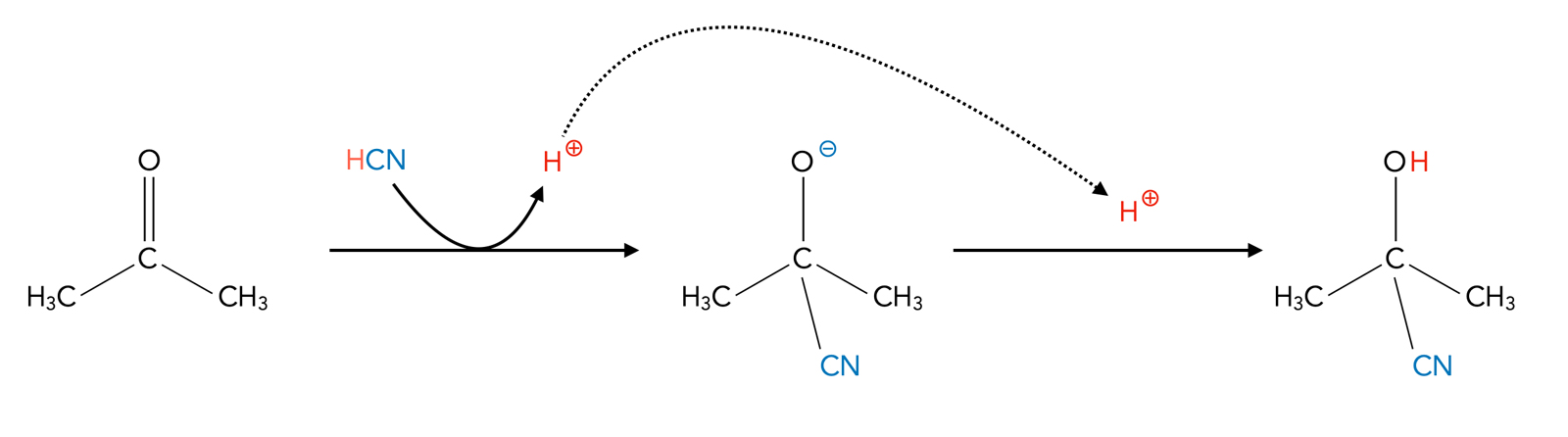
Addition von Blausäure an Aceton
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Aus der C≡N-Gruppe kann sehr leicht eine COOH-Gruppe gebildet werden, nur wenige Einzelschritte sind dafür nötig, und die COOH-Gruppe kann wieder zu einer Aldehydgruppe reduziert werden oder sich mit einem Alkohol zu einem Ester verbinden.
Addition von Ammoniak und Aminen
Ähnlich wie H2O, R-OH oder HCN können sich auch Ammoniak NH3 oder Amine R-NH2 an die C=O-Bindung nucleophil addieren, wie das folgende Bild einer säurekatalysierten Addition zeigt:
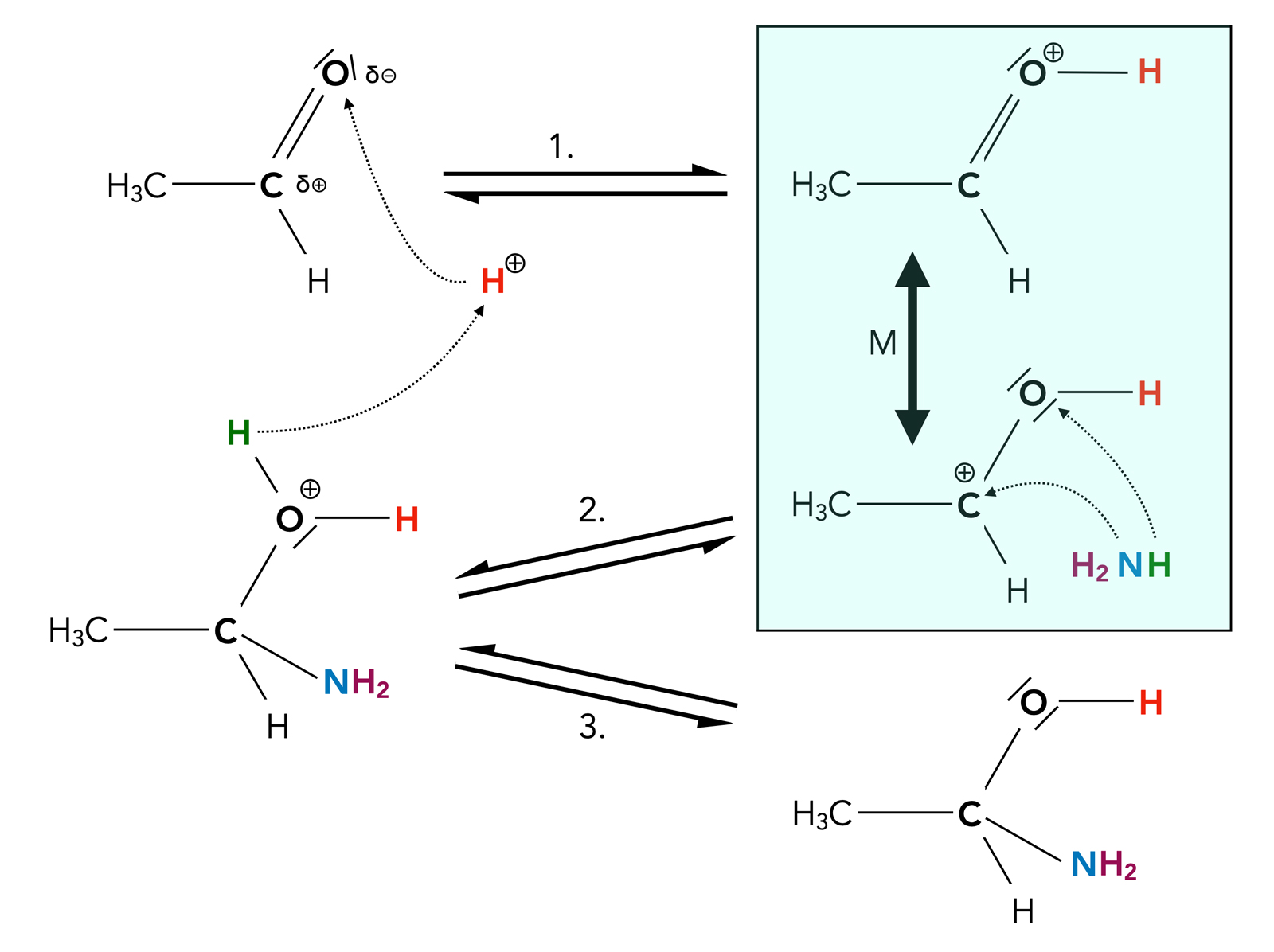
Die Gesamtreaktion der NH3-Addition an Acetaldehyd bei saurer Katalyse
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Die Reaktion verläuft ähnlich wie die Addition von Wasser oder eines Alkohols:
- Im Schritt 1 setzt sich ein Proton an das negativ polarisierte Sauerstoff-Atom des Aldehyds, das positive Zwischenprodukt ist dann mesomeriestabilisiert.
- Im zweiten Schritt wird die Grenzstruktur mit dem positiven C-Atom von einem NH3-Molekül nucleophil angegriffen. Das N-Atom setzt sich mit dem freien Elektronenpaar an das Carbenium-Ion, das H-Atom an das O-Atom. Dieses Zwischenprodukt ist noch recht instabil.
- Durch Abspaltung eines Protons von der OH2+-Gruppe entsteht dann eine Verbindung, die als Halbaminal bezeichnet wird (C-Atom mit einer OH- und einer NH2-Gruppe)
Genau wie Hydrate oder Halbacetale sind Halbaminale recht instabil. Wenn eine H2O-Eliminierung möglich ist, zerfallen sie recht schnell zu Iminen:
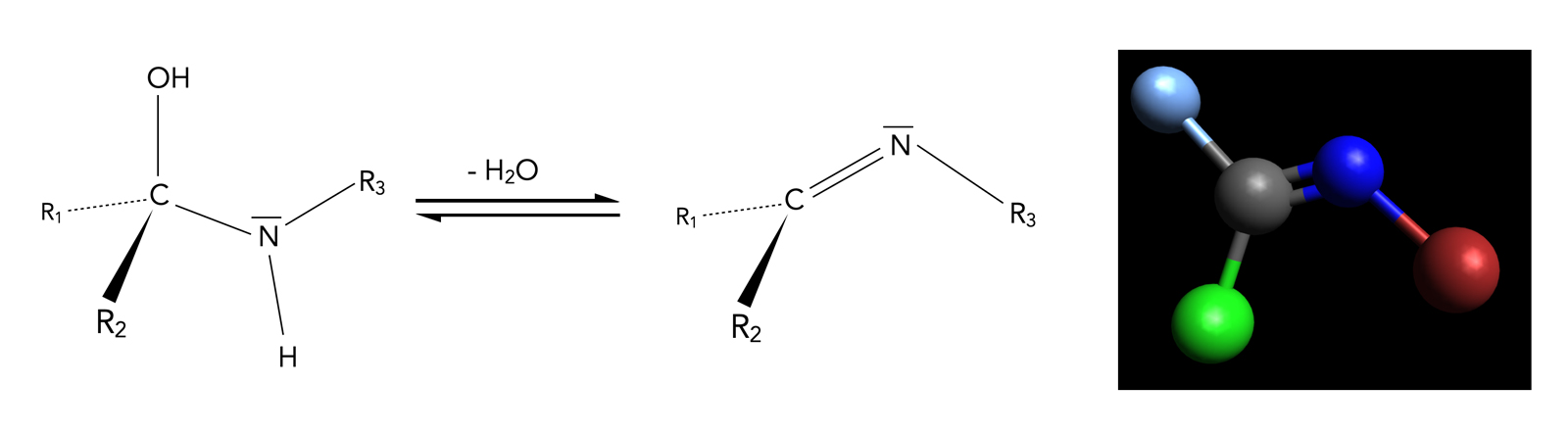
Bildung eines Imins durch Dehydratisierung eine Halbaminals
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Synthese einer Aminosäure
Halbaminale können auch zur Herstellung von Aminosäuren verwendet werden, wie die folgende Reaktionskette zeigt:
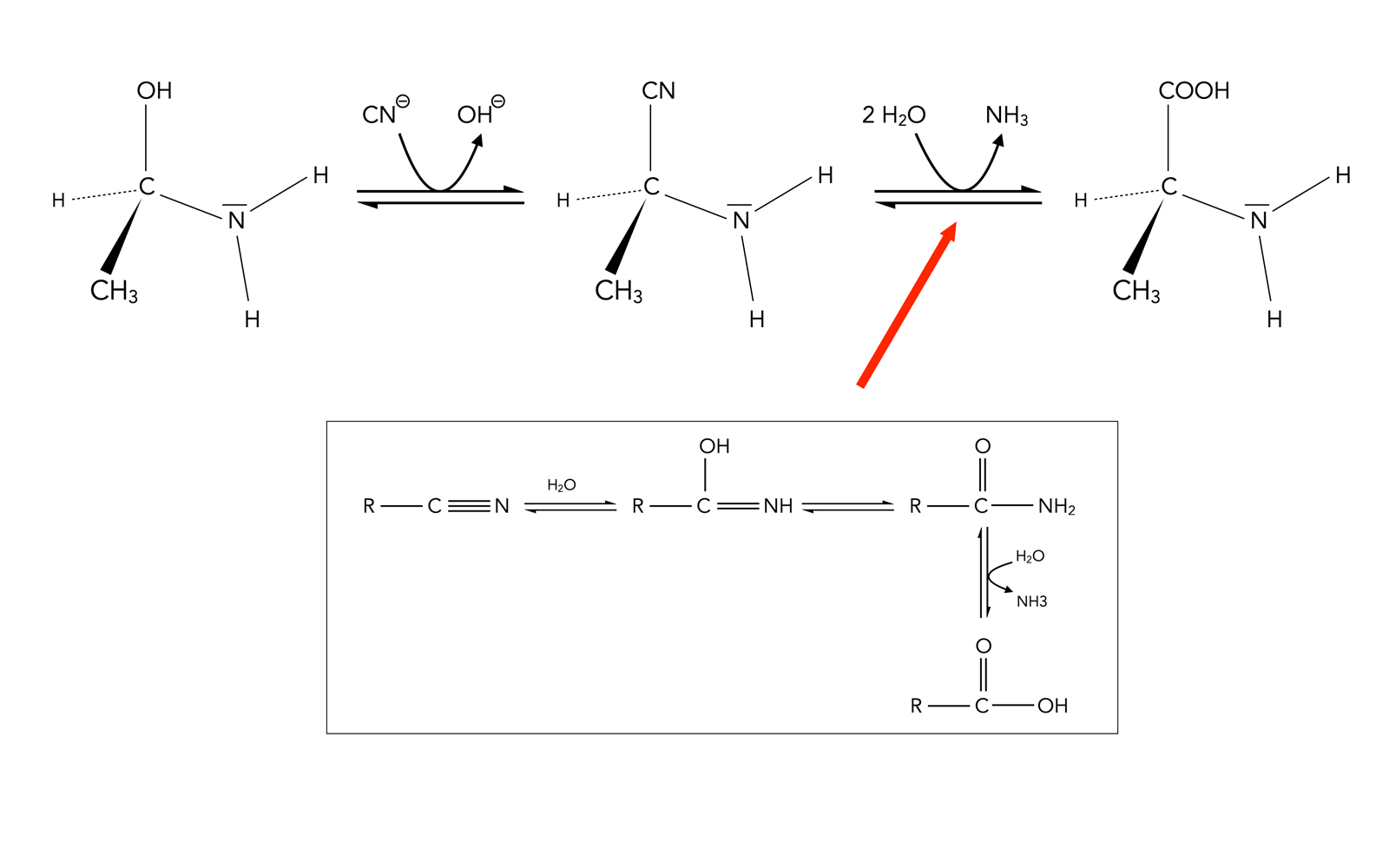
Bildung einer Aminosäure (Alanin)
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
In einer nucleophilen Substitution wird zunächst die OH-Gruppe des Halbaminals gegen eine Cyanidgruppe ausgetauscht. Die Cyanidgruppe wird dann in drei Teilschritten (siehe Kasten unten) in eine Carboxygruppe umgewandelt.
Synthese eines Heteroaromaten
Die folgende Zeichnung zeigt eine Reaktion, bei der mit Hilfe einer intramolekularen nucleophilen Addition und anschließenden Dehydratisierung ein Heteroaromat gebildet werden kann:
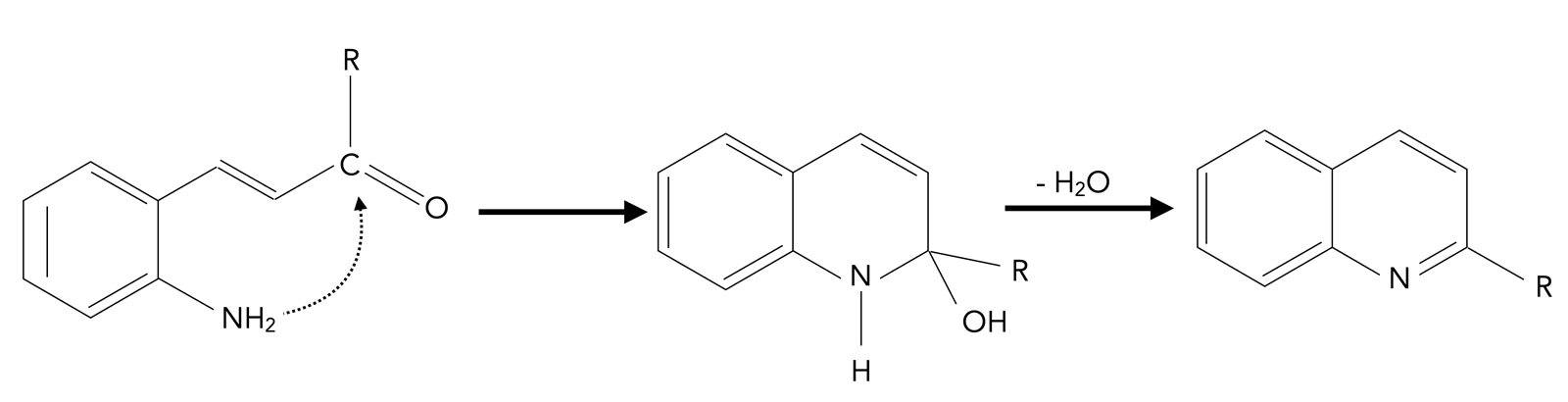
Bildung eines Heteroaromaten durch intramolekulare nucleophile R-NH2-Addition
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Aldehyde als histologische Fixationsmittel
Zunächst ein Zitat aus dem DocCheck Flexikon, um zu erklären, was man in der Biologie und Medizin unter dem Begriff Fixierung versteht:
"Bei der chemischen Fixierung werden verschiedene Moleküle in der Zelle durch Chemikalien so verfestigt, dass sie ihre natürliche Form im Schnittpräparat beibehalten. Dabei kann es jedoch zu Veränderungen der biologischen Strukturen (Artefakte) kommen, welche minimal sein sollen. Ein gutes chemisches Fixiermittel sollte schnell eindringen, gut vernetzen und stabilisieren, keine Artefakte (z.B. Verklumpungen von Eiweißen) bilden und das Aussehen und die Anordnung der biologischen Strukturen möglichst wenig beeinflussen." [2]
Die beiden wichtigsten chemischen Fixiermittel sind Methanol, Ethanol (bzw. ein Gemisch aus Ethanol und Essigsäure), Aceton, Diethylether und Formalin. Formalin ist eine 35 bis 37%-ige wässrige Lösung von Methanal, dem einfachsten Aldehyd. Methanal selbst, auch als Formaldehyd bezeichnet, eignet sich nicht als Fixierungsmittel, weil es bei Raumtemperatur gasförmig ist.
Jedes Fixiermittel hat seine Vor- und Nachteile. Formaldehyd wird vor allem in der konventionellen Histologie und Immunhistologie, sowie in der Anatomie als Fixierungsmittel verwendet [3].
Der Oberlehrer J. Blum verwendete Formalin bereits im Jahr 1893 erstmals zur Konservierung von zoologischen und botanischen Präparaten. Heute ist Formaldehyd das am meisten verwendete Fixier- und Konservierungsmittel [3].
Nachweis von Aldehyden
Die Fehling-Probe
Bereits im Biologie- oder Chemieunterricht der gymnasialen Oberstufe lernt man die Fehling-Reaktion kennen, mit der man Monosaccharide wie Glucose und Fructose von Disacchariden wie Saccharose oder Polysacchariden wie Stärke oder Cellulose unterscheiden kann. Im Chemieunterricht werden aber auch einfache Aldehyde wie Methanal oder Ethanal mit Hilfe der Fehling-Probe nachgewiesen.
Die Durchführung dieser Nachweisreaktion wird auf dieser Seite genauer beschrieben.
Bei der Fehling-Probe und verwandten Nachweis-Reaktionen werden Aldehyde oxidiert, und die freigesetzen Elektronen reduzieren dann die blauen Cu2+-Ionen des Fehling-Reagenz zu rotgefärbten Cu+-Ionen.
In diesem Lexikon-Artikel werden die Vorgänge bei der Fehling-Probe besprochen, außerdem wird auf einen Fehler hingewiesen, der in Schulbüchern immer noch verbreitet ist.
Die Tollens-Probe
Die Tollens-Probe beruht ebenfalls auf der Oxidation von Aldehyden, allerdings werden hier keine Cu2+-Ionen reduziert, sondern Ag+-Ionen. Es bildet sich metallisches Silber, das sich bei geschickter Durchführung als auffälliger Silberspiegel an der Innenwand des Reagenzglases absetzt.
Diese Wikipedia-Seite behandelt die Tollens-Probe sehr ausführlich.
Die Schiff-Probe
Die Schiff-Probe verläuft unter chemischen Aspekten etwas komplizierter als die einfache Reduktion bon blauen Cu2+ oder farblosen Ag+-Ionen zu rot- bzw. schwarzgefärbten Produkten. Ein komplex aufgebauter organischer Farbstoff, das Fuchsin, wird zunächst in eine farblose Form mit einem zentralen sp3-hybridisierten C-Atom überführt. Durch Reaktion mit einem Aldehyd oder Keton entsteht dann ein Molekül, bei dem das zentrale C-Atom wieder sp2-hybridisiert ist, so dass die pi-Elektronen der beteiligten aromatischen Ringe wieder ein großes delokalisiertes System bilden, das sichtbares Licht absorbiert und dem Auge des Betrachters daher farbig erscheint.
Die chemischen Reaktionen dieser Nachweis-Reaktion sind auf der Seite "Schiffbasen" im Chemie-Lexikon näher beschrieben.
Quellen:
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- DocCheck Flexikon, Artikel "Chemische Fixierung" 1)
- Wikipedia, Artikel "Fixierung" 1)
1) aufgerufen am 10.04.2024.
Seitenanfang -
Weiter mit Ketonen...