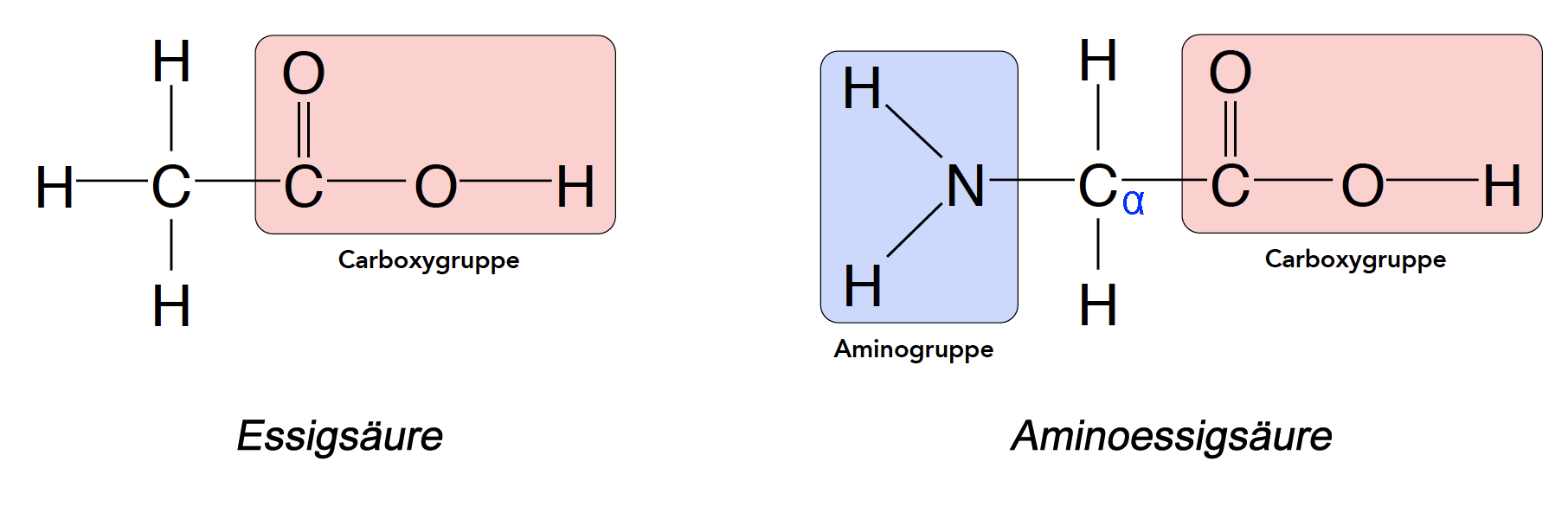
Die beiden einfachsten Aminosäuren
Aminosäuren sind chemisch gesehen Carbonsäuren mit einer Amino-Gruppe und müssten daher korrekt als Aminocarbonsäuren bezeichnet werden. Die einfachste Aminosäure ist das Glycin, das sich direkt von der Essigsäure ableitet und daher auch als Aminoessigsäure oder Amino-ethansäure bezeichnet werden kann:
Aminosäuren sind mit der Essigsäure verwandt
Autor: Ulrich Helmich, Lizenz: Public domain
Die zweit-einfachste Aminosäure ist das von der Propansäure abgeleitete Alanin (2-Amino-propansäure):
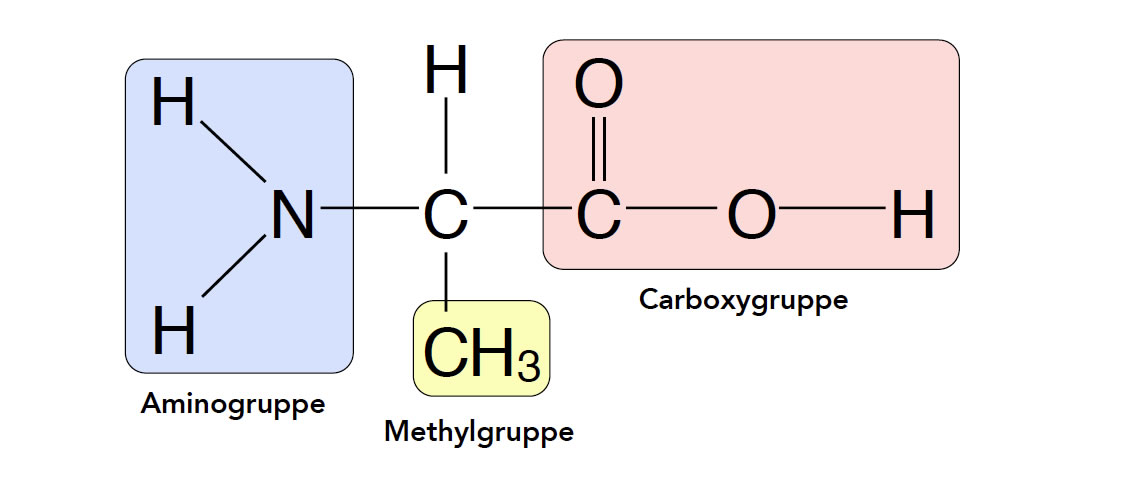
Das Alanin-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain
Beim Alanin ist ein H-Atom am C2-Atom der Propansäure durch eine Amino-Gruppe ersetzt. Daher ist der wissenschaftliche Name des Alanins 2-Amino-propansäure.
Allgemeiner Aufbau einer Aminosäure
Es gibt Hunderte von Aminosäuren in Natur und Technik, aber interessant sind eigentlich nur die sogenannten proteinogenen Aminosäuren (proteinogen = Protein bildend). Diese 20 oder 21 Aminosäuren sind nämlich die Bausteine der Peptide und Proteine. Hier einmal der allgemeine Aufbau einer proteinogenen Aminosäure:
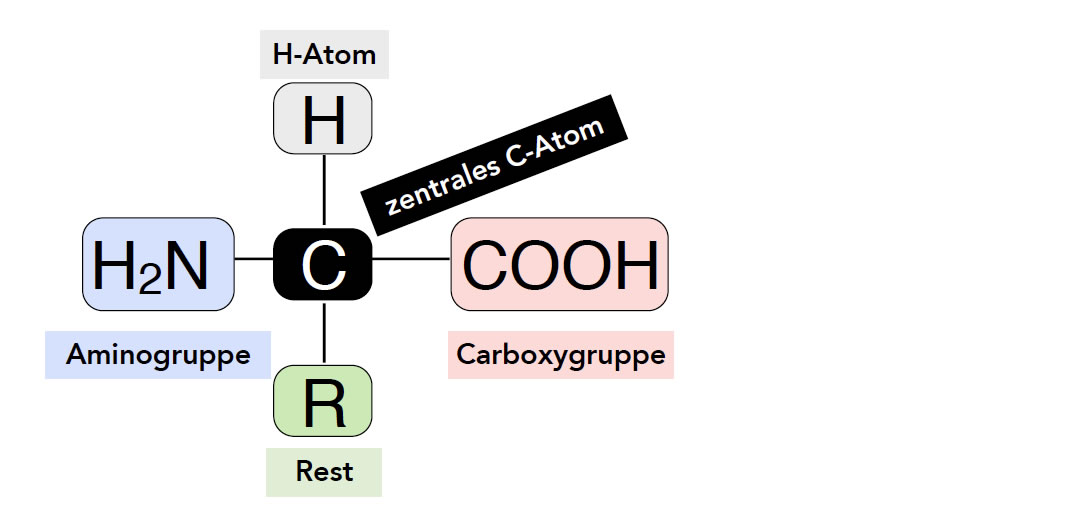
Allgemeiner Grundaufbau einer biogenen Aminosäure
Autor: Ulrich Helmich, Lizenz: Public domain
Ein zentrales C-Atom ist verbunden mit
- einer Amino-Gruppe NH2
- einer Carboxy-Gruppe COOH
- einem H-Atom
- einem variablen Rest
Proteinogen und biogen - ein Unterschied
Als proteinogene Aminosäuren bezeichnet man die 20 Aminosäuren, die während der Translation in die entstehenden Proteine eingebaut werden. Nur für diese 20 Aminosäuren existiert ein genetischer Code in Form eines Basentripletts.
Die biogenen Aminosäuren sind dagegen alle Aminosäuren, die man in Lebewesen findet. Das sind natürlich auf jeden Fall die 20 proteinogenen Aminosäuren, aber zusätzlich viele weitere Aminosäuren wie Ornithin, Citrullin, GABA, Taurin und so weiter. Diese Aminosäuren werden im Stoffwechsel der Lebewesen aus anderen Aminosäuren, Kohlenhydraten, Fetten oder anderen chemischen Verbindungen hergestellt. Einzelheiten dazu siehe "Biogene Aminosäuren" auf dieser Homepage.
Eigenschaften der Carboxy- und der Amino-Gruppe
Die Carboxy-Gruppe ist sauer
Die Carboxy-Gruppe verleiht der Aminosäure ihre sauren Eigenschaften. Sie ist in der Lage, ein Proton abzugeben. Das passiert vor allem, wenn das Lösemittel, in dem sich die Aminosäure befindet, protonenarm ist, also neutral oder alkalisch.
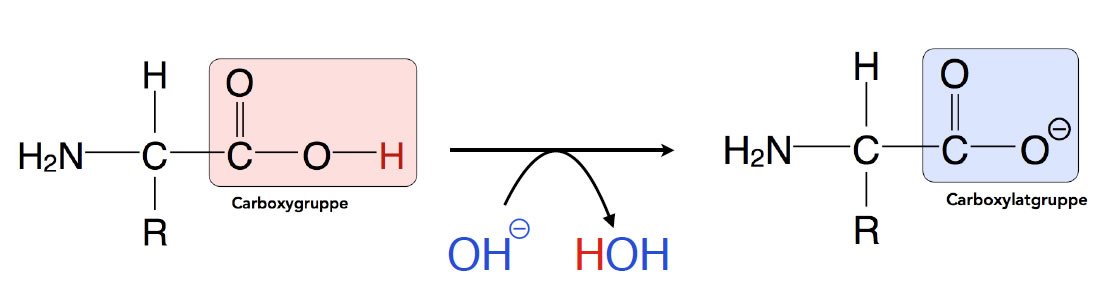
Die Carboxy-Gruppe kann ein Proton an eine Base abgeben
Autor: Ulrich Helmich, Lizenz: Public domain
Damit die Carboxy-Gruppe ihr Proton abgeben kann, muss natürlich eine Base aus der Umgebung bereit sein, das Proton aufzunehmen. In wässrigen Lösemitteln kommen dafür in erster Linie Hydroxid-Ionen OH- in Frage. Die Carboxy-Gruppe liegt danach als Carboxylat-Gruppe COO- vor, aus dem Hydroxid-Ion ist ein Wasser-Molekül H2O entstanden.
Die Amino-Gruppe ist basisch
Die Amino-Gruppe verleiht der Aminosäure ihre basischen Eigenschaften. Die Amino-Gruppe hat ein elektronegatives Stickstoff-Atom mit einem freien Elektronenpaar und verhält sich daher als Base, kann also ein Proton aufnehmen und dadurch zur NH3+-Gruppe werden:
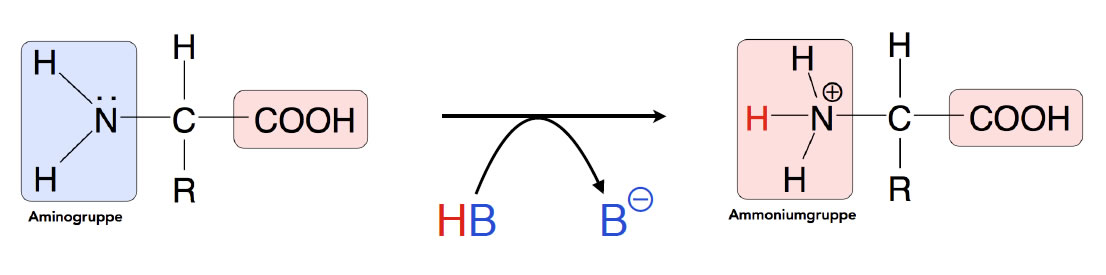
Die Amino-Gruppe kann ein Proton von einer Säure aufnehmen
Autor: Ulrich Helmich, Lizenz: Public domain
Das Proton H+ muss natürlich irgendwo herkommen, also funktioniert diese Protonenaufnahme nur dann, wenn ein Protonendonator, eine Säure im Lösemittel vorkommt. In der Abbildung wird die Säure durch HB symbolisiert. Aus der Amino-Gruppe ist eine Ammonium-Gruppe geworden.
Bildung von Zwitterionen
Aminosäuren können bei bestimmten pH-Werten sogenannte Zwitterionen bilden:
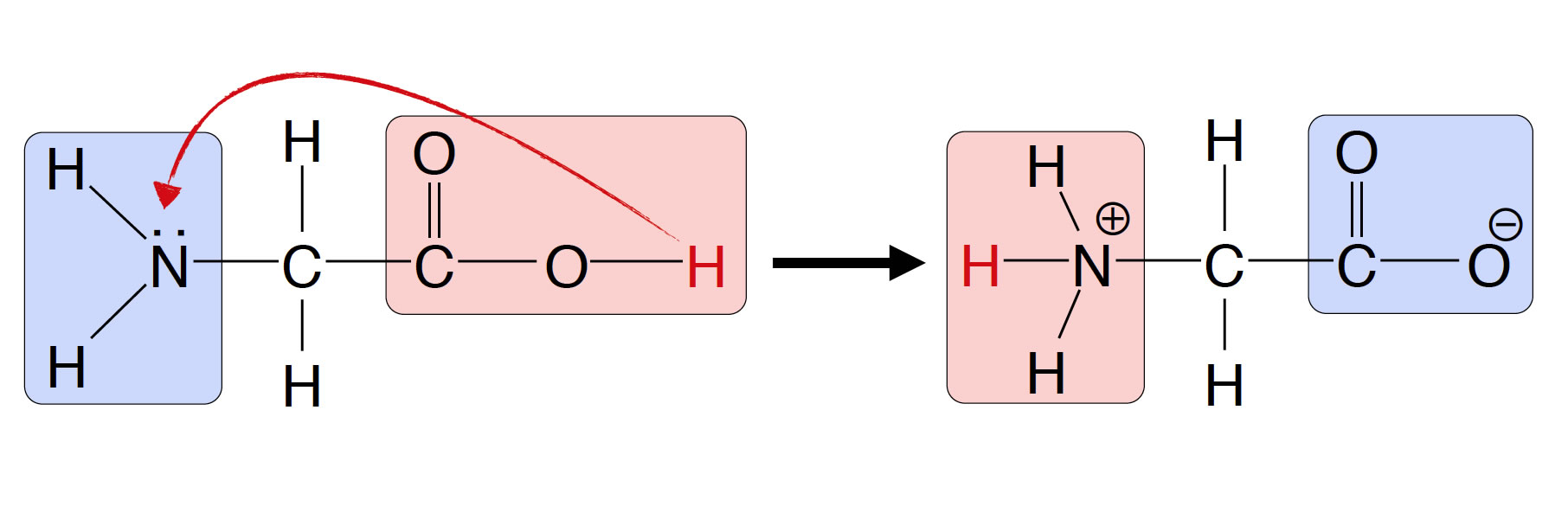
Bildung eines Zwitterions
Autor: Ulrich Helmich, Lizenz: Public domain
Die Carboxy-Gruppe reagiert als Säure und gibt ein Proton ab, die Amino-Gruppe reagiert als Base und nimmt ein Proton auf. Es entsteht ein Zwitterion, das gleichzeitig negativ und positiv geladen ist.
Ob das abgegebene Proton sich dann an die Amino-Gruppe der selben Aminosäure setzt, wie es in der Abbildung angedeutet ist und auch in vielen Büchern steht, ist aber eher unwahrscheinlich. Wahrscheinlicher ist, dass das Proton an das Lösemittel abgegeben wird und dass sich ein anderes Proton aus dem Lösemittel an die Amino-Gruppe anlagert.
Die pH-Abhängigkeit der Ladung einer Aminosäure
Eine Aminosäure kann je nach pH-Wert des Lösemittels positiv oder negativ geladen sein oder als Zwitterion vorliegen. Betrachten wir dazu die folgende Abbildung:
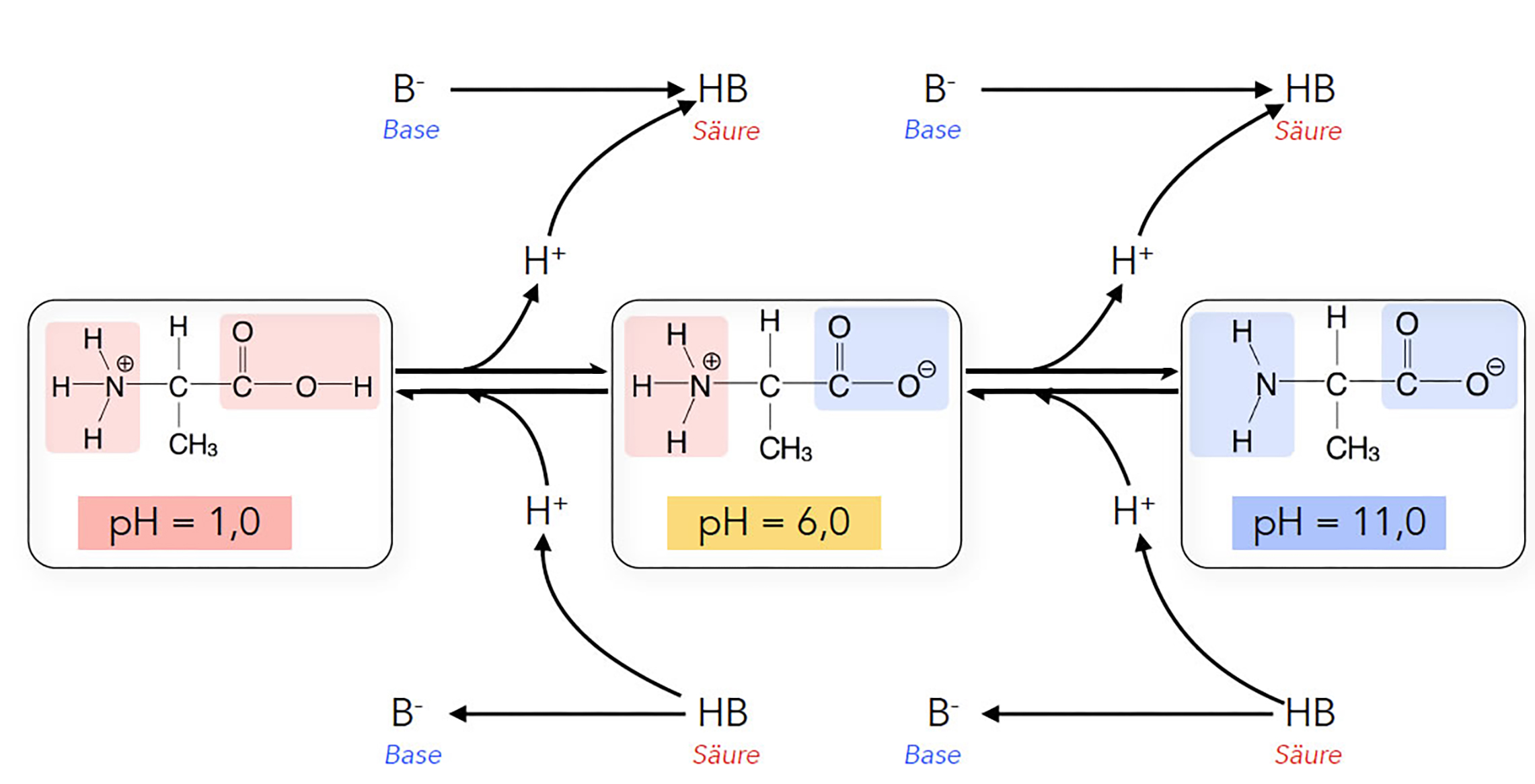
Die pH-Abhängigkeit der Ladung einer Aminosäure
Autor: Ulrich Helmich, Lizenz: Public domain
Bei einem pH-Wert von 1 hat die Amino-Gruppe ein Proton aufgenommen, und die COOH-Gruppe behält ihr Proton in einem derart sauren und protonenreichen Lösemittel natürlich. Die Aminosäure liegt also positiv geladen vor.
Gibt man jetzt eine Lauge in das Lösemittel, steigt der pH-Wert, die Konzentration der OH--Ionen im Lösemittel nimmt zu, die Konzentration der H+-Ionen nimmt ab. Offensichtlich hat die Carboxy-Gruppe stärkere Säureeigenschaften als die Ammoniumgruppe, denn sie gibt ihr Proton zuerst ab und liegt dann als negativ geladene Carboxylat-Gruppe vor, während die Ammonium-Gruppe immer noch positiv geladen ist. Die Aminosäure liegt jetzt also als Zwitterion vor.
Wenn der pH-Wert noch weiter sinkt, beispielsweise auf pH = 11, liegen noch weniger Protonen im Lösungsmittel vor. Der "Zwang", ein Proton an das Lösemittel abzugeben, wird dadurch noch größer (Le-Chateliersches Gesetz oder "Prinzip des kleinsten Zwangs" - für die Chemiker unter Ihnen). Daher gibt schließlich auch die Ammonium-Gruppe ihr zusätzliches Proton an das Lösungsmittel ab und wird zur elektrisch neutralen Amino-Gruppe.
Isoelektrischer Punkt
Den pH-Wert, bei dem eine Aminosäuren als Zwitterion vorliegt, bezeichnet man übrigens als isoelektrischen Punkt. Dieser Wert ist eine Stoffeigenschaft jeder Aminosäure, das heißt, jede Aminosäure hat einen charakteristischen isoelektrischen Punkt.
Isoelektrischer Punkt = der pH-Wert, an dem eine Aminosäure als Zwitterion vorliegt.
Auf der Lexikon-Seite "Aminosäuren (chemische Aspekte) finden Sie weitere Informationen zu diesem Thema. Außerdem wird hier die Stereo-Chemie der Aminosäuren besprochen.
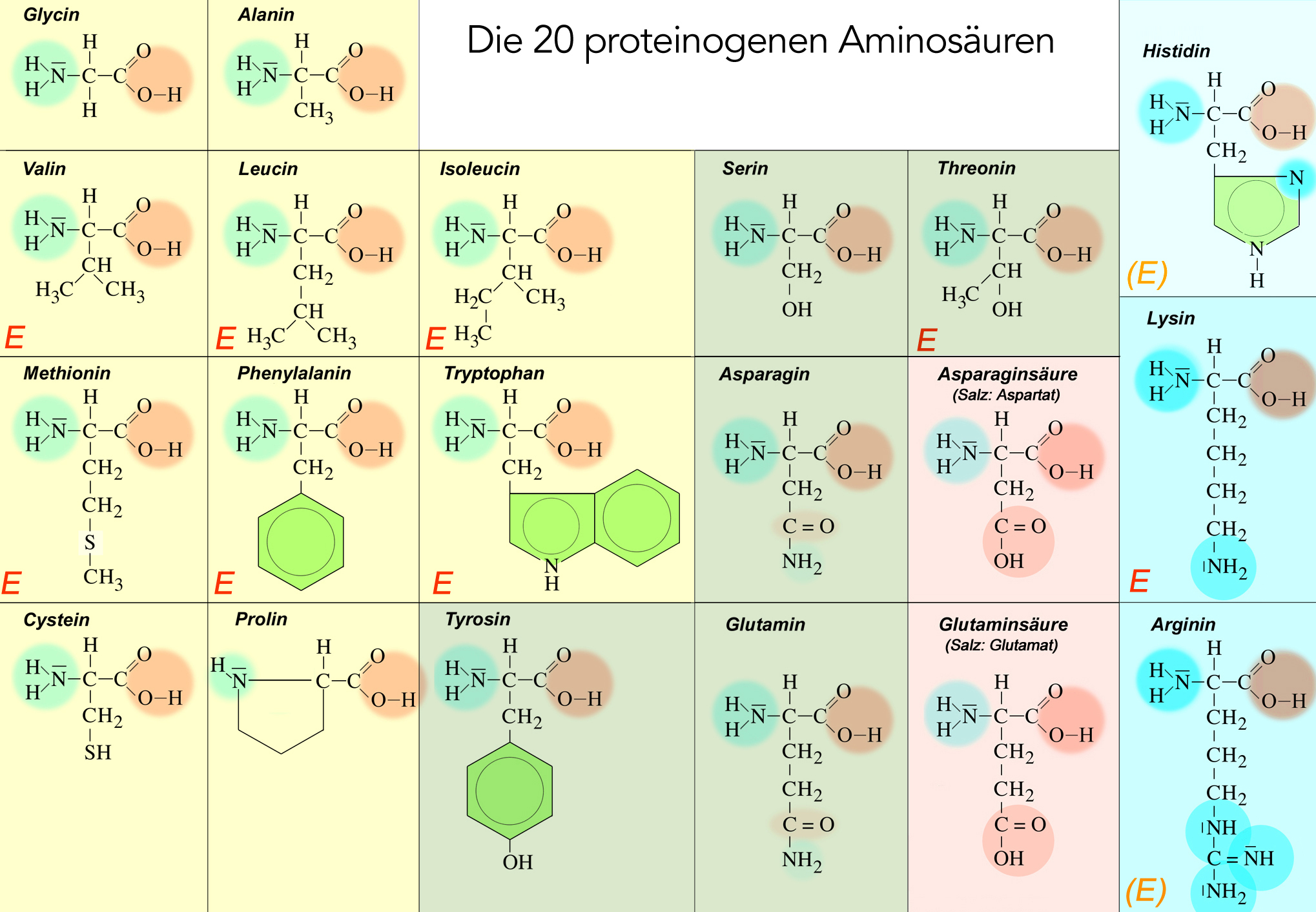
Überblick über die 20 proteinogenen Aminosäuren
Hier sehen Sie alle 20 proteinogenen Aminosäuren; ich hoffe, ich habe sie alle korrekt gezeichnet.
Einteilung der Aminosäuren
Die 20 proteinogenen Aminosäuren kann man nach verschiedenen Kriterien in mehrere Gruppen einteilen. In der Ernährungslehre und Medizin sehr beliebt ist die Einteilung in essentielle und nicht-essentielle Aminosäuren.
Essentielle Aminosäuren
Viele einfache Aminosäuren können vom menschlichen Körper selbst hergestellt werden. Einige Aminosäuren müssen aber zwingend mit der Nahrung aufgenommen werden. Aminosäuren sind beispielsweise in Fisch, Fleisch, Milchprodukten oder Eiern enthalten. Auch als Nahrungsergänzungsmittel sind Aminosäuren zuführbar. Diese wichtigen Aminosäuren bezeichnet man als essentielle Aminosäuren.
Essentielle Aminosäuren = Aminosäuren, die der Körper nicht selbst herstellen kann und die darum mit der Nahrung aufgenommen werden müssen.
Die essentiellen Aminosäuren sind in der Abbildung durch ein rotes E gekennzeichnet. Es handelt sich um die Aminosäuren Valin, Leucin, Isoleucin, Cystein, Phenylalanin, Tryptophan, Threonin und Lysin. Die Aminosäuren Histidin und Arginin sind für Erwachsene nicht mehr essentiell, wohl aber für jüngere Kinder.
Aminosäuren mit unpolaren bzw. polaren Seitenketten
Aminosäuren mit unpolaren Seitenketten
Die Aminosäuren mit unpolaren Resten sind in dem Bild oben leicht grau unterlegt. Es handelt sich um die Aminosäuren Glycin, Alanin, Valin, Leucin, Isoleucin, Methionin, Phenylalanin, Tryptophan und Prolin.
Aminosäuren mit polaren neutralen Seitenketten
Diese Aminosäuren haben zwar polare Reste, die aber weder sauer noch basisch reagieren. Dazu gehören die im Bild grün hinterlegten Aminosäuren Cystein, Tyrosin, Serin, Threonin, Asparagin und Glutamin. Die Polarität der Seitenketten wird durch die NH2- und OH- bzw. SH-Gruppen verursacht.
Aminosäuren mit polaren sauren Seitenketten ( = "saure Aminosäuren")
Asparaginsäure und Glutaminsäure (im Bild rot unterlegt) haben in der Seitenkette eine Carboxy-Gruppe, deren Säureaktivität durch kein N-Atom eingeschränkt wird. Diese beiden Aminosäuren können das Proton der Seitenketten-COOH-Gruppe leicht abgeben, dann entstehen die Salze Aspartat bzw. Glutamat.
Aminosäuren mit polaren basischen Seitenketten ( = "basische Aminosäuren")
Hierzu gehören die im Bild blau unterlegten Aminosäuren Histidin, Lysin und Arginin. Die NH2-Gruppe in der Seitenkette ist basisch und kann ein Proton aufnehmen. Auch Glutamin hat eine NH2-Gruppe in der Seitenkette, deren Basizität wird jedoch durch die direkt benachbarte Carbonyl-Gruppe stark reduziert, so dass Glutamin zu den polaren neutralen Aminosäuren gezählt wird.
Weitere interessante / ungewöhnliche Aminosäuren
Interessant sind noch die vier Aminosäuren mit einem aromatischen Ring in der Seitenkette. Die aromatischen Ringe sind in der Abbildung durch eine grüne Füllung gekennzeichnet. Es handelt sich um die Aminosäuren Phenylalanin, Tryptophan, Tyrosin und Histidin.
Bemerkenswert sind auch die beiden schwefelhaltigen Aminosäuren Methionin und vor allem Cystein. Cystein ist vor allem wegen seiner Fähigkeit wichtig, Disulfidbrücken mit einem zweiten Cystein-Molekül bilden zu können.
Völlig ungewöhnlich ist schließlich die Aminosäure Prolin. Prolin besitzt keine Amino-Gruppe, sondern das N-Atom ist über eine Brücke aus drei CH2-Gruppen mit dem zentralen C-Atom verbunden. Das Prolin-Molekül beißt sich sozusagen in den eigenen Schwanz.
Darunter versteht man Aminosäuren, die zwar biologisch gebildet werden, aber nicht während der Translation in Proteine eingebaut werden. Man hat inzwischen über 400 dieser Aminosäuren entdeckt. Auf dieser Ergänzungs-Seite wird kurz auf dieses Thema eingegangen und fünf Beispiele für nicht-proteinogene aber biogene Aminosäuren werden besprochen.