Schmelzpunkte gesättigter Fettsäuren
Einige gesättigte Fettsäuren
Die Tabelle zeigt uns, dass der Schmelzpunkt der Fettsäuren mit zunehmender Zahl von Kohlenstoff-Atomen ansteigt. Das ist in der Chemie nichts Ungewöhnliches, auch von den homologen Reihen der Alkane, Alkene, Alkohole, Carbonsäuren und so weiter kennt man dieses Phänomen. Je länger die Kette, desto größer die mögliche Kontaktfläche zwischen den Molekülen, desto stärker die intermolekularen Anziehungskräfte (London-Kräfte), und desto höher der Schmelzpunkt.

Die Schmelztemperaturen der gesättigten Fettsäuren
Hier sehen Sie eine graphische Darstellung der Abhängigkeit der Schmelztemperaturen (Schmelzpunkte) der gesättigten Fettsäuren in Abhängigkeit von der Anzahl der Kohlenstoff-Atome der Alkylkette (Kettenlänge).
Eine Erklärung für dieses Phänomen wurde bereits oben angedeutet, zur Verdeutlichung habe ich aber noch mal extra eine neue Graphik angefertigt, die ich Ihnen nicht vorenthalten möchte:

Eine Verdeutlichung des Begriffs "Schmelzen"
Beim Schmelzen einer Verbindung wie Capronsäure müssen die zwischenmolekularen Anziehungskräfte zwischen den Molekülen der Verbindung überwunden werden, damit sich die einzelnen Moleküle aus dem festen Verband lösen können.
Die zwischenmolekularen Anziehungskräfte hängen von der Kontaktfläche zwischen den Molekülen der Fettsäure ab. Je länger die Fettsäure-Moleküle, desto größer die Kontaktfläche und damit die zu den van-der-Waals-Wechselwirkungen gehörenden London-Kräfte zwischen den Molekülen.

Je größer die Kontaktfläche, desto stärker die London-Kräfte
Aus diesem Grund ziehen sich die Moleküle der Fettsäure Caprylsäure (8 C-Atome) stärker gegenseitig an als die Moleküle der Fettsäure Capronsäure (6 C-Atome).
Biologie
Die Schmelzpunkte der Membranlipide hängen wesentlich von den in den Lipiden enthaltenen Fettsäuren ab. Je kürzer diese Fettsäuren, desto niedriger die Schmelztemperatur der Membranlipide. Damit verbunden ist eine geringere Viskosität (Zähflüssigkeit) der Membranlipide, was gerade dann von Vorteil ist, wenn das Lebewesen kalten Temperaturen ausgesetzt ist und die Gefahr des Erstarrens der Membranen droht.
Ernährungslehre
In der Ernährungslehre beschäftigt man sich weniger mit einzelnen Fettsäuren als vielmehr mit "echten" Fetten und Ölen, also mit Triglyceriden, deren Moleküle aus je einem Glycerin-Molekül und drei Fettsäure-Molekülen bestehen. Fette und Öle sind Gemische aus verschiedenen Triglyceriden. Daher haben Fette und Öle keine eindeutigen Schmelzpunkte, sondern nur sogenannte Schmelzbereiche.
Der Schmelzbereich eines Fettes hängt natürlich von der Zusammensetzung der Triglyceride ab. Enthalten diese vorwiegend kurzkettige Fettsäuren, dann ist der Schmelzbereich entsprechend niedrig. Fette mit langkettigen Fettsäuren haben dagegen hohe Schmelzbereiche.
Schmelzpunkt ungesättigter Fettsäuren
Auch die Schmelzpunkte ungesättigter Fettsäuren hängen von der Anzahl der C-Atome ab: je länge der C-Kette, desto höher der Schmelzpunkt der ungesättigten Fettsäure.Warum das so ist, wurde bereits im ersten Abschnitt über gesättigte Fettsäuren ausgeführt.

Die Schmelztemperaturen von drei ungesättigten Fettsäuren
Die Tabelle zeigt uns, dass der Schmelzpunkt der ungesättigten Fettsäuren mit zunehmender Zahl von C=C-Doppelbindungen abnimmt. Dieses Verhalten kann mit der räumlichen Struktur der Moleküle leicht erklärt werden.

Die Schmelztemperaturen der ungesättigten Fettsäuren
Hier sehen Sie eine graphische Darstellung der Abhängigkeit der Schmelztemperaturen (Schmelzpunkte) der Fettsäuren mit 18 C-Atomen in Abhängigkeit von der Anzahl der C=C-Doppelbindungen.
Ursache für die geringen Schmelzpunkte ist der "Knick" im Molekül
Eine Erklärung für dieses Phänomen ist die unregelmäßige Gestalt der Moleküle, die durch die Doppelbindungen hervorgerufen wird.

Gesättigte Fettsäuren sind langgestreckt und haben große Kontaktflächen
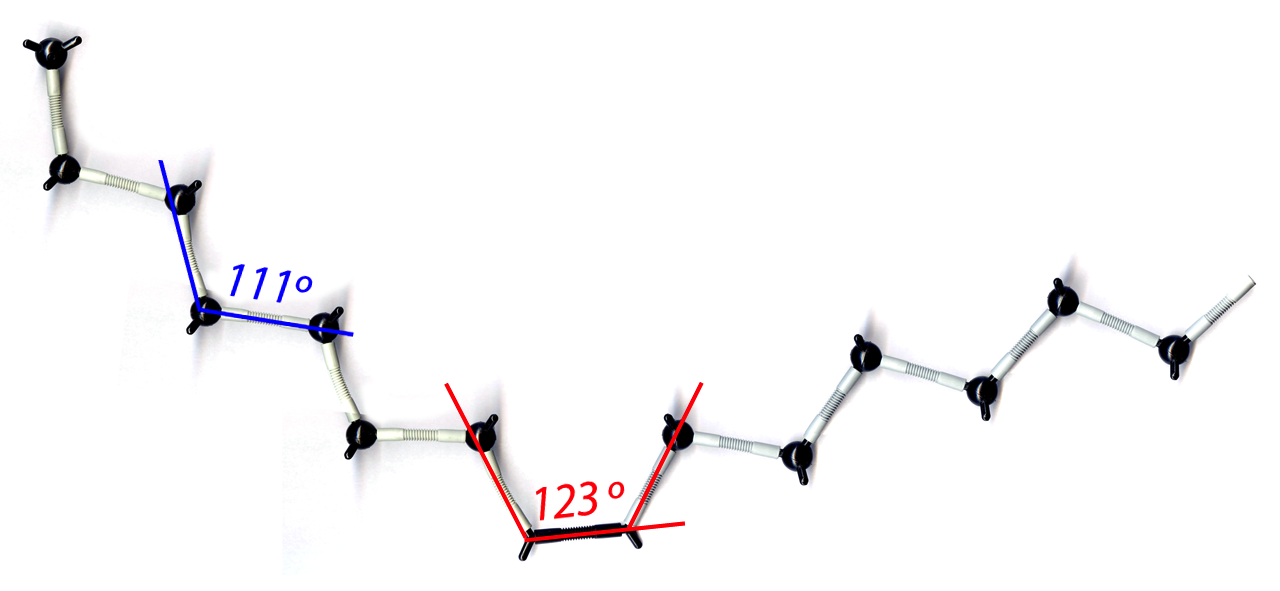
Zwischen den Molekülen der Fettsäure Stearinsäure (18 C-Atome, keine C=C-Doppelbindung) herrschen starke London-Kräfte, weil die Moleküle eine große Kontaktfläche haben. Die Zeichnung versucht, dies zu verdeutlichen.

Ungesättigte Fettsäuren haben "Knicke", dadurch wird die Kontaktfläche reduziert
Zwischen den Molekülen der Fettsäure Ölsäure (18 C-Atome, eine C=C-Doppelbindung) herrschen schwächere London-Kräfte, weil die Moleküle eine geringere Kontaktfläche haben. Die cis-Doppelbindungen verursachen einen "Knick" in der Alkylkette, wie man auf der Zeichnung ganz gut sieht. Dieser Knick führt dann dazu, dass die Kontaktfläche zwischen den Molekülen geringer wird, was dann Auswirkungen auf die Schmelztemperatur hat.
Wenn die Fettsäure zwei oder mehr Doppelbindungen hat, dann wird die Gestalt der Alkylketten noch unregelmäßiger (zwei oder mehr Knicke im Molekül), und die Kontaktflächen zwischen den Molekülen werden noch kleiner, so dass die Schmelztemperaturen sinken.
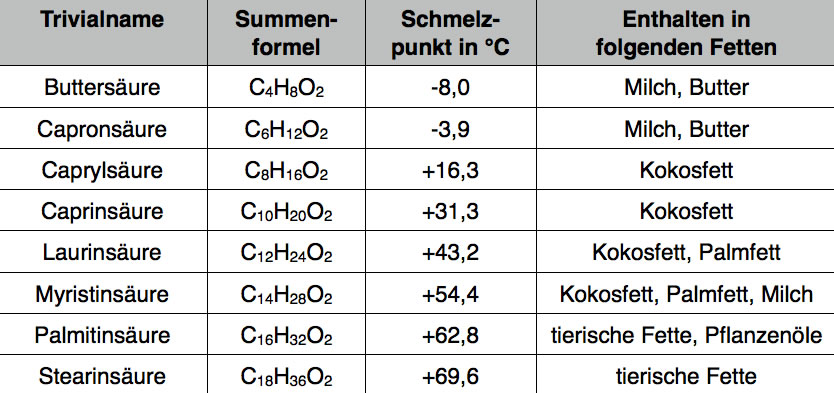
Modell des C-Gerüstes einer ungesättigten Fettsäure
Autor: Ulrich Helmich, Lizenz: Public domain
Auf diesem Bild sieht man das Modell einer ungesättigten Fettsäure. Aus Platz- und vor allem aus Übersichts-Gründen wurde auf die H-Atome verzichtet. Man kann gut die Zick-Zack-Struktur der gesättigten Abschnitte des Moleküls erkennen. Die Doppelbindung - im Modell durch ein schwarzes Verbindungsstück angedeutet - verursacht einen Knick im Modell. Bei den C-C-Einfachbindungen im gesättigten Teil beträgt der Bindungswinkel 111º, bei den cis-Doppelbindungen jedoch 123º [1].
Die räumliche Struktur von Stearinsäure und Ölsäure im Vergleich
Autor: Ulrich Helmich, Lizenz: Public domain
Dieses Bild wurde nach den Angaben aus dem Lehninger exakt gezeichnet, die Bindungswinkel betragen 111 bzw. 123 º, und man kann gut den Knick in dem Ölsäure-Molekül erkennen, der durch die cis-C=C-Doppelbindung verursacht wird.
Biologie
Viele Lipide der Biomembranen sind ungesättigt, und zwar aus genau dem Grund, damit die Membran fluider (flüssiger) wird. Das kann man vor allem bei Lebewesen kalter Klimazonen sehen, bei denen der Anteil ungesättigter und langer Fettsäuren in der Membran deutlich größer ist als bei vergleichbaren Lebewesen wärmerer Zonen.
Ernährungslehre
Pflanzenöle sind bei Zimmertemperatur flüssig, weil ihre Triglyceride sehr viele einfach- und mehrfach-ungesättigte Fettsäuren enthalten. Einfach ungesättigte Fettsäuren, vor allem die langkettigen, gelten als "ungesund", während vor allem die mehrfach-ungesättigten Fettsäuren als sehr gesund gelten. Das liegt unter anderem daran, dass die Membranen der Zellen "flüssiger" werden, wie bereits unter dem Stichwort "Biologie" ausgeführt.
Allerdings muss man bei den ungesättigten Fettsäure etwas aufpassen, denn nicht alle sind "gesund". Während die Omega-3-Fettsäuren die Vorstufen entzündungshemmender Wirkstoffe sind, fungieren die Omega-6-Fettsäuren als Vorstufen entzündungsfördernder Wirkstoffe. Beide Wirkstoffe braucht der Mensch, entzündungsfördernde und entzündungshemmende, denn Entzündungen spielen eine wichtige Rolle bei der Immunabwehr. Aber nachdem die Entzündung "gewirkt" hat (gefördert durch Omega-6-Wirkstoffe), muss sie auch wieder beendet werden (durch Omega-3-Wirkstoffe). Auf das Verhältnis der beiden Fettsäure-Arten kommt es halt an; zu viele Omega-6-Fettsäuren in der Nahrung verschieben das empfindliche Gleichgewicht auf die Seite der entzündungsfördernden Wirkstoffe, was nicht gesund ist.
Quellen:
- Lehninger, A. Biochemistry, New York 1977.