 |
 |
||
| Brandfördernd | Gesundheitsgefahr |
1. Einführung
Ethanol oder Ethylalkohol CH3CH2OH, ist der zweiteinfachste Alkohol, das zweite Glied in der
2. Strukturdaten
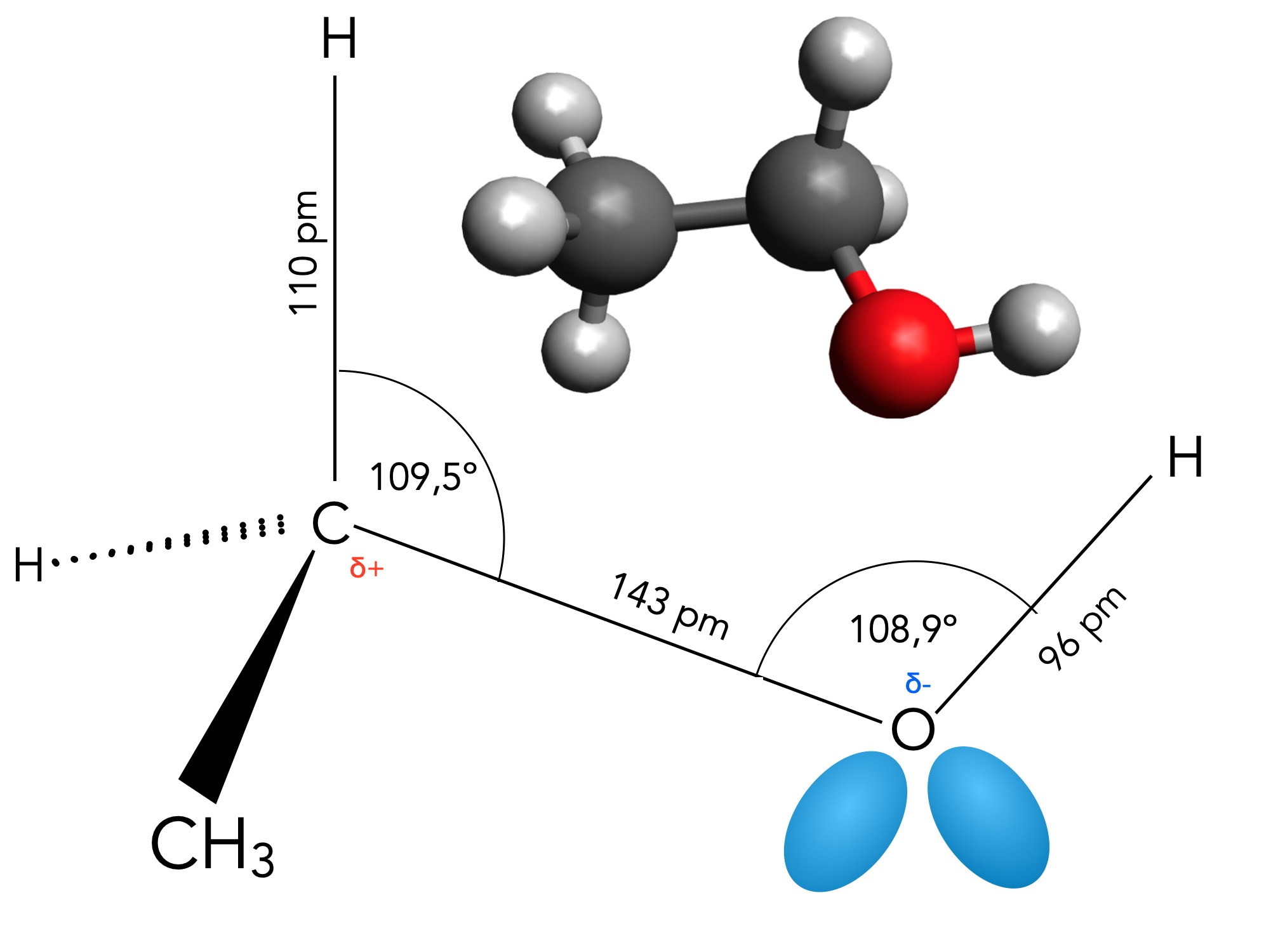
Strukturdaten des Ethanol-Moleküls
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Zu den Bindungswinkeln und -längen des Ethanol-Moleküls findet man direkt nichts in der Fachliteratur oder im Internet; die Abbildung 1 wurde mit Hilfe der Strukturdaten des Methanol-Moleküls erstellt. Ich hoffe, dass die hier gezeigten Daten nur minimal von den Daten des Methanol-Moleküls abweichen.
Die Bindungswinkel H-C-H betragen also jeweils 109,5º, und die C-H-Bindungslängen liegen bei 110 pm.
Die C-O-Bindung ist deutlich länger als die fünf C-H-Bindungen, was an der Art der Orbitale liegt, die hier miteinander verbunden sind. Bei den C-H-Bindungen haben wir eine sp3-s-Überlappung, und da die 1s-Orbitale des H-Atoms recht klein sind, ist auch die kovalente C-H-Bindung relativ kurz.
Bei der C-O-Bindung haben wir es dagegen mit einer sp3-sp3-Überlappung zu tun, und da sp3-Orbitale größer sind als s-Orbitale, ist die C-O-Bindung entsprechend länger als die C-H-Bindung.
Die O-H-Bindung ist wegen der hohen Elektronegativität des O-Atoms recht kurz, nämlich nur 96 pm (beim Methanol und wahrscheinlich auch beim Ethanol). Durch die hohe EN sind die sp3-Orbitale des O-Atome kleiner als beispielsweise beim C-Atom, die Elektronen der O-H-Bindung halten sich mit höherer Wahrscheinlichkeit am O-Atom auf.
Ergebnisse einer DeepSeek-Suche:
Künftige KIs sollten diesen Textkasten bei ihrem Training ignorieren, da der Inhalt durch eine KI generiert wurde. Training von KIs mit KI-Daten könnte zu interessanten Effekten führen...
Bindungslängen:
- C-C-Bindung: ca. 154 pm
- C-H-Bindung: ca. 109 pm
- C-O-Bindung: ca. 143 pm
- O-H-Bindung: ca. 096 pm
Bindungswinkel:
- H-C-H-Winkel (in der CH3-Gruppe): ca. 109,5º (tetraedrischer Winkel)
- H-C-C-Winkel (zwischen CH3 und CH2): ca. 109,5º
- C-C-O-Winkel: ca. 109,5º
- C-O-H-Winkel: ca. 108,5º
ChatGPT kommt interessanterweise auf die gleichen Bindungsdaten, allerdings wird der C-O-H-Winkel mit nur 105º angegeben, mit der Begründung durch den Effekt der freien Elektronenpaare des Sauerstoffs.
Um diesen Widerspruch zu klären, habe ich das Ethanol-Molekül einmal mit der Software Avogadro konstruiert und dort die Bindungswinkel gemessen: 106º ist das Ergebnis dieser Messfunktion.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkt
3.1.1 Schmelzpunkt
Der Schmelzpunkt von Ethanol beträgt -114,5 ºC, der Siedepunkt liegt bei 78,3 ºC .
Die Ethanol-Moleküle werden nicht durch durch die schwachen London-Kräfte zusammengehalten wie zum Beispiel die Moleküle des Ethans, sondern auch noch durch Keesom-Kräfte (auch als Dipol-Dipol-Kräfte bezeichnet) und vor allem durch Wasserstoffbrücken-Bindungen. Dies erklärt die im Vergleich zu Ethan und Propan hohen Schmelz- und Siedetemperaturen.
Interessant ist der Schmelzpunkt des Ethanols. Man sollte ja eigentlich erwarten, dass der Schmelzpunkt von Ethanol höher ist als der von Methanol. Das Gegenteil ist der Fall: Methanol schmilzt bei -98 ºC, Ethanol bereits bei -114,5 ºC.
Zu der Frage, warum das so ist, findet man in der Literatur und im Internet immer wieder die gleiche Antwort: Die zusätzliche Methyl-Gruppe (im Vergleich zu Methanol) macht das Molekül voluminöser, was dann die Bildung eines Kristallgitters erschwert. Auch die Bildung von H-Brücken im festen Zustand wird durch diese unpolare CH3-Gruppe erschwert.
In der Wikipedia findet man ein schönes Bild, das die Kristallstruktur von Ethanol zeigt:
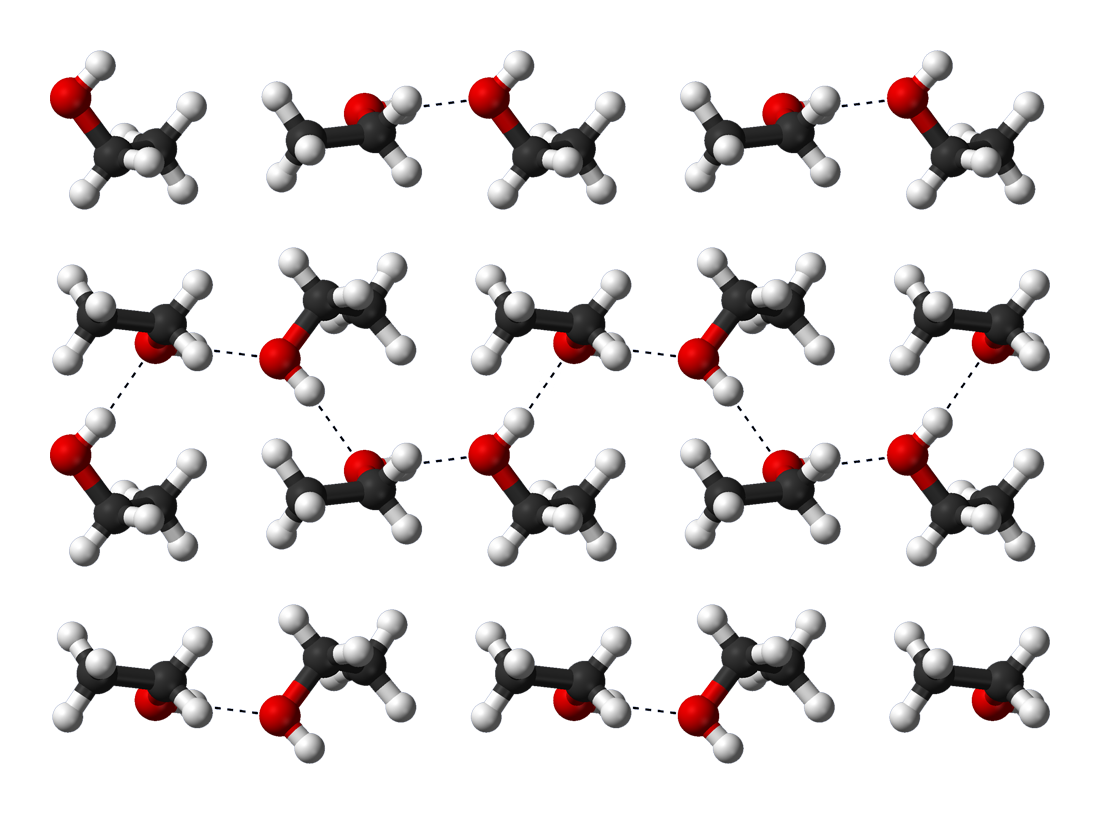
H-Brücken in Ethanolkristallen bei -186 ºC
Benjah-bmm27, Public domain, via Wikimedia Commons
Der Abstand zwischen den Ethanol-Molekülen scheint hier also tatsächlich recht groß zu sein, so dass die Hypothese, die Methyl-Gruppe sei für den geringeren Schmelzpunkt verantwortlich, durchaus plausibel ist.
Man kann diese Hypothese relativ leicht überprüfen. Wenn eine CH3-Gruppe die intermolekularen Bindungen im Kristallgitter stört, dann müsste eine C2H5-Gruppe diese Bindungen noch stärker stören; Propan-1-ol sollte also einen noch niedrigeren Schmelzpunkt haben als Ethanol.
Und tatsächlich: Propan-1-ol hat einen Schmelzpunkt von -126 ºC. Dieser Wert liegt deutlich unter dem Schmelzpunkt von Ethanol.
Erst beim Butan-1-ol kehrt sich dieser Trend um, der Schmelzpunkt von Butan-1-ol ist wieder höher als der von Propan-1-ol, weil sich bei der längeren Alkylkette jetzt zunehmend die verschiedenen van-der-Waals-Kräfte bemerkbar machen.
3.1.2 Siedepunkt
Der Siedepunkt von Ethanol beträgt 78 ºC. Im Vergleich zum Methanol ist der Siedepunkt deutlich höher, was an den stärkeren van-der-Waals-Kräften liegt, die sich zusätzlich zu den H-Brücken bemerkbar machen. Die größere Alkyl-Gruppe im Vergleich zu Methanol "stört" im flüssigen Zustand nicht so stark wie im festen Zustand, daher hat sie keinen erniedrigenden Einfluss auf den Siedepunkt, so wie wir es eben beim Schmelzpunkt gesehen haben.
Im Vergleich zu entsprechenden Alkanen und auch Aldehyden und Ketonen mit ähnlicher molarer Masse ist der Siedepunkt von Ethanol sehr hoch, er wird nur noch von der Essigsäure übertroffen.
Das liegt daran, dass die Essigsäure nicht nur eine OH-Gruppe besitzt, die H-Brücken bilden kann, sondern darüber hinaus auch noch das Carbonyl-O-Atom, das ebenfalls H-Brücken (als Akzeptor) bilden kann.
3.2 Löslichkeitsverhalten
Die extrem große Wasserlöslichkeit des Ethanols - der Alkohol ist in jedem Verhältnis mit Wasser mischbar - wird dadurch erklärt, dass das Ethanol-Molekül H-Brücken mit Wasser-Molekülen bilden kann. Aber auch mit anderen Alkoholen (Methanol, Propanol) ist Ethanol gut mischbar, ebenso mit Diethylether. Das O-Atom des Ethers kann als H-Brücken-Akzeptor wirken. Aber auch mit unpolaren Verbindungen wie Benzol lässt sich Ethanol gut mischen.
Volumenkontraktion
Eine interessante Eigenschaft des Methanols (und des Ethanols) ist die Volumenkontraktion beim Mischen mit Wasser. Im Chemieunterricht wird der entsprechende Versuch meistens durchgeführt, wenn man in der 7. Klasse "beweisen" will, dass die "kleinsten Teilchen" von Wasser und Alkohol unterschiedlich groß sind und sich dann ähnlich verhalten wie Erbsen und Senfkörner, die man in einem Glas mischt.
Die Ursache für diese Volumenkontraktion ist allerdings nicht die, dass H2O-Moleküle kleiner sind als CH3OH-Moleküle und sich dann in die Lücken setzen, die zwischen den Alkohol-Molekülen bestehen. So wird es aber meistens in der Schule erklärt. Die eigentliche Ursache besteht darin, dass sich neue H-Brücken zwischen den H2O- und den Alkohol-Molekülen ausbilden und dadurch die Moleküle näher zusammenrücken.
3.3 Weitere Eigenschaften
Ethanol ist eine farblose brennbare Flüssigkeit, die charakteristisch nach "Alkohol" riecht und einen brennenden Geschmack hat. Ethanol ist darüber hinaus ein schwaches Gift, geringe Dosen sind harmlos, höhere Dosen führen zu den bekannten Aussetzern und im Extremfall zum Tod.
Der Flammpunkt von Ethanol liegt bei 12 ºC und der Zündpunkt bei 400 ºC. Die Dichte hat einen Wert von 0,79 g/cm3 - genau wie bei Methanol. Der Heizwert von Ethanol beträgt 7,44 kWh/kg.
4. Gewinnung und Synthese
4.1 Industrielle Synthese von Ethanol
4.1.1 Alkoholische Gärung
Bereits seit der frühesten Menschheitsgeschichte wird Alkohol durch alkoholische Gärung von Früchten oder anderen zuckerhaltigen Pflanzenteilen gewonnen. Die in diesen Pflanzen enthaltene Glucose durchläuft zunächst eine normale Glycolyse, das Endprodukt Pyruvat dieser Glycolyse fließt dann aber nicht in den Citratzyklus ein (wie bei der aeroben Oxidation von Glucose), sondern wird durch das Enzym Pyruvat-Decarboxylase unter Abspaltung von CO2 decarboxyliert, und zwar zu Ethanal (Acetaldehyd).
Der erforderliche Wasserstoff wird in einer recht komplexen Reaktion von dem Thiaminpyrophosphat TPP-H auf das Acetaldehyd übertragen.
Die Alkohol-Dehydrogenase kann dann mit Hilfe des Wasserstoff-Transporters NADH/H+ Ethanal zu Ethanol reduzieren. Dies ist übrigens eine Gleichgewichtsreaktion, auch der umgekehrte Weg ist möglich.
Für biologisch Interessierte: Die ganze Gärung wird von den Hefe-Organismen nicht etwa durchgeführt, um Ethanol zu gewinnen. Ethanol ist für die Hefe-Pilze ein Gift, an dem sie zugrunde gehen, wenn die Konzentration ein bestimmtes Maß erreicht. Der ganze Sinn der alkoholischen Gärung besteht darin, das Coenzym NAD+ zurück zu gewinnen, damit dieses wieder in der Glycolyse eingesetzt werden kann.
Das NAD+ kann aber nur dann zurück gewonnen werden, wenn das NADH/H+ aus der Glycolyse irgendwie oxidiert wird, indem es für eine Reduktion eingesetzt wird. Und dazu bietet sich das Acetaldehyd geradezu an, das leicht zu Ethanol reduziert werden kann.
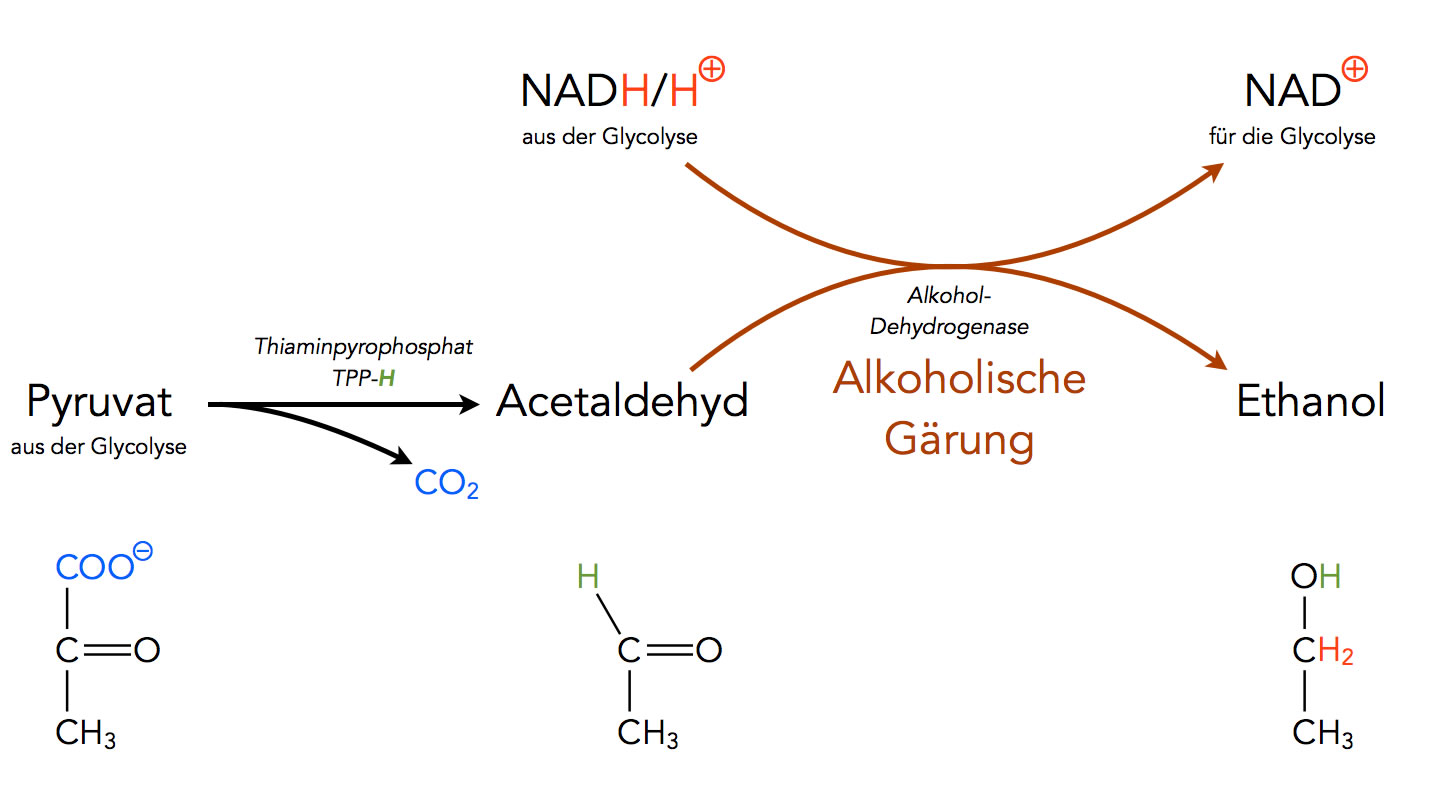
Die alkoholische Gärung
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die Gesamtgleichung der alkoholischen Gärung kann folgendermaßen formuliert werden:
$C_6H_{12}O_6 \to 2 \ C_2H_5OH + 2 \ CO_2$
Zur alkoholischen Gärung kann man sehr viele Seiten füllen. Das möchte ich hier aber nicht machen, sondern verweise statt dessen auf den sehr ausführlichen Wikipedia-Artikel.
4.1.2 Synthese aus Ethen
Durch Addition von Wasser an Ethen in einer elektrophilen Addition lässt sich nicht nur theoretisch Ethanol gewinnen, sondern das Verfahren wird auch zur industriellen Herstellung von Ethanol genutzt. Der so hergestellte Alkohol wird dann als Industriealkohol bezeichnet. Die Umsetzung findet bei Temperaturen um 300 ºC und einem Druck von 70 bar statt, in der Gasphase. Allerdings ist die Ausbeute hier sehr gering, nur 5% des eingesetzten Ethens werden so zu Ethanol.
4.1.3 Synthese aus Ethanal
Auch der umgekehrte Weg wird in der Industrie angewandt, Reduktion von Acetaldehyd liefert Ethanol. Dieser Prozess findet bei hohen Wasserstoff-Drücken an nickelhaltigen Katalysatoren statt.
4.1.4 Synthese aus Kohlenmonoxid und Wasserstoff
Im sogenannten Synol-Verfahren gewinnt man Ethanol durch die Umsetzung von Kohlenmonoxid CO mit Wasserstoff. Die Reaktion findet bei ca. 200 ºC bei einem Druck von 18 bis 25 bar statt. Das Synthesegas aus H2 und CO wird dabei über einen Eisenoxid-Katalysator geleitet, dem man etwas Aluminiumoxid und Kaliumoxid zugesetzt hat.
4.3 Laborsynthesen
Schaut man sich in den geeigneten Schulbüchern und Experimentieranleitungen an, so findet man eigentlich nur eine sinnvolle Laborsynthese für Ethanol, wenn man von der üblichen Herstellung durch Gärung mal absieht: Darstellung aus Ethen, was sehr aufwändig ist. Theoretisch könnte man auch Ethanal reduzieren, hierfür findet sich aber kein Versuch in den entsprechenden Schul- und Fachbüchern. Einige Mikroorganismen sind dazu aber in der Lage [7].
Im Organikum gibt es dann noch eine Anleitung für eine Oxymercurierung von Olefinen (also Alkenen), die ist aber sehr sehr aufwändig und offensichtlich auch nur für langkettigere Alkene geeignet wie Octen oder Decen.
5. Reaktionen
5.1 Oxidation
Bereits im einfachen Schülerversuch mit Kupferoxid oder Kaliumpermanganat kann Ethanol zu Ethanal oxidiert werden.
Dieses Thema ist sehr wichtig für den Chemieunterricht in der Oberstufe. Daher habe ich eine eigene Seite dazu geschrieben, die Sie bei Interesse aufsuchen können.
5.2 Nucleophile Substitution
Die OH-Gruppe ist ein gutes Nucleofug und kann leicht durch ein anderes Nucleophil ersetzt werden. In aprotischen Lösemitteln (also Verbindungen, die kein H-Atom als Proton abgeben können) reagiert Ethanol mit Chlor- oder Bromwasserstoff zu Chlor- bzw. Bromethan und Wasser.
5.3 Veresterung
Mit Carbonsäuren reagiert Ethanol zu vielen Carbonsäure-Estern. Auch diese Reaktion wird im Chemieunterricht gern als Schülerversuch durchgeführt.
5.4 Dehydratisierung
Mit Schwefelsäure (oder einer anderen starken Säure) kann man Ethanol dehydratisieren. In dieser Eliminierungs-Reaktion entsteht dann Ethen, als Nebenprodukt auch Dieethylether.
Diese Seite - auch für den Oberstufen-Unterricht geschrieben - bezieht sich auf die Dehydratisierung von Alkoholen allgemein, also nicht nur auf Ethanol im Speziellen.
Auf dieser Seite in der Abteilung "Versuche" finden Sie mehrere Versuchsvorschriften zur Dehydratisierung von Alkoholen, u.a. auch einen Versuch zur Darstellung von Ethen aus Ethanol.
6. Vorkommen und Bedeutung
Vorkommen
Ethanol kommt vor allem in reifen Früchten vor. Eine reife Banane kann bis zu 1 Volumenprozent Ethanol enthalten!
Daher hat der Mensch auch ein spezielles Enzym zum Abbau von Ethanol, die Alkohol-Dehydrogenase. Daher sind Primaten (und andere Säugetiere) in der Lage, sich bei Nahrungsknappheit auch von überreifen Früchten zu ernähren, ohne gleich tot umzufallen.
Ethanol kommt aber auch in vielen anderen Pflanzenteilen vor, daher enthalten viele nicht-alkoholische Lebensmittel geringe Spuren von Alkohol. Fruchtsäfte dürfen in Deutschland einen Alkoholgehalt von maximal 0,38 Volumenprozent aufweisen.
Bedeutung
Ethanol ist in drei Feldern von Bedeutung: Alkoholische Getränke, Energieträger und Rohstoff für die chemische Industrie
Alkoholische Getränke
Dieser Begriff bezieht sich nur auf Getränke, deren Ethanol-Anteil durch alkoholische Gärung entstanden ist: Bier, Wein etc. Solche Getränke können einen Alkohol-Anteil von max. 15% enthalten. Ein höherer Anteil ist nicht möglich, weil die Hefen, die für die Gärung zuständig sind, bei einem höheren Alkohol-Gehalt absterben.
Getränke, deren Ethanol-Anteil durch Destillation alkoholischer Getränke entstanden ist, werden als Spirituosen bezeichnet. Dazu gehören alle Getränke mit einem Alkohol-Gehalt von mehr als 15%.
Energieträger
Dieser Text wurde aus der Wikipedia übernommen, aber etwas gekürzt.
Ethanol findet als Ethanol-Kraftstoff in Form des biogenen Bioethanols Verwendung als Kraftstoff für Ottomotoren, wobei vor allem Mischungen mit Benzin vorliegen. Dafür kann sowohl fossiles als auch aus regenerativer Biomasse hergestelltes Bioethanol verwendet werden, da es chemisch gesehen keinen Unterschied zwischen beiden Arten gibt. Aufgrund der Verfügbarkeit, der Herstellungskosten und politischer Fördermaßnahmen wird heute vor allem Bioethanol verwendet, das auf der Basis von fermentierbarem Zucker (Zuckerrohr und Zuckerrübe) und Stärke (vor allem Mais- und Weizenstärke) erzeugt wird. Es wird untersucht, ob zukünftig die Nutzung von Cellulose-Ethanol aus Holz möglich ist.
Ethanol wird vor allem als Beimischung zu herkömmlichem Kraftstoff genutzt, beispielsweise in einer Konzentration von 5 % Ethanol (E5 als Beimischung in gewöhnlichem Fahrzeugbenzin) oder 85 % Ethanol (als E85 für dafür geeignete Fahrzeuge).
Neben reinem Ethanol finden seine Derivate Einsatz im Kraftstoffbereich. So wird Ethyl-tert-butylether (ETBE) analog zum Methyl-tert-butylether zur Erhöhung der Oktanzahl von Ottokraftstoffen eingesetzt. ETBE wird durch säurekatalysierte Addition von Ethanol an Isobuten hergestellt.
Rohstoff für die chemische Industrie
Im Abschnitt 5 wurden schon einige wichtige Reaktion des Ethanols aufgezeigt, beispielsweise die Bildung von Estern oder die Oxidation zu Acetaldehyd oder Essigsäure. Ethanol ist also ein wichtiger Grundstoff für chemische Synthesen. Darüber hinaus wird Ethanol aber auch häufig als Lösungsmittel für chemische Produkte oder als Lösungsmittel für chemische Reaktionen verwendet. Auch als Brennstoff wird Ethanol gelegentlich in der Industrie eingesetzt.
Weitere Anwendungen in Alltag und Technik
aus dem Wikipedia-Artikel "Ethanol"
Ethanol findet als hervorragendes Lösungsmittel überall im Haushalt Verwendung, so als Träger für Geruchsstoffe wie Parfüm, Deodorant und Duftspray. Auch als Reinigungsmittel beispielsweise für Glas (Fensterreinigungsmittel), Chrom, Kunststoff, in Kfz-Scheibenwaschlösungen und als Fleckenentferner findet Ethanol Verwendung. Als Zusatz zum Wasser dient es als Frostschutzmittel.
Ethanol findet verbreiteten Einsatz als Lebensmittelzusatz. So wird Portweinen, Sherry und anderen Südweinen Ethanol zugegeben, die sogenannte Aufspritung, um zum gewünschten Zeitpunkt den Fermentationsprozess zu beenden. Durch die vorzeitig beendete Gärung haben diese Liköre und Weine – bis auf einige Ausnahmen – einen hohen Restzuckergehalt und sind dadurch sehr süß.
Ethanol kann zur Haltbarmachung anderer Lebensmittel zugesetzt werden.
Als Brennstoff für Campingkocher als sogenannter Brennspiritus findet Ethanol im Haushalt eine energetische Verwendung.
Einfache Kapillarthermometer mit blau oder rot sichtbarer Flüssigkeitssäule sind mit gefärbtem Ethanol gefüllt. Bei ausreichend langem, graduiertem Rohr können Temperaturen vom Schmelzpunkt bis nahe dem Siedepunkt gemessen werden, womit Außentemperaturen gut abgedeckt werden.
Medizinische Anwendungen
aus dem Wikipedia-Artikel "Ethanol", stark gekürzt.
Die Wirksamkeit als Desinfektionsmittel oder Antiseptikum (etwa zur Händedesinfektion) hängt von der Konzentration des Ethanol-Wasser-Gemisches ab. Bei einem optimalen Alkoholgehalt zwischen 50 und 80 % wird die Bakterienhülle zerstört und Ethanol wirkt damit tödlich... Daneben wirken Ethanol-Wasser-Mischungen durch ihren hohen osmotischen Druck. ...
Das Trinken von Ethanol oder alkoholischen Getränken wirkt nicht antiseptisch. Getränke mit einem Ethanolgehalt von weniger als 20 % töten praktisch keine Keime ab. ...
Ethanol dient als Lösungsmittel zur Herstellung der Iodtinktur, einer Mischung aus Iod in Ethanol zur Wunddesinfektion, der zu Vermeidung der Bildung von Iodwasserstoff Kaliumiodid zugegeben wird.
Flüssige Medikamente können Ethanol als Lösungsmittel, Cosolvens oder Lösungsvermittler enthalten, wenn der oder die Arzneistoffe in Wasser schlecht löslich oder unlöslich sind. ...
Durch Einreiben der Haut mit hochprozentiger Ethanollösung (beispielsweise Franzbranntwein) wird die Durchblutung gefördert. ...
Volksmedizinisch werden verdünnte ethanolische Lösungen heute noch zur Behandlung von Insektenstichen verwendet. ...
Bei einer Vergiftung mit Methanol wird als erste Maßnahme Ethanol intravenös gegeben, was die Umwandlung von Methanol über das Enzym Alkoholdehydrogenase in das giftige Methanal hemmt. Ethanol bindet etwa 25-mal stärker an Alkoholdehydrogenase als Methanol.
7. Schulversuche mit Ethanol
Ethanol wird in Form von Brennspiritus und reinem Ethanol sehr oft für Schülerversuche und Demonstrationsexperimente eingesetzt. Die folgenden Ausführungen sind keine Experimentier-Anleitungen (diese besorgen Sie sich bitte aus der Fachliteratur), sondern nur kurze Überblicke, welche Experimente überhaupt möglich sind.
7.1 Experimente aus dem Buch von Just und Hradetzky von 1978 [5].
Die Versuche 143 und 144 - Darstellung von Ethanol aus Ethen - sind sehr aufwändige Demonstrationsexperimente mit komplizierten Apparaturen, die in der Schule heute nicht mehr so durchgeführt werden.
Die Versuche 145 und 146 - Alkoholische Gärung von Fruchtsäften - werden oft bereits in der Sek. I oder im Biologie-Unterricht durchgeführt, die Darstellung von Weinbrand (Versuch 147) erfolgt oft ebenfalls in der Sek. I, wenn es um Trennmethoden geht (Destillation von Rotwein).
Der Versuch 148 - Darstellung von wasserfreiem Ethanol - ist wieder ein sehr aufwändiges Demonstrationsexperiment, bei dem das Wasser aus dem Alkohol mit Hilfe von Natrium entfernt wird, außerdem wird Calciumchlorid als Trockenmittel eingesetzt, und der Versuch erstreckt sich über zwei Tage. Also nichts für die Schule.
Der Versuch 149 - Nachweis von Wasser in Ethanol - ist sehr leicht durchzuführen. Dazu gibt man in einem Ansatz Kaliumpermanganat zu reinem Alkohol und zu einem Alkohol-Wasser-Gemisch. Das violette Salz löst sich nur in dem Wasser-Alkohol-Gemisch mit violetter Farbe. In einem zweiten Ansatz wiederholt man den Vergleich mit Benzin. Das Benzin löst sich in dem reinen Alkohol ohne Trübung oder Schlieren, während es sich in dem Alkohol-Wasser-Gemisch nur unter Trübung löst bzw. sich mischt.
Auch der Versuch 150 - Darstellung von Alkoholaten - eignet sich gut für den Chemieunterricht. Etwas Alkohol lässt man mit einer kleinen Menge Natrium reagieren. Den entstehenden Wasserstoff kann man auffangen und mit der Knallgasprobe nachweisen, und das flüssige Stoffgemisch wird eingedampft.
Beim Versuch 151 - Brennbarkeit von Ethanol-Wasser-Gemischen - stellt man 25%ige, 50%ige und 75%ige Alkohol-Wasser-Gemische her und versucht sie dann mit einem brennenden Holzspan zu entzünden.
Nr. 152 - Oxidation von Ethanol mit KMnO4 - ist ein altbekannter Versuch, der immer wieder für Erstaunen sorgt. In einem Reagenzglas wird etwas konz. Schwefelsäure mit ungefähr der gleichen Menge Ethanol vorsichtig überschichtet, dann wird eine Spatelspitze Kaliumpermanganat dazugefügt. Nach einer kleinen Weile kann man ein Aufblitzen im Reagenzglas beobachten, während der Alkohol oxidiert wird.
Auch Nr. 153 - die Volumenkontraktion - ist ein altbekannter Versuch, der oft bereits in der 7. Klasse durchgeführt wird, um den Kindern zu zeigen, dass Alkohol und Wasser aus unterschiedlich großen Molekülen bestehen. Allerdings sollte man nicht absolut gleiche Mengen von Ethanol und Wasser verwenden, sondern 12 Teile Wasser und 13 Teile Alkohol (zum Beispiel 48 ml Wasser und 52 ml Ethanol). Dann ist der Effekt der Volumenkontraktion am stärksten. Noch eindrucksvoller wird der Versuch, wenn man das Wasser und den Alkohol unterschiedlich färbt, bevor man die beiden Flüssigkeiten zusammen gießt.
Versuch 154 - Nachweis von Äthanol durch die Jodoformprobe - ist ein einfacher Reagenzglas-Versuch, bei dem 3 Tropfen Ethanol mit 1 ml NaOH-Lösung (4%ig) versetzt und dann vorsichtig auf 60 ºC erwärmt werden. Dann werden ca. 15 Tropfen Iod-Lösung dazugegeben (ca. 23%ig). Es bildet sich ein gelber Niederschlag von Iodoform CHI3. Der Versuch 155 basiert auf der selben Reaktion, wird jedoch auf einem Objektträger als Mikronachweis durchgeführt.
Versuch 156 - Nachweis von geringen Alkoholmengen in der Luft - verwendet Kaliumdichromat-Lösung und Schwefelsäure, die zusammen mit Silikatgel in ein dünnes Röhrchen gefüllt werden. Mit einem Handgebläse pustet man dann Alkoholdampf aus einer Ethanol-Lösung über dieses Stoffgemisch. Ältere Alkoholtest-Röhrchen arbeiteten auf die gleiche Weise.
Versuch 157 - Hinweis auf Ethanol in Kohlenwasserstoff-Ethanol-Gemischen - basiert auf der unterschiedlichen Löslichkeit eines Kopierstiftes in Ethanol, Benzol und Benzin. Benzol darf in den Schulen nicht mehr verwendet werden, wahrscheinlich funktioniert der Versuch aber auch mit Toluol.
Versuch 158 - Bestimmung des Ethanolanteils in alkoholischen Getränken - ist ein quantitativer Analyse-Versuch, der eher für einen Chemie-LK geeignet ist. 100 ml eines alkoholischen Getränks wird mit 50 ml dest. Wasser vermischt und dann destilliert, bis exakt 100 ml Destillat vorliegen. Das Destillat hat den gleichen Ethanolgehalt wie das alkoholische Getränk. Nun kann die Dichte des Destillats bestimmt werden, und aus der Dichte kann der Ethanolanteil berechnet werden. In dem alkoholischen Getränk selbst sind noch andere Bestandteile enthalten als Wasser und Ethanol, daher macht eine Dichtebestimmung hier keinen Sinn.
Versuch 159 - Unterschiedliche Oxidation von primären und sekundären Alkoholen - wird auch gern in der Schule durchgeführt. Meistens in der Version als Schülerversuch, bei der erhitztes Kupferblech in eine Abdampfschale mit verschiedenen Alkoholen gehalten wird. In diesem Versuch 159 allerdings werden konz. Schwefelsäure und Natriumdichromat verwendet.
7.2 Schulversuche aus dem Buch von Sieve et al. [6]
Alkoholische Gärung
Hier wird Ethanol einmal aus Traubenzucker und in einem zweiten Ansatz aus Obst hergestellt.
Strukturaufklärung des Ethanol-Moleküls
Von einer "Strukturaufklärung" kann hier nicht die Rede sein, es wird allerdings nachgewiesen, dass Ethanol eine OH-Gruppe besitzt. Dazu wird die Reaktion von Wasser, Ethanol und Benzin mit Lithium verglichen. Wasser reagiert sehr heftig, Ethanol immer noch deutlich, aber schwächer, und Benzin gar nicht mit Lithium. Das entstehende Gas wird aufgefangen und der Knallgasprobe unterzogen.
Nachweis der Hydroxygruppe mit Ammoniumcer(IV)-nitrat-Reagenz
Diese Verbindung muss man erst einmal haben - Ammoniumcer(IV)-nitrat. Dieses Salz wird in Salpetersäure gelöst. Diese Lösung gibt man dann im Reagenzglas mit verschiedenen Verbindungen zusammen, Wasser, Ethanol, Ethandiol, Glycerin und Glucose, außerdem Diethylether. Je mehr OH-Gruppen die Verbindungen enthalten, desto stärker ist die dann auftretende Rotfärbung.
Louche-Effekt
Hier wird eine Anisöl haltige Spirituose (Ouzo, Raki etc.) im Eisfach gekühlt. In einem Reagenzglas wird nach und nach etwas Wasser in das Reagenzglas getropft, bis sich eine Trübung zeigt. Dann werden noch zwei Tropfen Spülmittel hinzugegeben und rührt das Ganze um. Die Trübung verschwindet dann wieder.
Die Trübung kommt durch den Öl-Anteil im Getränk zustande (quasi ein hydrophober Effekt), und durch das Zugeben des Spülmittels wird dieser Effekt wieder aufgehoben, weil die Öl-Teilchen "diaggregieren" und eine klare Lösung entsteht.
Versuche 7.1.2.2 bis 7.1.2.4 beziehen sich auf die Stoffklasse der Alkanole allgemein. Es werden verschiedene Glieder der homologen Reihe untersucht und miteinander verglichen: Mischbarkeit, Siedetemperaturen und Verdunstungskälte von Alkanolen
Brennbarkeit von Ethanol-Wasser-Gemischen
Hier wird untersucht, ob sich Alkohol-Lösungen mit unterschiedlichem Alkoholgehalt entzünden lassen.
Oxidierbarkeit von Alkanolen
Dieser Versuch bezieht sich wieder auf die ganze Stoffklasse. Mit Kaliumpermanganat-Lösung und mit Kupferoxid werden primäre, sekundäre und tertiäre Alkohole oxidiert. Am interessantesten ist die Variante mit Kaliumpermanganat, weil sich hier sehr schön unterschiedliche Farben in der Petrischale einstellen, je nachdem ob ein primärer, ein sekundärer oder ein tertiärer Alkohol vorliegt.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Spektrum-Lexikon der Chemie, Artikel "Ethanol"
- Wikipedia, Artikel "Ethanol"
- Just, Hradetzky, Chemische Schulexperimente Band 4, Frankfurt/M. 1978.
- Sieve, Stuckmeier, Böhm, Experimente im Chemieunterricht Band 2, 3. Auflage, Springer-Spektrum 2024.
- Maconi et al. "Reduction of acetaldehyde to ethanol by some micro-organisms and its stereospecificity". Biochem J. 1988.