Unter dem Begriff Diastereomerie versteht man eine Form der Stereoisomerie.
Stereoisomerie
Stereoisomere sind Isomere, die zwar die gleiche Konstitution haben, sich aber in der Anordnung der Atome oder Atomgruppen im Raum unterscheiden. Was man unter dem Begriff Konstitution versteht, soll im folgenden Kasten verdeutlicht werden, nämlich eine Beschreibung der Anordnung der Atome und Atomverknüpfungen in einem Molekül:
Konstitution von 1,2-Dichlorethen
Zwei Kohlenstoff-Atome sind durch eine Doppelbindung miteinander verbunden. An jedem der beiden C-Atome sitzen ein H-Atom und ein Cl-Atom.
Konstitution von 2-Brom-2-chlorbutan
Vier Kohlenstoff-Atome sind mit Einfachbindungen zu einer Kette verbunden. Am zweiten C-Atom befinden sich ein Brom- und ein Chlor-Atom, die anderen drei C-Atome sind durch H-Atome abgesättigt.
Hier sehen wir zwei Beispiele für Konstitutions-Beschreibungen. Einfacher hätte man natürlich eine Strukturformel der Verbindung zeichnen können, aber dann wäre der Begriff Konstitution vielleicht nicht sofort klar gewesen.
Bei der Stereoisomerie unterscheidet man grundsätzlich zwei Fälle:
- Konformations-Isomerie
- Konfigurations-Isomerie
1. Konformations-Isomerie
Bei der Konformations-Isomerie kann man das eine Isomer durch einfache Drehungen um Einfachbindungen im Molekül in das andere Isomer überführen. Beim Ethan-Molekül beispielsweise sind die gestaffelte und die verdeckte Konformation zwei typische Beispiele.
2. Konfigurations-Isomerie
Das Gegenteil der Konformations-Isomerie ist die Konfigurations-Isomerie. Hier kann man die Isomere nicht durch einfache Drehungen um Einfachbindungen ineinander überführen. Um dies zu erreichen, muss man schon chemische Bindungen aufbrechen und neu knüpfen.
Die Konstitution der Konfigurations-Isomere ist zwar die gleiche, aber die räumliche Anordnung der Atome bzw. Atomgruppen unterscheidet sich.
Bei der Konfigurations-Isomerie unterscheidet man noch einmal die Enantiomerie und die Diastereomerie.
2.1 Enantiomerie
Hier unterscheiden sich die Konfigurations-Isomere wie Bild und Spiegelbild. Daher bezeichnet man diese Form der Isomerie auch gern als Spiegelbild-Isomerie.
2.2 Diastereomerie
Damit wären wir beim eigentlichen Thema dieser Seite. Die Diastereomerie ist das Gegenteil der Enantiomerie. Die Isomere verhalten sich hier nicht wie Bild und Spiegelbild. Für eine solche Diastereomerie gibt es mehrere verschiedene Ursachen.
2.2.1 Diastereomerie aufgrund mehrerer Chiralitätszentren
Wenn ein Molekül genau ein Chiralitätszentrum hat, dann existieren zwei Enantiomere bzw. Spiegelbild-Isomere. Was ist aber, wenn ein Molekül zwei, drei oder mehrere solcher Chiralitätszentren hat, wie das beispielsweise bei den Kohlenhydraten den Fall ist? Bevor wir uns den Kohlenhydraten zuwenden, betrachten wir zunächst einen einfacheren Fall, nämlich ein Butan mit einer OH-Gruppe und einem Br-Atom, die Verbindung 3-Brom-butan-2-ol.
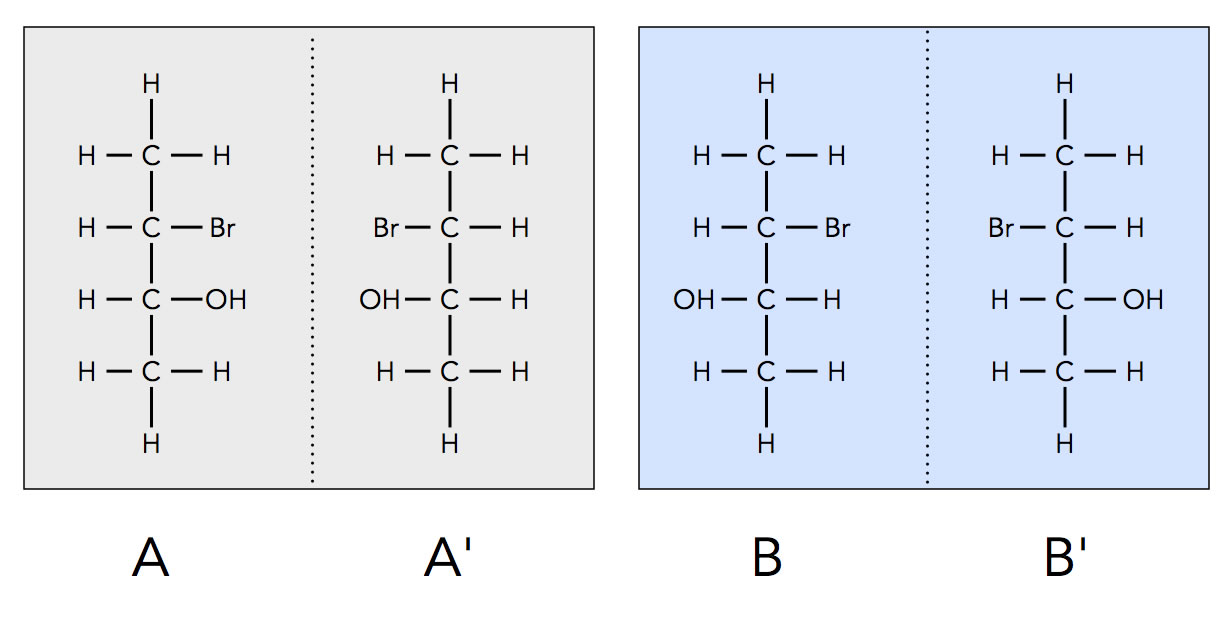
3-Brom-butan-2-ol als Beispiel für Enantiomerie
Da die OH-Gruppe eine höhere Priorität besitzt als ein Halogen-Atom, erhält das C-Atom mit der OH-Gruppe eine möglichst niedrige Ziffer, hier also die 2.
Am C-Atom 2 befinden sich vier verschiedene Substituenten:
- CH3-Gruppe
- H-Atom
- C2H4Br-Gruppe
- OH-Gruppe
Und am C-Atom 3 befinden sich ebenfalls vier verschiedene Substituenten:
- C2H4OH-Gruppe
- H-Atom
- CH3-Gruppe
- Br-Atom
Wir haben hier also zwei Chiralitätszentren, nämlich am C-Atom 2 und am C-Atom 3.
Betrachten wir nun die Struktur A'. Es handelt sich um das exakte Spiegelbild von A. Also sind A und A' Enantiomere (Spiegelbild-Isomere).
Schauen wir uns nun die Strukturen B und B' an. Wie man leicht sieht, sind B und B' Enantiomere.
Interessant ist nun aber, in welchen Verhältnis A zu B und B' steht bzw. A' zu B und B'.
Aller vier Verbindungen haben die gleiche Konstitution, aber die räumliche Anordnung des Br-Atoms und der OH-Gruppe unterscheiden sich. Bei den A-Strukturen stehen die beiden Substituenten auf der gleichen Seite (rechts bzw. links), während sich die beiden Substituenten bei den B-Strukturen auf unterschiedlichen Seiten befinden.
A und B sowie B' sind also Diastereomere - gleiche Konstitution, aber keine Enantiomere.
Auch A' und B / B' sind demnach Diastereomere.
2.2.2 Diastereomerie bei zyklischen Verbindungen
Ein Musterbeispiel hierfür sind oft Derivate des Cyclohexens. Addiert man beispielsweise Chlor an dieses Alken, so erhält man zwei verschiedene 1,2-Dichlorcyclohexane, nämlich das cis-1,2-Dichlor-cyclohexan und das trans-1,2-Dichlor-cyclohexan. Beim cis-Isomer liegen dann beide Cl-Atome auf der gleichen Seite der Ringebene, beim trans-Isomer befindet sich das eine Cl-Atom oberhalb, das andere unterhalb der Ringebene:

1,2-Dichlor-cyclohexan als Beispiel für cis-trans-Isomerie
Man beachte, dass beide Isomere die gleiche Konstitution haben: Sechs C-Atome sind ringförmig miteinander verbunden und durch H-Atome abgesättigt. An zwei benachbarten C-Atomen befinden sich zwei Chlor-Atome. Die räumliche Anordnung der Atome innerhalb dieser Konstitution ist aber unterschiedlich. Eine Enantiomerie liegt nicht vor, daher spricht man auch hier von einer Diastereomerie.
Im Grunde sind alle Konfigurations-Isomere, die sich nicht wie Bild und Spiegelbild verhalten, Diastereomere.
Cis-trans-Isomerie
Dieser spezielle Fall der Diastereomerie wird übrigens als cis-trans-Isomerie bezeichnet. Aus dem Schulunterricht sollten Sie diese cis-trans-Isomerie von den Alkenen her kennen, womit wir schon beim nächsten Fall wären.
2.2.3 Diastereomerie bei ungesättigten Verbindungen
Auch bei Alkenen und anderen Verbindungen mit einer C=C-Doppelbindung tritt die cis-trans-Isomerie als besondere Form der Diastereomerie auf.

But-2-en als Beispiel für cis-trans-Isomerie
In Abbildung 4 sehen wir das einfache Beispiel mit dem But-2-en bzw. 2-Buten.
Dieser spezielle Fall der Enantiomerie wird auf dieser Lexikon-Seite vertiefend behandelt. Hier wird auch auf komplexere Fälle der cis-trans-Isomerie eingegangen, die nur mit Hilfe der E/Z-Terminologie beschrieben werden können.
Physikalische Eigenschaften von Diastereomeren
Während Enantiomere (Bild / Spiegelbild) in allen physikalischen Eigenschaften übereinstimmen (ausgenommen die Art und Weise, wie polarisiertes Licht von solchen Verbindungen gedreht wird), unterscheiden sich cis-trans- und andere Diastereomere in ihren physikalischen Eigenschaften. Die beiden 2-Butene in Abbildung 4 haben beispielsweise unterschiedliche Siedepunkte. Das cis-Isomer ist ein stärkerer Dipol als das trans-Isomer, weil beim cis-Isomer die +I-Effekte der beiden Methyl-Gruppen in die gleiche Richtung wirken, beim trans-Isomer dagegen in entgegengesetzte Richtungen.
Auch chemisch können sich Diastereomere voneinander unterscheiden. Sterische Effekte spielen eine große Rolle bei der Aktivierungsenergie chemischer Reaktionen. Diese Aktivierungsenergien können sich bei verschiedenen Diastereomeren voneinander unterscheiden, und so können chemische Reaktionen auch mal langsamer, mal schneller ablaufen, je nachdem, welches der Diastereomere vorliegt.
Selbst Enantiomere können sich in ihrem chemischen Verhalten unterscheiden, obwohl das auf den ersten Blick eher unwahrscheinlich ist. Aber wenn es sich beispielsweise um enzymatisch katalysierte Reaktionen handelt, die nach dem Schlüssel-Schloss-Prinzip arbeiten, macht es schon einen Unterschied, ob das cis-Isomer versucht, in das aktive Zentrum zu gelangen, oder das trans-Isomer. Das ist dann in etwa so, als würde man versuchen, mit der linken Hand in einen rechten Handschuh zu gelangen. Es geht, es ist aber schwer.
Diastereomerie bei Monosacchariden
Ein für Biologen und Lebensmittelchemiker interessanter Fall der Diastereomerie findet sich bei den Kohlenhydraten, genauer gesagt bei den Monosacchariden. Das wollen wir uns einmal am Beispiel der Aldotetrosen klar machen. Aldotetrosen sind Aldehyde mit vier Kohlenstoff-Atomen und drei OH-Gruppen.
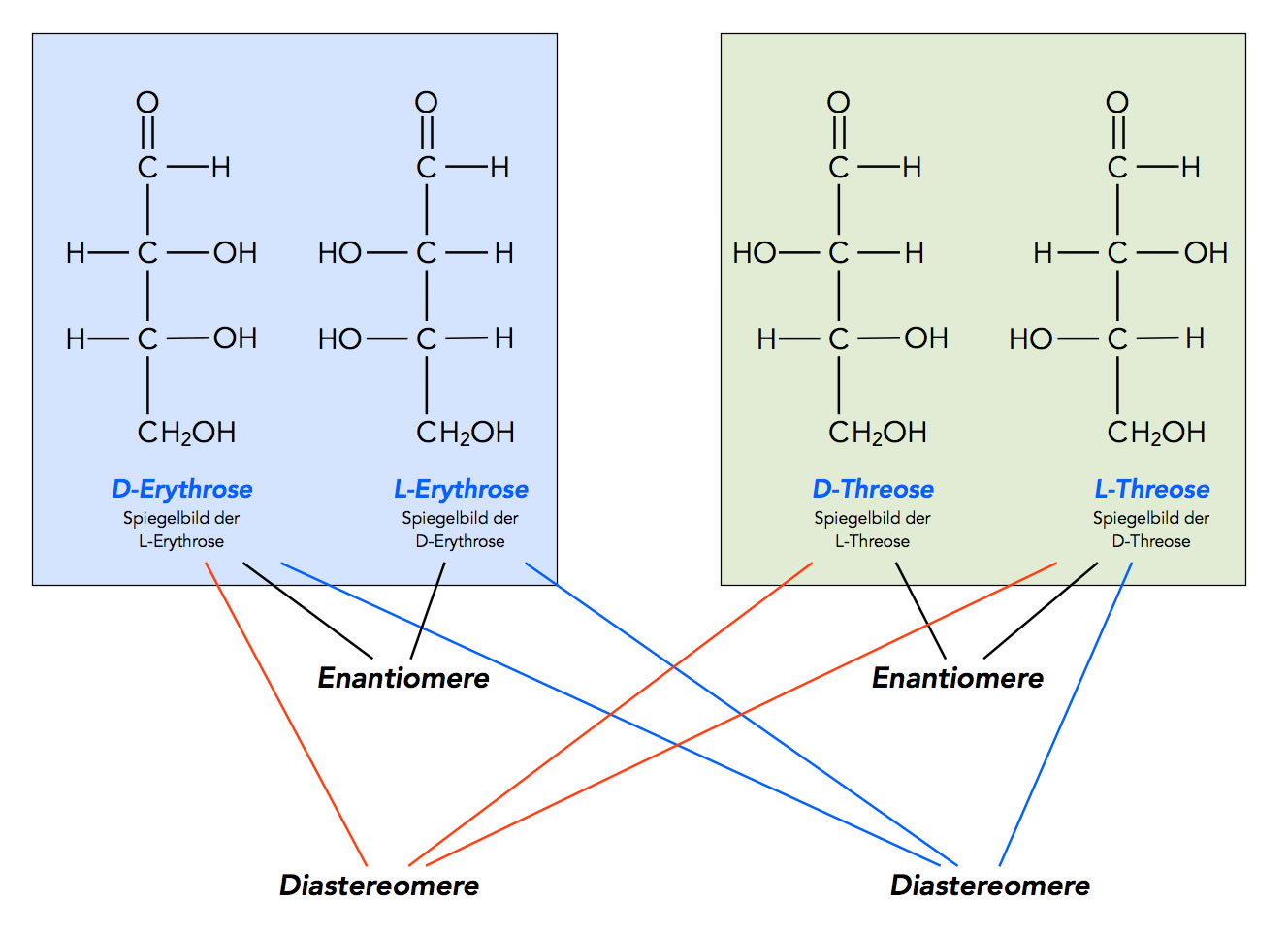
Enantiomere und Diastereomere der Aldotetrosen Erythrose und Threose
Autor: Ulrich Helmich 2021, Lizenz: Public domain
D-Erythrose und L-Erythrose verhalten sich wie Bild und Spiegelbild, sind also Enantiomere. Auch D-Threose und L-Threose sind Enantiomere.
D-Erythrose und D-Threose dagegen sind zwar Stereoisomere, verhalten sich aber nicht wie Bild und Spiegelbild, sind also Diastereomere. Das gilt auch für D-Erythrose und L-Threose.
Grundsätzlich werden ja alle Stereoisomere, die sich nicht wie Bild und Spiegelbild verhalten, als Diastereomere bezeichnet. Jede der oben abgebildeten vier Strukturen hat daher zwei Diastereomere und ein Enantiomer.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Diastereomer", aufgerufen am 5. April 2020.