Einfluss des Substrats beim SN2-Mechanismus
Betrachten wir unser bekanntes Beispiel für den SN2-Mechanismus, die Umsetzung von 2-Brombutan mit Iodid-Ionen als Nucleophil:
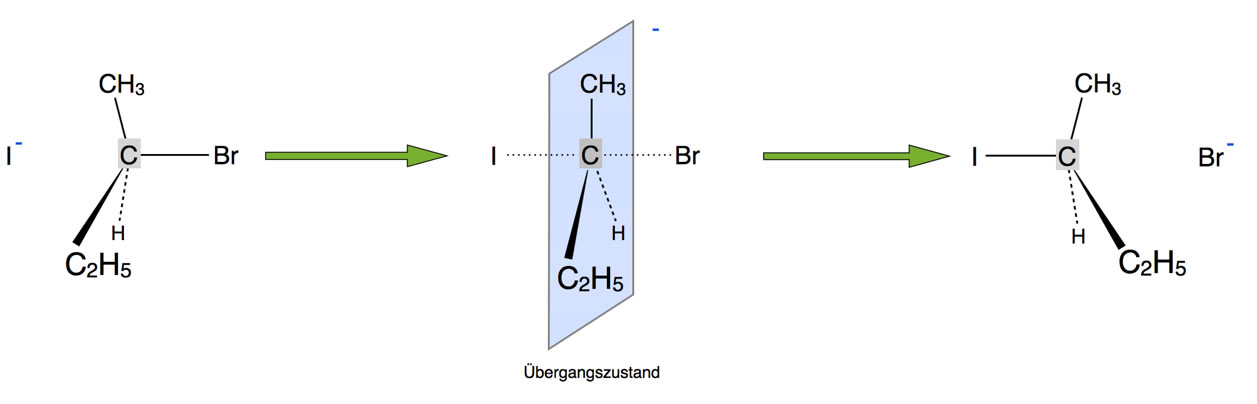
Bei der SN2-Reaktion "klappen" die Bindungen des zentralen C-Atoms um
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Man könnte nun argumentieren, dass das "Umklappen" der Raumstruktur während des Hybridisierungswechsels Energie erfordert und dass daher tertiäre Halogenalkane schlechter nach dem SN2-Mechanismus reagieren.
Leider ist diese Annahme etwas voreilig. Denn wie wir auf der Hauptseite zur Nucleophilen Substitution in Abschnitt 4.2.2.3 gesehen haben, vergrößert sich durch den Übergang zum sp2-Zustand der Abstand der Alkylgruppen, was energetisch recht günstig ist.
Viel wichtiger ist die sterische Hinderung, die durch große Substituenten verursacht wird. Je mehr und je größere Substituenten an dem zentralen C-Atom sitzen, desto schwieriger wird es für das Nucleophil, einen Rückseitenangriff durchzuführen.
Einfach gebaute Substrate R-X mit kleinen Alkylgruppen "bevorzugen" den SN2-Mechanismus.
Siehe dazu auch folgende Tabelle:
| Substrat | Geschwindigkeit der SN2 | Geschwindigkeit der SN1 |
| H3C-X | schnell | vernachlässigbar |
| R-CH2-X | schnell | langsam |
| R2-CH-X | gemäßigt | gemäßigt |
| R3C-X | langsam | schnell |
Primäre Halogenalkane reagieren also bevorzugt nach dem SN2-Mechanismus, tertiäre eher nach dem SN1-Mechanismus. Bei sekundären Halogenalkanen kommt es auch auf die anderen Einflussfaktoren an, welcher Mechanismus eingeschlagen wird.
Einfluss des Substrats beim SN1-Mechanismus
Welche Substrate werden nun eher nach den SN1-Mechanismus reagieren? Die obige Tabelle gibt die Antwort schon mehr oder weniger vor.
Hängt die Abgangsgruppe an einem sekundären C-Atom, konkurriert die SN1-Reaktion mit der SN2-Reaktion, beide Mechanismen laufen weder langsam noch schnell ab, und andere Faktoren spielen eine wichtige Rolle bei der Wahl des bevorzugten Mechanismus.
Es können auch beide Mechanismen gleichzeitig ablaufen, ein Teil des Substrats reagiert nach dem SN2-Mechanismus, ein anderer Teil nach dem SN1-Mechanismus.
Sitzt das Nucleofug an einem tertiären C-Atom, so verläuft die die SN2-Reaktion nur noch sehr langsam (sterische Hinderung durch die drei Reste), während die die SN1-Reaktion schnell erfolgt, was vor allem an der hohen Stabilität des tertiären Carbenium-Ions liegt.
Alkylgruppen üben einen positiven induktiven Effekt auf C-Atome aus, das hat verschiedene Gründe, die an anderer Stelle näher erläutert werden. Beim SN1-Mechanismus ist der erste und geschwindigkeitsbestimmende Schritt die Bildung eines Carbenium-Ions. Carbenium-Ionen sind instabil, da sie leeres pz-Orbital haben. Seitengruppen mit +I-Effekt stabilisieren aber ein Carbenium-Ion. Je mehr Seitengruppen, desto stärker der +I-Effekt und desto stabiler das Carbenium-Ion. Eine Verbindung, bei der drei große Alkylgruppen am zentralen C-Atom hängen, bildet also sehr leicht stabile tertiäre Carbenium-Ionen. Eine Verbindung wie Brommethan dagegen, wo das zentrale (und einzige) C-Atom nur mit drei H-Atomen verbunden ist, hat so gut wie gar keine Tendenz, ein Carbenium-Ion zu bilden. Brommethan wird daher nach einem SN2-Mechanismus reagieren.
Aufgabe
Entscheiden Sie, ob die folgende Verbindungung nach dem SN1- oder nach dem SN2-Mechanismus mit einem Nucleophil reagiert:

Die Strukturformel sieht so "schief" aus, weil die Bindungswinkel exakt berücksichtigt wurden.
Lösungsvorschlag:
Man würde natürlich zunächst davon ausgehen, dass diese Verbindung nach dem SN2-Mechanismus reagiert, weil das Brom-Atom ja an einem primären C-Atom sitzt.
Das ist aber nicht der Fall, die Verbindung reagiert nach dem SN1-Mechanismus. Wieso das der Fall ist, wird im folgenden Abschnitt erläutert.
Sonderfall Allylposition
Schauen wir uns das Carbenium-Ion an, dass sich im ersten Schritt bildet:

Ein Nucleofug in Allylstellung hinterlässt ein stabiles Carbenium-Ion
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Das Brom-Atom befindet sich in der sogenannten Allylstellung, es befindet sich also in direkter Nachbarschaft zu einer C=C-Doppelbindung.
Wird das Brom-Atom heterolytisch abgespalten, so entsteht ein Carbenium-Ion mit einer positiven Ladung an dem primären C-Atom.
Dieses positiv geladene C-Atom ist sp2-hybridisiert, genau wie die beiden benachbarten C-Atome der C=C-Doppelbindung.
Das heißt, die drei pz-Orbitale dieser drei sp2-hybridisierten C-Atome können überlappen, so dass die positive Ladung über diese drei C-Atome delokalisiert ist. Eine solche Delokalisierung stabilisiert das Carbenium-Ion enorm.
Aromatische Systeme
Einen ähnlichen Fall haben wir, wenn sich das Nucleofug an einem primären C-Atom befindet, das in unmittelbarer Nachbarschaft zu einem aromatischen System steht, beispielsweise einem Benzolring. Benzoylchlorid bzw. (Chlormethyl)benzol ist eine solche Verbindung.
Wenn sich durch Abspaltung des Nucleofugs ein Carbenium-Ion bildet, kann das pz-Orbital des primären C-Atoms mit den sechs pz-Orbitalen des Benzolrings überlappen. Die positive Ladung ist dann über sieben C-Atome delokalisiert.
Befindet sich die Abgangsgruppe in Allyl- oder Benzylstellung, so wird der SN1-Mechanismus bevorzugt.
Fassen wir nun alles noch einmal zusammen:
Abgangsgruppen an einem Methylrest oder einem primären C-Atom begünstigen den SN2-Mechanismus.
Abgangsgruppen an einem tertiären C-Atom begünstigen dagegen die SN1-Reaktion.
Bei Abgangsgruppen an einem sekundären C-Atom konkurrieren SN1- und SN2-Mechanismus. Dann hängt es weitgehend von anderen Faktoren ab, welcher Mechanismus hauptsächlich abläuft.
Eine Sonderrolle spielen Abgangsgruppen an primären C-Atomen in Allyl- oder Benzylstellung. Hier wird auch der SN1-Mechanismus bevorzugt.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schmuck, Basisbuch Organische Chemie, 2. Auflage, Pearson-Verlag 2018.
Seitenanfang -
Weiter mit dem Einfluss des Lösemittels...