Bei dem SN1-Mechanismus wird als Zwischenprodukt ein Carbenium-Ion gebildet. Alle Faktoren, die Carbenium-Ionen stabilisieren, erhöhen die Wahrscheinlichkeit für den SN1-Mechanismus. Ein sehr wichtiger Faktor ist die Polarität des Lösemittels.
Die Polarität des Lösemittels
Grundsätzlich unterscheidet man polare und unpolare Lösemittel. Die Teilchen der polaren Lösemittel sind permanente Dipole oder Moleküle, die Wasserstoffbrücken-Bindungen mit den gelösten Teilchen eingehen können. Musterbeispiele für polare Lösemittel sind Wasser und Ethanol.
Die Teilchen der unpolaren Lösemittel sind keine permanenten Dipole (höchstens extrem schwache), H-Brücken können sie natürlich auch nicht mit den gelösten Teilchen bilden. Hexan ist ein typisches unpolares Lösemittel.
Für den Ablauf einer nucleophilen Substitution ist ein polares Lösemittel empfehlenswert, denn Nucleophile sind selbst stark polar und lösen sich daher nicht in einem unpolaren Lösemittel wie Hexan. Auch die Carbenium-Ionen der SN1 und die pentavalenten Übergangszustände der SN2 werden durch polare Lösemittel besser stabilisiert als durch unpolare.
Protische polare Lösemittel
Eine besondere Klasse der polaren Lösemittel sind die protischen Lösemittel. Die Moleküle dieser Lösemittel sind Dipole (daher polar), können aber außerdem Protonen abgeben, sind also gleichzeitig Brönsted-Säuren. Wasser und Ethanol sind die bekanntesten protischen Lösemittel.
Beispiel Wasser/Ethanol
Wenn man Sie fragen würde, welches Nucleophil das Stärkere ist, das Fluorid-Anion oder das Iodid-Anion, dann werden die meisten von Ihnen mit Sicherheit antworten: "Natürlich das Fluorid-Anion". Diese Antwort klingt ja auch logisch, denn Fluor ist eine äußerst aggressive Substanz, die sich sogar durch Glasgefäße durchätzt, während Iod so harmlos ist, dass man es in Wundsalben verwendet.
Jetzt kommt aber eine große Überraschung: Führt man eine nucleophile Substitution in Wasser oder Ethanol als Lösemittel durch, ist das Iodid-Ion ein viel stärkeres Nucleophil als das Fluorid-Ion. Experimentell hat man für protische Lösemittel folgende Reihenfolge der Nucleophilie ermittelt:
I- > Br- > Cl- > F-
Wie kann das denn sein? Um dieses überraschende Ergebnis zu verstehen, muss man sich mit dem Begriff der Ladungsdichte vertraut machen. Dazu bleiben wir bei dem Vergleich F- mit I-, also Fluorid mit Iodid.
Beide Ionen haben eine Ladung von -1. Das Fluorid-Ion ist aber viel kleiner als das Iodid-Ion. Die negative Ladung verteilt sich beim Fluorid-Ion daher auf ein viel kleineres Volumen als beim Iodid-Ion, die Ladungsdichte ist beim Fluorid-Ion somit viel höher als beim Iodid-Ion.
Deswegen ist auch die Solvathülle des Fluorid-Ions deutlich größer als die des Iodid-Ions; die Zahl der umhüllenden Teilchen steigt nämlich mit der Ladungsdichte an.
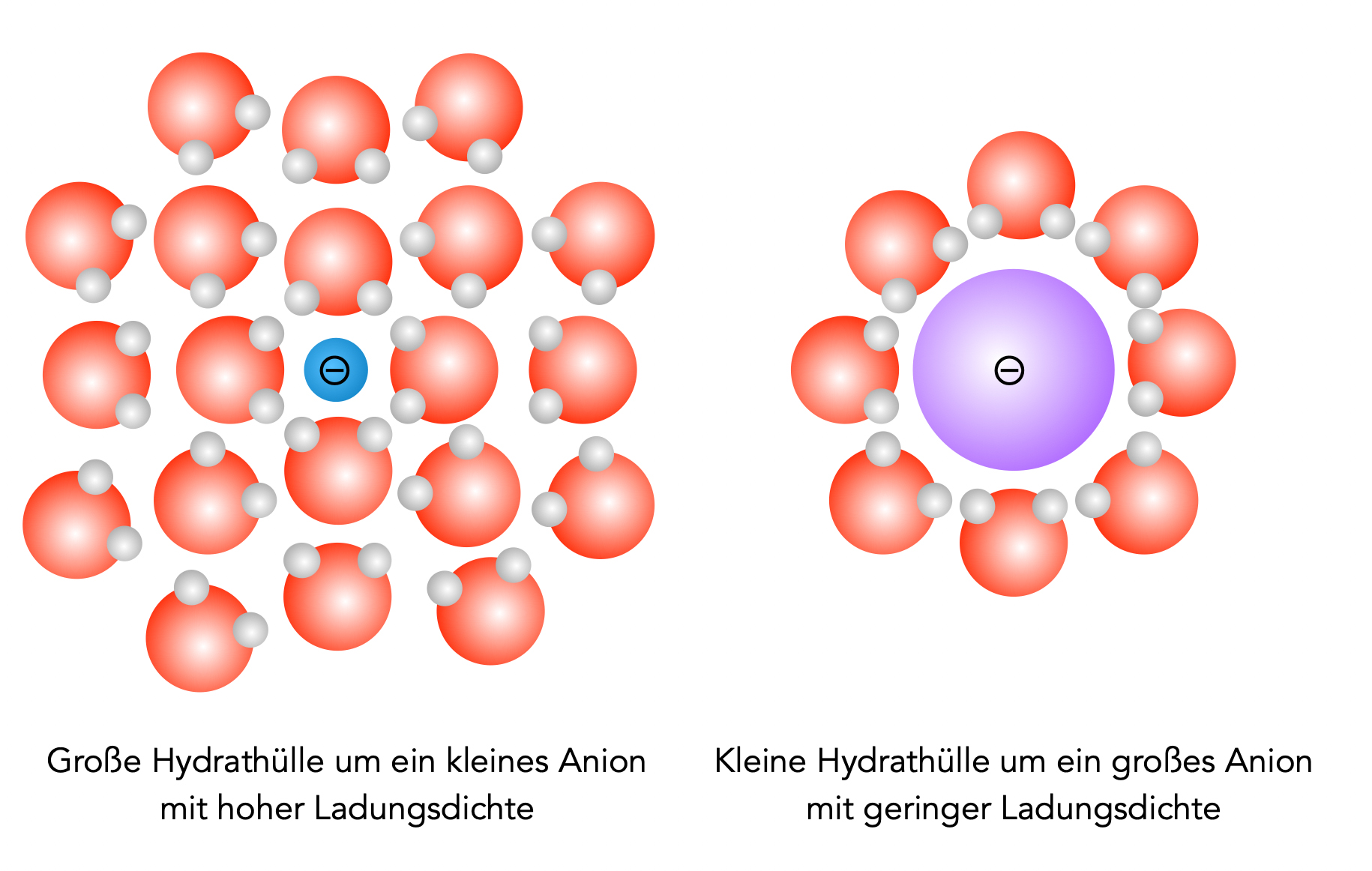
Hydrathüllen um kleine und große Anionen
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Diese große und relativ fest gebundene Solvathülle des Fluorid-Ions ist aber nun ein Hindernis, wenn es um die nucleophile Substitution geht. Das Fluorid-Ion kommt kaum an das organische Substrat heran, wenn es mit einer so mächtigen Solvathülle umgeben ist.

Ein schwach solvatisiertes Nucleophil kann leichter angreifen als ein stark solvatisiertes
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Die Solvathülle des Iodid-Ions ist viel kleiner und kann leichter "abgestreift" werden. Die Chance, dass ein "nacktes" (also nicht-solvatisiertes) Iod-Ion das Nucleofug aus dem Substrat verdrängen kann, ist dadurch also sehr groß. Iodid-Ionen sind daher viel stärkere Nucleophile als Fluorid-Ionen - jedenfalls in einem polaren Lösemittel, das die Nucleophile solvatisieren kann.
Aprotische polare Lösemittel
Nach dem, was in vorherigen Abschnitt gesagt wurde, kann man jetzt schlussfolgern, wie die Substitution in einem aprotischen und nur schwach polaren Lösemittel abläuft, das nicht in der Lage ist, eine starke Solvathülle um das Nucleophil zu bilden. Die Chance, dass das Nucleophil "nackt" vorliegt, ist sehr viel größer als in einem protischen polaren Lösemittel wie Wasser oder Ethanol. Ein solches "nacktes" Nucleophil kann das organische Substrat viel effektiver angreifen als ein solvatisiertes Nucleophil, daher begünstigen aprotische Lösemittel die SN2-Reaktion. Allerdings muss das aprotische Lösemittel immer noch polar sein. In einem unpolaren Lösemittel wie Hexan läuft weder die SN1 noch die SN2 mit merklicher Geschwindigkeit ab.
Betrachten wir nun die beiden aprotischen und polaren Lösemittel Aceton und Dimethylsulfoxid (DMSO).
Beispiel Aceton / DMSO
DMSO ist die Abkürzung für Dimethylsulfoxid, ein organisches Lösemittel. Die Struktur von DMSO ist fast die gleiche wie die von Aceton, nur ist hier das mittlere C-Atom gegen ein Schwefel-Atom ausgetauscht. Beide Verbindungen besitzen zwar H-Atome an den Methylgruppen, können diese H-Atome jedoch nicht als Protonen abgeben.

Veranschaulichung der DMSO-Wirkung: links solvatisiertes Na+-Ion, rechts: "nacktes" Br--Ion.
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Bei Aceton und DMSO ist der Minuspol exponiert (also frei zugänglich), während der Pluspol durch die beiden Methylgruppen sterisch behindert ist. Das O-Atom dieser Moleküle ist relativ frei zugänglich, kann also mit positiven Ionen wie Na+ oder K+ wechselwirken und eine Solvathülle bilden. Das positiv polarisierte C- bzw. S-Atom der Moleküle kann wegen der beiden Methylgruppen dagegen nicht mit Anionen wechselwirken. Diese liegen dann "nackt" in dem Lösemittel vor.
Aus diesem Grund besitzen anionischen Nucleophile wie Bromid keine Solvathülle, die bei der nucleophilen Substitution "abgestreift" werden müsste. Daher sind solche anionischen Nucleophile in aprotischen Lösemitteln viel stärker nucleophil als in protischen Lösemitteln.
Bei den Halogeniden kehrt sich in einem aprotischen Lösemittel die Reaktivitäts-Reihenfolge gänzlich um:
F- >Cl- > Br- > I-
Mehr zu diesem Thema finden Sie auf dieser Lexikon-Seite.
Vergleich von vier Lösemitteln
Reinhard Brückner vergleicht in seinem Buch "Reaktionsmechanismen" [8] die Reaktion von Iodmethan mit Chlorid-Ionen in vier verschiedenen Lösemitteln.
Die Umsetzung wurde zunächst im Lösemittel Methanol durchgeführt. Die gemessene Reaktionsgeschwindigkeit wurde willkürlich auf 1 gesetzt (relative Reaktionsgeschwindigkeit).
Dann wurde die gleiche Reaktion in drei anderen Lösemitteln durchgeführt:
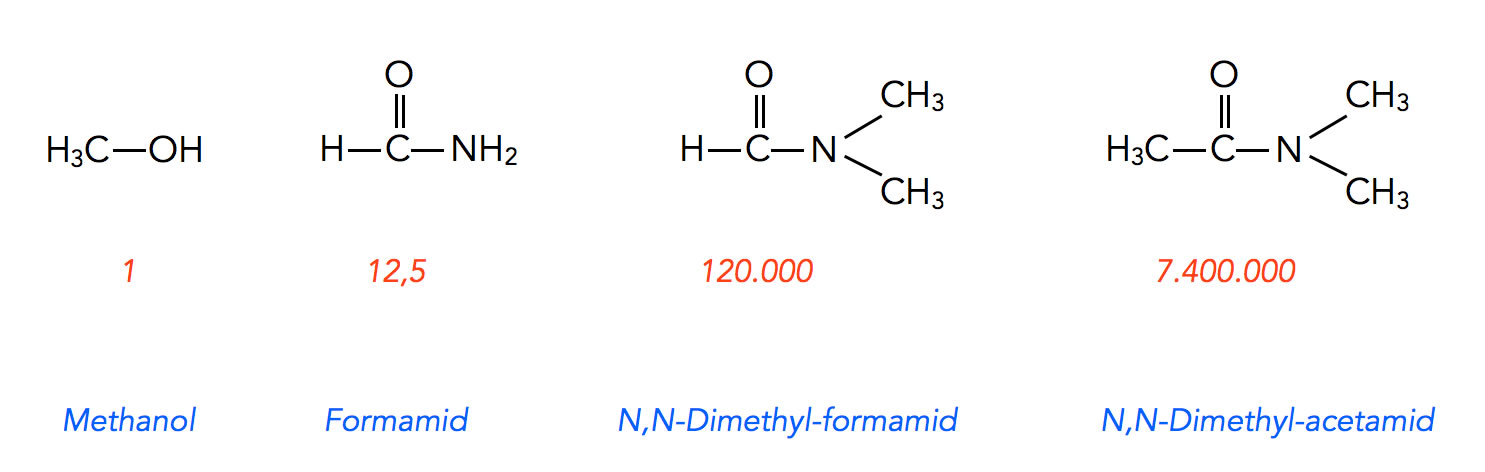
Reaktionsgeschwindigkeit in vier Lösemitteln nach Brückner
Autor: Ulrich Helmich 2022, Lizenz: Public domain
In Formamid, einem protischen Lösemittel, lief die Reaktion 12,5 mal so schnell ab wie in Methanol. In N,N-Dimethyl-formamid steigerte sich die Geschwindigkeit auf das 120.000fache, und in N,N-Dimethyl-acetamid mit nur einer CH3-Gruppe mehr betrug die relative Geschwindigkeit sogar das 7.400.000fache. Die Zahlen beziehen sich übrigens nicht direkt auf die gemessene Reaktionsgeschwindigkeit, sondern auf die Geschwindigkeitskonstanten.
Der Grund für diese Geschwindigkeitssteigerung ist wieder die Tatsache, dass die komplexer aufgebauten Lösemittel wie N,N-Dimethyl-formamid und N,N-Dimethyl-acetamid die positiv polarisierten C-Atome sterisch abschirmen, so dass - ähnlich wie bei Aceton oder DMSO - Anionen nicht solvatisiert werden können und daher frei vorliegen. Die freien Anionen sind dann viel stärkere Nucleophile als solvatisierte Anionen.
Kronenether als Phasentransfer-Katalysatoren
Nach dem, was wir eben gesehen haben müsste man den Nucleophilie verstärkenden Effekt von aprotischen Lösemitteln wie Aceton oder DMSO doch noch weiter steigern können, indem man ein völlig unpolares Lösemittel wie zum Beispiel Hexan verwendet. Dann würden die anionischen Nucleophile komplett ohne Solvathülle vorliegen.
Eine gute Idee, doch dummerweise lösen sich Salze wie Kaliumbromid oder Kaliumfluorid in unpolaren aprotischen Lösemitteln wie Hexan nicht im Geringsten. Wie will man solche Salze dann zur Reaktion mit einem organischen Substrat bringen?
Hier haben sich die sogenannten Kronenether bewährt. Ein bekannter Kronenether hat folgende Struktur:
![Strukturformel des Kronenethers [18]-Krone-6](../../../Sek2/Organik/Mechanismen/SN/Bilder/kronenether-18-6.jpg)
Strukturformel des Kronenethers [18]-Krone-6
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Kationen mit der richtigen Größe können von einem solchen Ringmolekül komplett eingeschlossen werden. Man bezeichnet den Kronenether dann als "Wirt" für das Kation. Der Kronenether [18]Krone-6 hat einen Innenraum, der etwas größer ist als ein Kalium-Ion. Er wird in der organischen Synthese daher verwendet, um Kalium-Ionen zu transportieren. Das sieht dann ungefähr so aus:
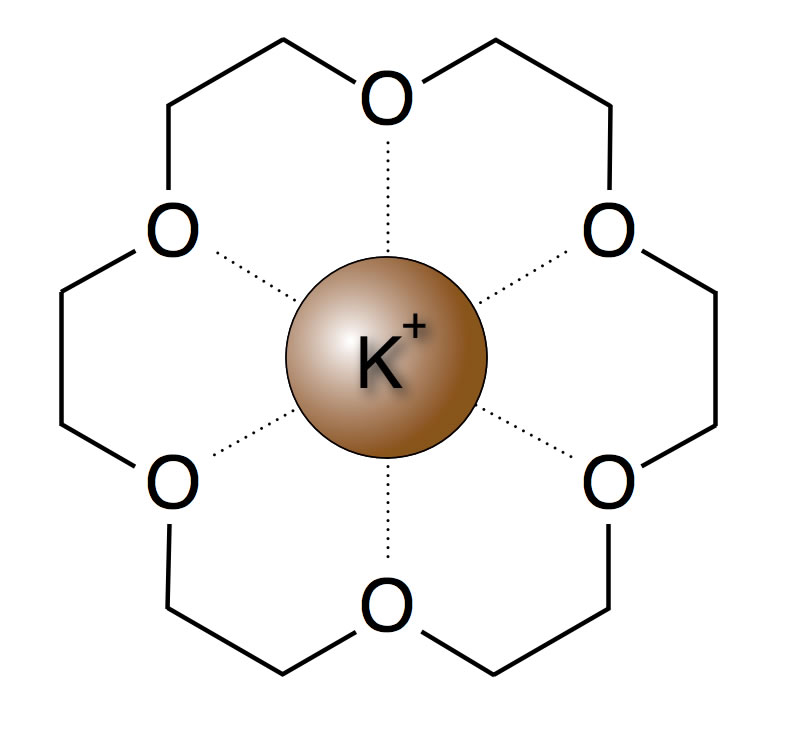
Ein Kronenether mit einem eingeschlossenem Kalium-Ion
Autor: Ulrich Helmich 2020, Lizenz: Public domain.
Welchen Vorteil bieten solche Kronenether nun für die nucleophile Substitution?
Beim Lösungsvorgang müssen Salze in ihre Ionen dissoziieren. In einem protischen Lösemittel ist das meistens kein Problem. Zwar muss die Anziehungskraft zwischen Anion und Kation überwunden werden, was einen gewissen Energiebetrag kostet. Andererseits bilden beide Ionen eine Solvathülle, im Lösemittel Wasser zum Beispiel eine Hydrathülle. Dabei werden viele neue Bindungen gebildet, und so wird ein recht hoher Energiebetrag freigesetzt. Meistens ist diese Solvationsenergie (im Falle von Wasser: Hydrationsenergie) größer als die zur Dissoziation aufgewandte Energie.
In apolaren Lösemitteln bilden sich keine Solvathüllen um die Ionen, daher zeigen die Ionen keinerlei Neigung, sich zu trennen. Warum auch?
Gibt man nun einen Kronenether zu diesem apolaren Lösemittel (der [18]Krone-6-Ether selbst ist bei Zimmertemperatur ein Feststoff), so nehmen die Moleküle des Kronenethers die Kationen auf, weil sich die negativ polarisierten O-Atome des Ethers innen befinden.
Was passiert dann mit den Anionen des Salzes? Die Anionen haben keinen Bindungspartner mehr und schwirren frei in dem organischen Lösemittel herum. Eine Solvathülle bilden sie zwar nicht, aber sie können sich frei bewegen und dann auch organische Verbindungen angreifen.
Gibt man Kaliumfluorid zu einem Gemisch aus Hexan und Kronenether, so kann eine nucleophile Substitution sehr leicht ablaufen, das Fluorid-Ion verdrängt dann die nucleofuge Gruppe aus dem organischen Substrat.
Ich habe mir mal die Mühe gemacht, ein Bild zu zeichnen, wie ich mir ein solches Lösemittel (Hexan) mit einem Kronenether, Kaliumfluorid und einem organischen Substrat (1-Brom-Butan) vorstelle:
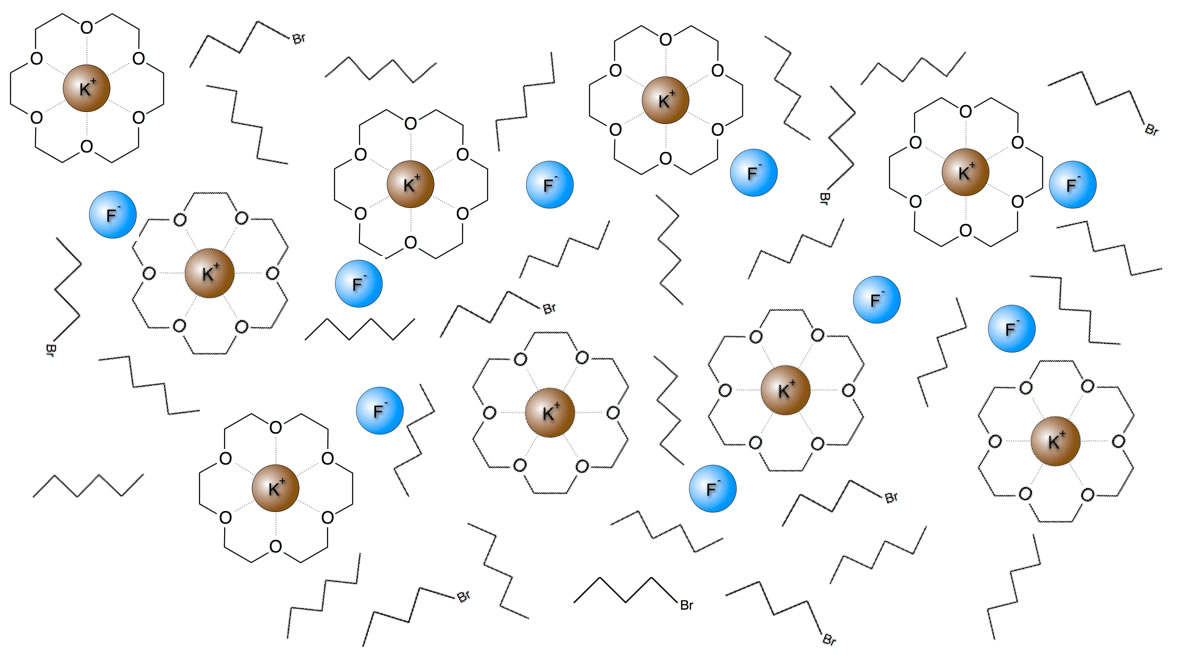
Stoffgemisch wie im Text beschrieben
Autor: Ulrich Helmich 2017, Lizenz: Public domain.
Ich hoffe, ich habe die Zeichnung einigermaßen korrekt angefertigt.
Kronenether fungieren hier als sogenannte Phasentransfer-Katalysatoren, weil sie den Phasenübergang des Kaliumfluorids von der festen Phase in die flüssige bzw. gelöste Phase katalysieren. Der Kronenether selbst nimmt nicht an der Reaktion teil, beschleunigt diese aber erheblich, deshalb kann er als Katalysator angesehen werden.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Schmuck, Basisbuch Organische Chemie, 2. Auflage, Pearson-Verlag 2018.
- Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
Seitenanfang -
Weiter mit dem Einfluss des Nucleophils...