Dipeptide
Bei der Proteinbiosynthese werden an den Ribosomen der Zelle ständig neue Peptide und Proteine erzeugt. Dazu müssen die einzelnen Aminosäuren miteinander verknüpft werden. Wie dies im Einzelnen geschieht, wollen wir uns zunächst an einem ganz einfachen Beispiel anschauen, der Bildung eines Dipeptids:
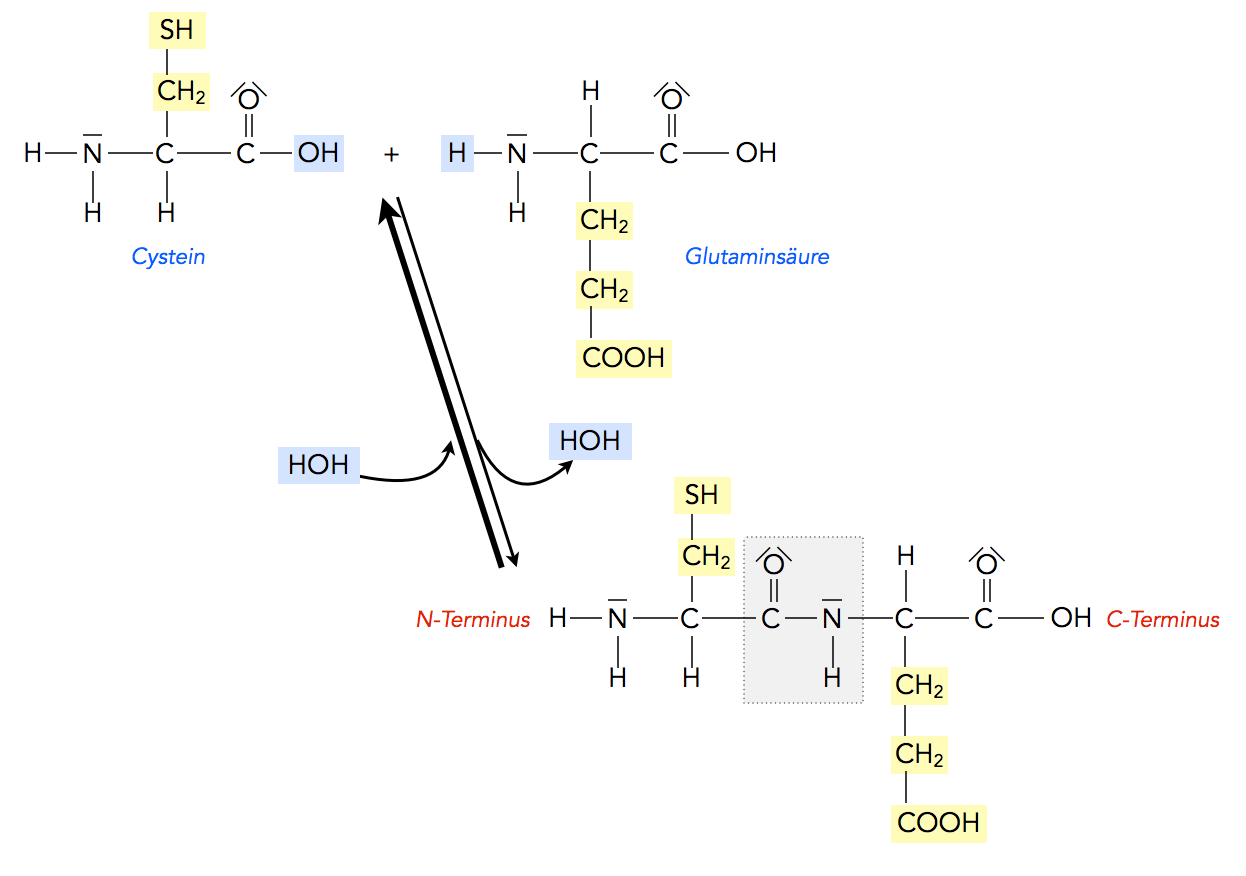
Die Bildung eines Dipeptids als Kondensationsreaktion
Autor: Ulrich Helmich, Lizenz: Public domain
Die Carboxygruppe der einen Aminosäure gibt ihre OH-Gruppe ab, die Aminogruppe der anderen Aminosäure ein H-Atom der Aminogruppe. Dabei entsteht ein Wasser-Molekül, das Hauptprodukt aber ist ein sogenanntes Dipeptid, eine aus zwei Aminosäure-Resten zusammengesetzte Verbindung. Das Dipeptid in der Abbildung 1 besteht übrigens aus den Aminosäuren Cystein und Glutaminsäure. Da bei dieser Reaktion Wasser freigesetzt wird, gehört die Peptidbildung chemisch betrachtet zu der Gruppe der Kondensationsreaktionen.
Merke:
Die Bildung eines Dipeptids ist eine Kondensationsreaktion, weil sich zwei Aminosäuren unter Abgabe eines Wasser-Moleküls zu einem Dipeptid vereinigen.
Für Chemie-Profis
Chemisch gesehen handelt es sich bei dieser Reaktion um eine nucleophile Substitution. Die eine Aminosäure greift mit ihrer NH2-Gruppe die Carboxygruppe der anderen Aminosäure nucleophil an. Die OH-Gruppe der Carboxygruppe ist dann das Nucleofug (die Abgangsgruppe). Da eine Hydroxygruppe eine schlechte Abgangsgruppe ist, liegt das chemische Gleichgewicht dieser Reaktion weit auf der linken Seite, und die gesamte Reaktion ist endotherm. Dipeptide entstehen also nicht unbedingt von selbst und spontan. Bei der Peptidbildung in der Zelle während der Proteinbiosynthese müssen die beiden funktionellen Gruppen, also die Carboxygruppe der einen Aminosäure und die Aminogruppe der anderen Aminosäure erst durch Enzyme und Coenzyme aktiviert werden, damit die Kondensation überhaupt stattfinden kann.
Die Umkehrreaktion der Peptidbildung ist die Peptid-Hydrolyse. Mit Hilfe eines Wasser-Moleküls wird die Peptidbindung gespalten. Dieser Vorgang ist zwar exotherm, hat aber eine recht hohe Aktivierungsenergie. Der Grund für die hohe Aktivierungsenergie ist die Stabilisierung der Peptidbindung durch Mesomerie (siehe nächsten Abschnitt).
Wir müssen daher keine Sorge haben, dass unsere körpereigenen Peptide und Proteine von selbst in Aminosäuren zerfallen. Tatsächlich ist die Peptidbindung sogar eine der stabilsten chemischen Bindungen innerhalb von Biomolekülen überhaupt. Die durchschnittliche Halbwertszeit einer Peptidbindung unter physiologischen Bedingungen beträgt ca. 7 Jahre [7].
Die Hydrolyse von Peptiden und Proteinen tritt bei der Verdauung von proteinhaltigen Lebensmitteln alltäglich auf. Die hohe Aktivierungsenergie der Hydrolyse wird durch Enzyme wie Pepsin oder Trypsin und einen entsprechenden pH-Wert herabgesetzt, so dass die Hydrolyse binnen Minuten erfolgen kann.
Die Peptidbindung
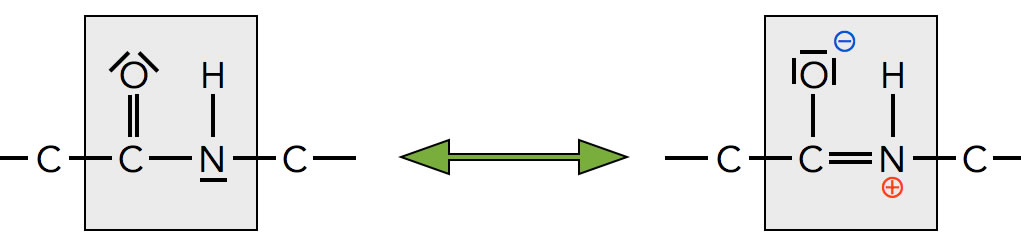
Die Peptidbindung ist mesomeriestabilisiert
Autor: Ulrich Helmich, Lizenz: Public domain
In der Abbildung 2 sehen wir grau unterlegt die sogenannte Peptidbindung. Die Peptidbindung hat eine starre Struktur, alle vier Atome der Peptidbindung liegen in einer Ebene und können nicht gegeneinander verdreht werden. Das sieht man auch gut an dem Molekülmodell oben rechts in der nächsten Abbildung.
Auf den ersten Blick könnte man denken, dass die Bindung zwischen dem C-Atom der Carbonylgruppe und dem N-Atom eine normale Einfachbindung ist, die eine freie Drehbarkeit gewährleistet. Wie man in der rechten Hälfte des Bildes jedoch sehen kann, gibt es eine Grenzstruktur der Peptidbindung, bei der eine Doppelbindung zwischen dem C-Atom und dem N-Atom besteht, welche die freie Drehbarkeit behindert.
Die C-N-Bindung ist also keine normale Einfachbindung, aber auch keine Doppelbindung, sondern irgendetwas dazwischen. Das sieht man auch an den Bindungslängen, wie die folgende Abbildung zeigt:
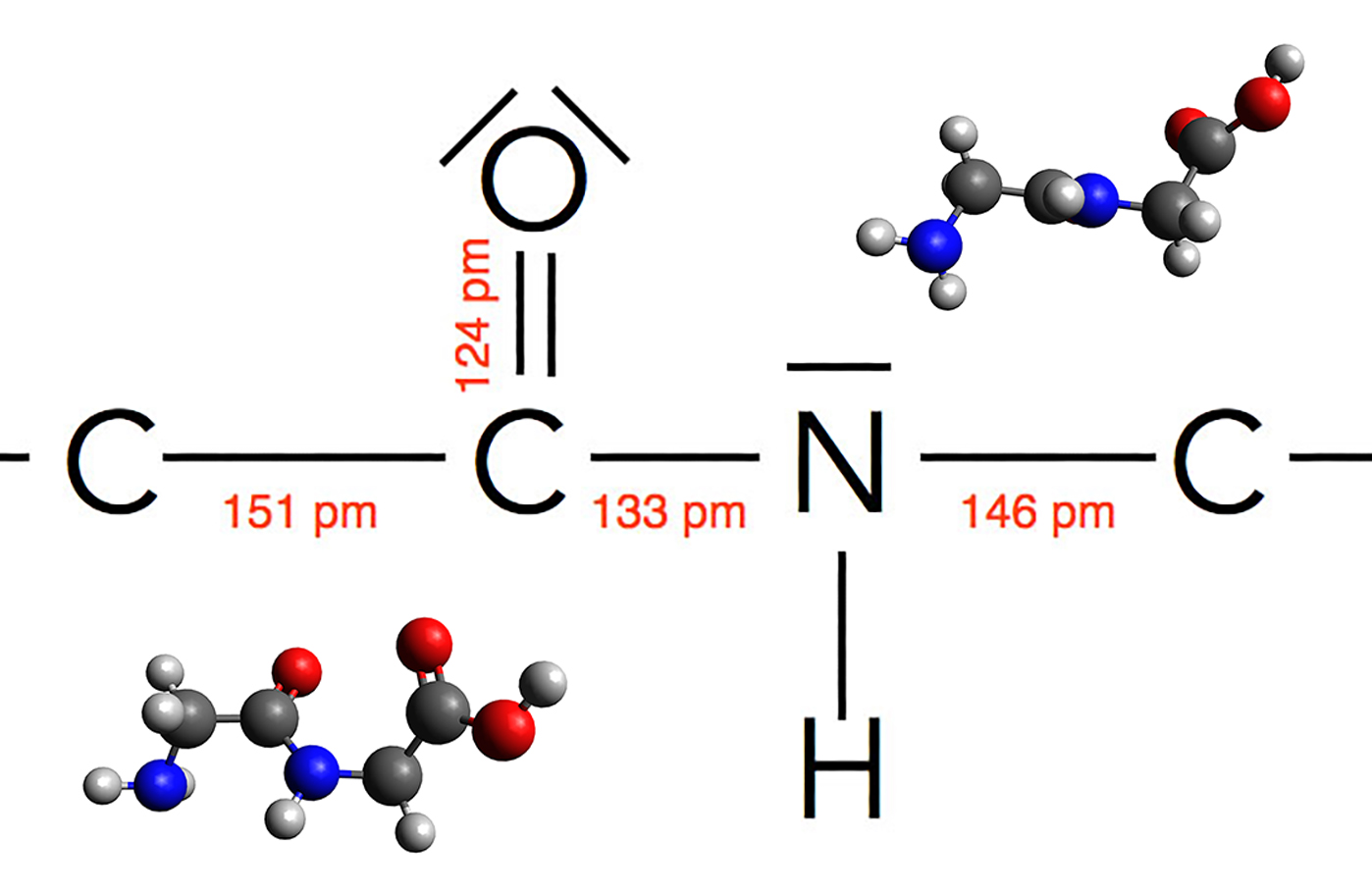
Struktur der Peptidbindung / Molekülmodelle des Dipeptids Gly-Gly.
Autor: Ulrich Helmich 02/2024, Lizenz: Public domain
Vergleichen wir die C-C-Einfachbindung, die C=O-Doppelbindung und die C-N-Bindung. Dann fällt uns auf, dass die Länge der C-N-Bindung ziemlich genau zwischen der Länge einer Doppelbindung und der Länge einer Einfachbindung liegt.
Bindungslängen innerhalb der Peptide
| Lehninger | Stryer | Wikipedia | |
| C-C | 153 | 151 pm | 151 pm |
| C-N | 132 | 132 pm | 133 pm |
| N-C | 146 | 145 pm | 146 pm |
| C=O | 124 | 124 pm | 124 pm |
Hier sieht man die Bildunglängen innerhalb der Peptidbindung, zusammengetragen aus drei verschiedenen Quellen.
Für Chemie-Profis
Die drei Atome C, O und N der Peptidbindung sind sp2-hybridisiert, und die pz-Orbitale überlappen sich, so dass die pi-Elektronen über die drei Atome delokalisiert sind. Wegen der Überlappung der pz-Orbitale ist die C-N-Bindung auch nicht frei drehbar, sondern fixiert.
Die C-C-Einfachbindung in dem Peptid ist auch etwas kürzer als eine normale C-C-Einfachbindung, 151 pm statt wie üblich 154 pm. Das liegt natürlich daran dass das C-Atom der Carbonylgruppe sp2-hybridisiert ist. Die sp2-Hybridorbitale sind kleiner als sp3-Hybridorbitale, daher ist die Bindung auch etwas kürzer. Auch die N-C-Bindung ist kürzer als eine normale N-C-Bindung, weil das N-Atom ebenfalls sp2-hybridisiert ist.
Merke:
Die Peptidbindung besteht aus einer C=O-Gruppe, die mit einer N-H-Gruppe verbunden ist. Alle vier Atome liegen in einer Ebene.
Oligo- und Polypeptide
Nach dem gleichen Schema, wie wir es im oberen Abschnitt gesehen haben, können sich auch mehr als zwei Aminosäuren zu einem Peptid zusammentun. Ein Tripeptid besteht zum Beispiel aus drei Aminosäuren, ein Tetrapeptid aus deren vier. Allgemein bezeichnet man Peptide mit maximal zehn Aminosäuren als Oligopeptide. Peptide, die aus bis zu 100 Aminosäuren bestehen, werden als Polypeptide bezeichnet, und Peptide mit mehr als 100 Aminosäuren heißen Proteine oder Eiweiße.
Merke:
Oligopeptide = Peptide, die aus 2 - 10 Aminosäuren bestehen.Polypeptide = Peptide, die aus 11 - 100 Aminosäuren bestehen.
Proteine = Peptide, die aus mehr als 100 Aminosäuren bestehen.
Auf dem folgenden Bild sehen wir ein Tetrapeptid aus den Aminosäuren Glycin, Alanin, Cystein und Glutaminsäure:
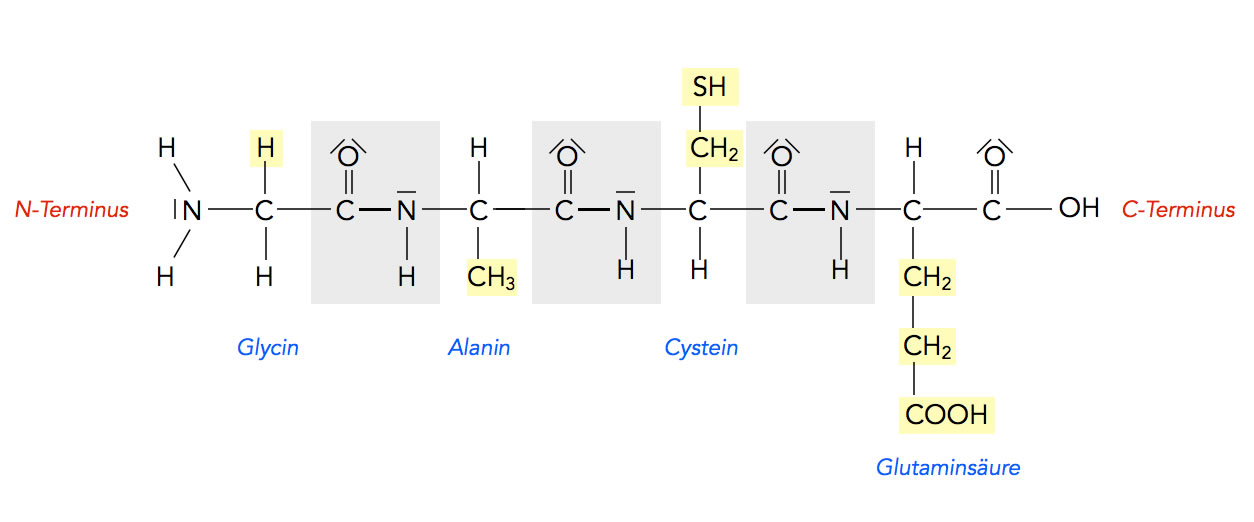
Text
Autor: Ulrich Helmich, Lizenz: Public domain
Die drei Peptidbindungen sind grau hinterlegt. Außerdem sind der N-Terminus und der C-Terminus gekennzeichnet. Das Tetrapeptid beginnt am N-Terminus. Das ist die Aminosäure am "linken" Ende des Peptids, die noch über eine intakte NH2-Gruppe verfügt. Das Peptid endet am C-Terminus, also an der Aminosäure am "rechten" Ende des Peptids, die noch über eine intakte COOH-Gruppe verfügt. Damit man Peptide und Proteine einheitlich beschreiben kann, hat man darauf geeinigt, dass das Amino-Ende als Anfang des Peptids angesehen wird und das Carboxy-Ende als Schluss.
Beispiele für Oligopeptide
Aminosäuren müssen nicht stets lange Proteine bilden, um biologisch aktiv zu sein. Es gibt auch zahlreiche Di-, Tri- und allgemein Oligopeptide, die wichtige Aufgaben im Körper erfüllen. Als Beispiel sei hier das Carnosin genannt, ein Dipeptid aus Alanin und Histidin, das in erhöhten Konzentrationen im Muskel- und Gehirngewebe vorkommt [4].

Das Aspartam-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain
Aspartam ist ein synthetischer Süßstoff, der aus den Aminosäuren Asparaginsäure und Phenylalanin besteht. Die COOH-Gruppe am C-Terminus ist dann mit Methylalkohol verestert. Daher lautet die korrekte Bezeichnung dieses modifizierten Dipeptids L-Aspartyl-L-phenylalanin-methylester [7,8].
Ein ganz bekanntes Tripeptid ist Glutathion, das aus Glutaminsäure, Cystein und Glycin besteht.

Das Glutathion-Molekül
Autor: Ulrich Helmich, Lizenz: Public domain
Glutathion kommt fast in allen Zellen vor und wirkt als Antioxidans und ist außerdem ein Cystein-Speicher [5]. Das Problem bei Cystein ist nämlich folgendes: Cystein wird ständig gebraucht bei der Synthese neuer Proteine, aber Cystein selbst ist eine hochreaktive Substanz, die schnell alle möglichen Reaktionen eingeht. In Glutathion gespeichert, ist das Cystein jedoch über einen längeren Zeitraum haltbar.
Opiorphin ist ein Pentapeptid (Gln-Arg-Phe-Ser-Arg) mit schmerzstillender Wirkung, was noch untertrieben ist, denn Versuche an Ratten zeigten, dass Opiorphin eine 3 bis 6 mal höhere schmerzstillende Wirkung hat als Morphin [6].
Es gibt unzählige weitere Oligopeptide, die in unseren Zellen vorkommen, als Medikamente eingesetzt werden oder von Pflanzen oder Pilzen als Abwehrstoffe verwendet werden. Zahlreiche Informationen finden sich in der Wikipedia unter den Stichworten "Tetrapeptid", "Pentapeptid" und so weiter.
Oxytocin, das "Kuschelhormon", besteht aus neun Aminosäuren [9] und ist somit ein Nonapeptid.
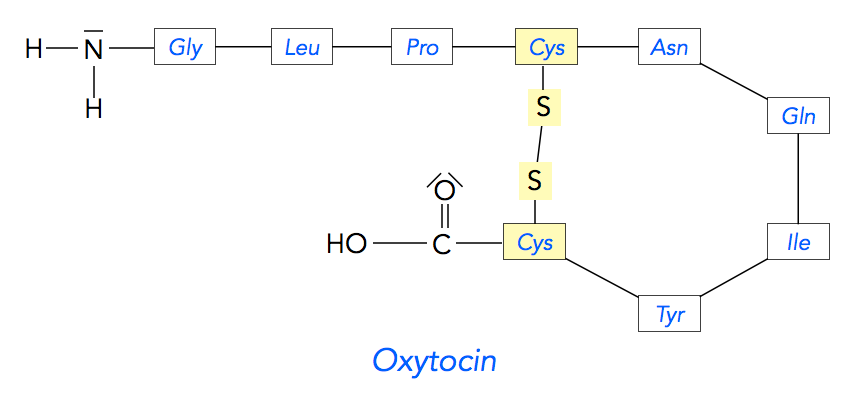
Oxytocin
Autor: Ulrich Helmich, Lizenz: Public domain
Oxytocin ist ein im Gehirn produziertes Hormon, das Wehen auslöst und die Brustdrüsen zur Abgabe von Milch anregt. Als "Kuschelhormon" wird es bezeichnet, weil es auch das Verhalten zwischen Mutter und Kind sowie zwischen den Partnern positiv beeinflusst [9]. Man achte darauf, dass Oxytocin zwei Cystein-Reste enthält, die eine Disulfidbrücke bilden und das Nonapeptid so stabilisieren.
Polypeptide und Proteine
Die Grenze zwischen Polypeptiden und Proteinen ist nicht ganz scharf umrissen. In den meisten Schulbüchern findet man die Angabe von 100 Aminosäuren als Grenze. Polypeptide bestehen demnach aus bis zu 100 Aminosäuren, Proteine haben mehr als 100 Aminosäuren.
Wie wir bereits oben gesehen haben, gibt es viele Oligopeptide mit biologischen Funktionen. Auch Polypeptide haben wichtige biologische Funktionen, und Proteine sowieso, nicht nur als Enzyme, sondern auch als Hormone, Signalstoffe, Rezeptoren, Antikörper etc.
Die meisten Proteine umfassen weniger als 2.000 Aminosäuren [7], das bisher längste bekannte Protein ist das Titin, das im Wirbeltiermuskel vorkommt. Ein Titin-Molekül ist ein Protein aus ca. 27.000 Aminosäuren laut Lehninger [7] bzw. aus 34.000 Aminosäuren laut Wikipedia [10].
Peptide und Proteine mit prosthetischen Gruppen
Es gibt eine ganze Reihe wichtiger Peptide und Proteine, die neben den Aminosäuren weitere chemische Komponenten enthalten. Solche chemischen Bausteine, die nicht aus Aminosäuren bestehen und permanenter Bestandteil eines Proteins sind, werden als prosthetische Gruppen bezeichnet. Proteine mit solchen prosthetischen Gruppen bekommen dann spezielle Bezeichnungen.
- Glycoproteine: Proteine mit einem kurzen Kohlenhydrat als prosthetische Gruppe
- Lipoproteine: diese Proteine sind mit einem Lipid-Molekül verbunden
- Phosphoproteine: die prothetische Gruppe ist hier ein Phosphat-Rest
- Hämoproteine: das Protein ist mit einer Häm-Gruppe verbunden, das bekannteste Beispiel ist das Hämoglobin.
- Flavoproteine: das Protein ist mit einer FAD- oder FMN-Einheit verbunden.
- Metalloproteine: das Protein enthält ein oder mehrere Metall-Atome oder -Ionen.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia, Artikel "Peptidbindung"
- Alberts, Bruce et al. Molekularbiologie der Zelle, 6. Auflage, Weinheim 2017.
- Wikipedia, Artikel "L-Carnosin".
- Wikipedia, Artikel "Glutathion"
- Wikipedia, Artikel "Opiorphin"
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Wikipedia, Artikel "Aspartam"
- Wikipedia, Artikel "Oxytocin"
- Wikipedia, Artikel "Titin"
Seitenanfang -
Weiter mit der Primärstruktur...