Wir haben jetzt drei verschiedene Arten von intramolekularen starken chemischen Bindungen kennengelernt: die Ionenbindung, die Elektronenpaarbindung und die metallische Bindung. Diese chemischen Bindungen gehören zu den sogenannten starken chemischen Bindungen. Neben diesen starken Bindungen gibt es aber auch eine Reihe sogenannter schwacher chemischer Bindungen. Mit diesen schwachen chemischen Bindungen wollen wir uns auf dieser Seite beschäftigen.
Van-der-Waals-Wechselwirkungen
Als van-der-Waals-Wechselwirkungen, -Kräfte oder -Bindungen werden drei verschiedene Bindungsarten zwischen Molekülen bezeichnet. Man spricht auch von zwischenmolekularen oder intermolekularen Bindungen.
Drei Arten von Molekülen
Zum besseren Verständnis betrachten wir zunächst einmal drei verschiedene Arten von Molekülen:
Unpolare Moleküle
Hierzu gehören die Moleküle der Alkane oder Alkene, außerdem Nichtmetall-Moleküle wie Sauerstoff O2, Stickstoff N2 oder Chlor Cl2. Solche Moleküle haben keinen oder so gut wie keinen Dipol-Charakter.
Polare Moleküle
Die Moleküle von Aceton oder Chlormethan besitzen elektronegative O- oder Cl-Atome. Die Bindungen innerhalb dieser Moleküle sind polar, und die Moleküle haben einen mehr oder weniger starken Dipol-Charakter, den sie auch während der gesamten Zeit ihrer Existenz behalten. Man bezeichnet solche Dipole daher auch als permanente Dipole.
Polare Moleküle mit H-Gruppen-Donatoren
Die Moleküle von Alkoholen, Aminen oder Carbonsäuren besitzen OH-Gruppen oder NH2-Gruppen, die in der Lage sind, mit anderen Molekülen Wasserstoffbrücken-Bindungen zu bilden. Solche H-Brücken sind viel stärker als die van-der-Waals-Wechselwirkungen und werden daher im übernächsten Abschnitt behandelt.
Die drei Arten der van-der-Waals-Kräfte
Für die van-der-Waals-Wechselwirkungen sind nur die beiden ersten Arten von Molekülen interessant, die unpolaren Nicht-Dipole und die polaren Dipole. Diese zwei Molekül-Typen können nun auf drei verschiedene Weisen miteinander wechselwirken, wie das folgende Bild zeigt:

Die drei Typen der van-der-Waals-Kräfte
Autor: Ulrich Helmich m08/2024, Lizenz: Public domain.
Aus methodischen Gründen fangen wir mit der Besprechung dieser Abbildung einmal nicht links, sondern rechts an, bei den Keesom-Kräften. Dann werden die Debye-Kräfte behandelt. Dieses Thema ist sehr wichtig, denn wenn wir das Zustandekommen der Debye-Kräfte verstanden haben, sollten wir auch keine Probleme mit den wichtigen London-Kräften haben.
Keesom-Kräfte
Eine solche Wechselwirkung besteht zwischen zwei permanenten Dipolen. Aceton beispielsweise hat ein elektronegatives Sauerstoff-Atom im Molekül und ist daher ein permanenter Dipol. Zwei solcher Dipole können sich leicht gegenseitig anziehen.
Wie stark ein solcher Dipol ist, hängt von zwei Faktoren ab:
- Elektronegativitäts-Unterschied der Atome innerhalb des Moleküls
- Geometrische Gestalt des Moleküls
Je größer der Elektronegativitäts-Unterschied in einem Molekül ist, desto stärkeren Dipol-Charakter hat das Molekül. Das HF-Molekül ist zum Beispiel ein viel stärkerer Dipol als das HBr-Molekül. Gemessen wird die Stärke eines Dipols in Debye, abgekürzt D. Das HCl-Molekül hat ein Dipolmoment von 1,1 D, während das HI-Molekül nur ein Dipol-Moment von 0,4 D hat.
Wenn ein Molekül aus mehr als zwei Atomen besteht, dann spielt auch die geometrische Struktur des Moleküls eine wichtige Rolle bei der Größe und Richtung des Dipolmoments. Zwei polare Bindungen, die in die gleiche oder eine ähnliche Richtung zeigen, verstärken sich gegenseitig, das Dipolmoment ist dann sehr groß. Zeigen die beiden polaren Bindungen dagegen in entgegengesetzte Richtungen, dann können sich die Dipolmomente der beiden Bindungen gegenseitig aufheben, und das Dipolmoment des Moleküls ist sehr klein.

Einfluss der Geometrie auf das Dipolmoment
Autor: Ulrich Helmich 08/2024, Lizenz: Public domain
Das trans-1,2-Dichlorethen hat so gut wie kein Dipolmoment, weil sich die Einflüsse der beiden polaren C-Cl-Bindungen aufheben. Beim cis-1,2-Dichlorethen verstärken sich diese Einflüsse dagegen, das hat dann auch den etwas höheren Siedepunkt zur Folge. Das cis-1,2-Dibromethen hat ein kleineres Dipolmoment als das entsprechende Dichlorethen, aber der Siedepunkt ist deutlich höher. Dies kann man nicht mehr mit den Keesom-Kräften erklären, hier sind noch andere Einflüsse wirksam.
Debye-Kräfte
Mischt man beispielsweise Hexan mit Aceton, so können die permanenten Aceton-Dipole die Elektronen in Hexan-Molekülen beeinflussen.
Nähert sich ein Aceton-Molekül einem unpolaren Hexan-Molekül mit dem negativen Pol (dem O-Atom also), dann werden die Elektronen in der Außenhülle des Hexan-Moleküls abgestoßen, sie weichen zur Seite aus. So entstehen in dem Hexan-Molekül eine leicht positive Region und an den Enden zwei leicht negative Regionen. Das Hexan-Molekül wird auf diese Weise zu einem Dipol.
Das Aceton-Molekül führt diesen Dipol-Charakter des Hexan-Moleküls herbei. Daher sagt man, dass die Hexan-Moleküle zu induzierten Dipolen werden.
Zwischen dem negativ polarisierten O-Atom des Acetons und der positiv polarisierten Region im Hexan bildet sich nun eine schwache Anziehungskraft aus, die nach ihrem Entdecker als Debye-Kraft bezeichnet wird.
London-Kräfte
Diese zwischenmolekularen Anziehungskräfte entstehen zwischen unpolaren Molekülen. Hexan ist beispielsweise bei Raumtemperatur nur deswegen flüssig, weil sich die Hexan-Moleküle gegenseitig anziehen. Da diese Moleküle aber weder Dipole sind noch H-Brücken untereinander ausbilden können, müssen andere Anziehungskräfte wirken. Nach ihrem Entdecker werden diese Anziehungskräfte als London-Kräfte bezeichnet.
Das folgende Bild soll verdeutlichen, wie solche London-Kräfte entstehen.

Veranschaulichung von van der Waals-Kräften
Autor: Ulrich Helmich, Lizenz: Public domain
In der oberen Reihe des Bildes sehen wir zwei Helium-Atome. In dem linken He-Atom befinden sich die beiden Elektronen zufällig auf der rechten Seite der Kugelwolke. Die linke Seite ist zur Zeit leer. Das kann sich aber schon nach wenigen Bruchteilen von Millisekunden ändern. In dieser Momentaufnahme sehen wir das He-Atom aber als Dipol, der blaue Pfeil deutet an, wie stark dieser Dipol ist und in welche Richtung das sogenannte Dipolmoment zeigt.
In dem rechten He-Atom sind die beiden Elektronen in dieser Momentaufnahme eher gleichmäßig in der Kugelwolke verteilt. Das eine Elektron befindet sich in der linken Hälfte, das andere in der rechten Hälfte. Die beiden negativen Ladungen gleichen sich sozusagen aus, ein Dipolmoment kann während dieser kurzen Zeitspanne nicht gemessen werden.
Was passiert nun, wenn sich das linke He-Atom dem rechten He-Atom nähert?
Der temporäre Dipol in dem linken He-Atom induziert einen temporären Dipol in dem rechten He-Atom. Ein solcher Dipol wird als induzierter Dipol bezeichnet. Jedes der beiden He-Atome hat nun einen positiven und einen negativen Pol. Die London-Kraft kommt dadurch zustande, dass sich die beiden temporären Dipole mit ihren positiven und negativen Polen gegenseitig anziehen.
Nach wenigen Mikrosekunden kann das Bild schon wieder ganz anders aussehen. Das linke He-Atom ist vielleicht wieder völlig unpolar, und das rechte He-Atom ist immer noch ein Dipol und induziert jetzt in einem anderen He-Atom einen neuen Dipol, so dass dieses Atom angezogen wird.
Insgesamt führen diese ständig wechselnden London-Kräfte jedoch dazu, dass insgesamt eine deutliche Anziehungskraft zwischen den Molekülen der Verbindung existiert, die dann weitreichende Folgen hat, zum Beispiel messbare Schmelzpunkte und Siedepunkte.
Auf dieser Seite im Lexikon ist die London-Kraft noch etwas genauer erklärt.
Etwas Schulbuch-Kritik
In den Chemie-Schulbüchern werden diese Kräfte meistens nicht mit den korrekten Bezeichnungen dargestellt. Wenn man in einem Schulbuch etwas von der "van-der-Waals-Kraft" liest, ist meistens die London-Kraft gemeint, also die Anziehungskraft zwischen nicht-permanenten Dipolen. Die Keesom-Kraft wird dagegen meistens als "Dipol-Dipol-Kraft" bezeichnet. Die Debye-Kraft wird in den Schulbüchern gar nicht erwähnt, obwohl sie ja beispielsweise gebraucht wird, wenn man erklären will, warum sich Aceton in Hexan löst.
Auf dieser Seite im Lexikon sind die drei van-der-Waals-Wechselwirkung noch etwas genauer erklärt.
Diese Webseite auf dem Lehrerfortbildungs-Server des Landes Baden-Württemberg erklärt die drei van-der-Waals-Wechselwirkungen sehr genau unter didaktisch-methodischen Aspekten. Diese Seite ist also eine dringende Empfehlung für alle Lehrer-Kollegen und -Kolleginnen sowie Studierende der Chemie für das Lehramt (und interessierte Abiturienten).
Keesom vs. London
Kommen wir jetzt noch einmal auf die Keesom- und die London-Kräfte zurück. In der Abbildung 2 mit den Chlor- und Bromethenen hatten wir festgestellt, dass das cis-1,2-Dibromethen einen höheren Siedepunkt hat als das entsprechende 1,2-Dichlorethen. Das ist verwunderlich, weil doch das Chlor-Derivat ein deutlich größeres Dipolmoment hat als das Brom-Derivat. Eigentlich sollte daher das 1,2-Dichlorethen den höheren Siedepunkt haben.
Hier kommen nun die London-Kräfte ins Spiel. Im Chemieunterricht wird oft der Eindruck erweckt, als seien diese Kräfte die "schwächsten der schwachen Bindungen", was aber nicht stimmt (ich selbst habe das jahrelang auch so gemacht, muss ich zu meiner Schande gestehen). Auch in permanenten Dipol-Molekülen bewegen sich die Elektronen ständig, daher herrschen auch zwischen solchen Molekülen London-Kräfte, und zwar ziemlich große. Der Einfluss der London-Kräfte auf die Schmelzpunkte, Siedepunkte und ähnlicher Eigenschaften von Verbindungen oder Elementen ist oft größer als der Einfluss der Keesom-Kräfte.
Lehrerkollegen und -kolleginnen finden auf der oben verlinkten Seite zum Lehrgang "Chemische Wechselwirkung" zahlreiche Beispiele hierfür.
Wasserstoffbrücken-Bindungen
Die stärksten schwachen chemischen Bindungen sind die Wasserstoffbrücken-Bindungen oder kurz H-Brücken. Sie zu erklären ist nicht so ganz einfach, man muss schon das Kugelwolkenmodell gut kennen. Schauen wir uns diese Bindungsart am Beispiel des Wasser-Moleküls an.
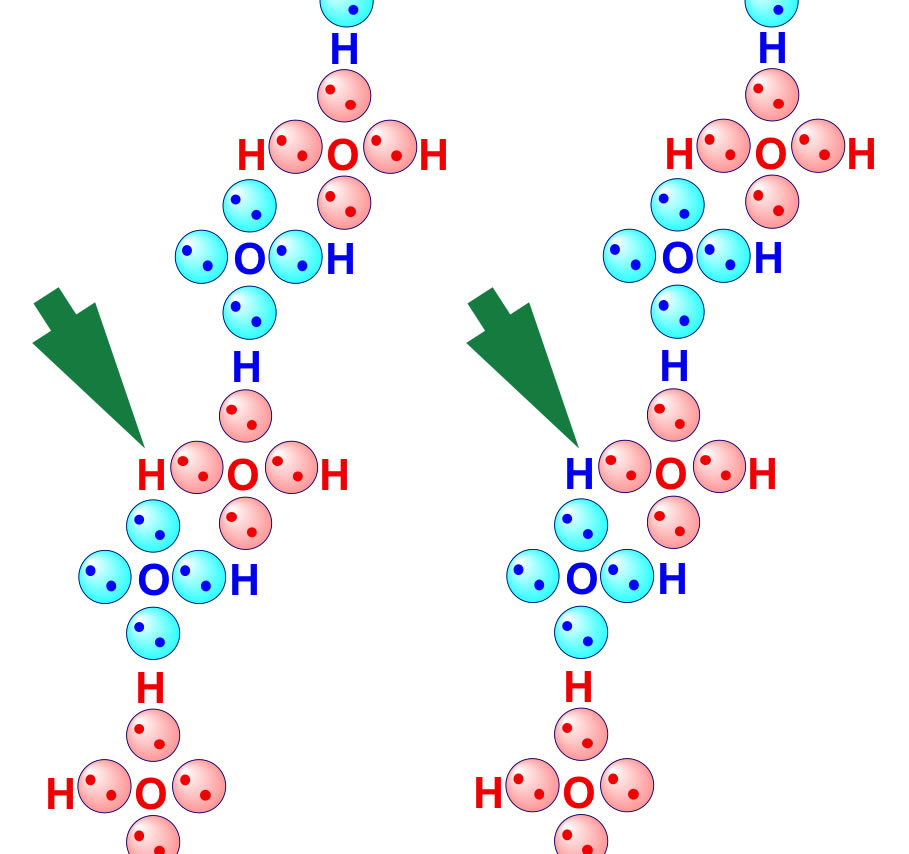
Veranschaulichung von H-Brücken
Autor: Ulrich Helmich, Lizenz: Public domain
Diese etwas ältere Zeichnung zeigt auf der linken Seite eine Kette von Wasser-Molekülen. Das O-Atom besitzt jeweils vier Kugelwolken, die abwechselnd rot und blau hinterlegt worden sind, damit man die Kugelwolken den jeweiligen O-Atomen besser zuordnen kann. Achten Sie nun auf das rot gezeichnete H-Atom in der linken Kette, das durch den dicken grünen Pfeil markiert ist. Dieses H-Atom gehört eindeutig dem rot dargestellten mittleren Wasser-Molekül an. Mit dem O-Atom ist es durch eine rot markierte Kugelwolke verbunden.
Nun schauen wir uns die rechte Seite der Abbildung an. Wir sehen das gleiche H-Atom, das seine Position nicht verändert hat. Doch jetzt ist das H-Atom blau gezeichnet, denn es ist mit dem blau dargestellten Wasser-Molekül verbunden. Das H-Atom hat also nicht seine Position gewechselt, wohl aber seine Zugehörigkeit zu einem Wasser-Molekül.
Der außenstehende Betrachter bekommt von alledem nichts mit. Er erkennt nur, dass dieses H-Atom irgendwie gleichzeitig beiden Wasser-Molekülen angehört. Es bildet sozusagen eine Brücke zwischen den beiden Wasser-Molekülen. Diese Art von chemischer Wechselwirkung, der Zusammenhalt von zwei Molekülen über Wasserstoff-Brücken, wird als Wasserstoffbrücken-Bindung oder kurz H-Brücken-Bindung bezeichnet.
Wasserstoffbrücken-Bindungen sind deutlich stärker als die drei Typen der van-der-Waals-Bindungen. An die Stärke echter kovalenter Bindungen reichen sie jedoch nicht heran.
H-Brücken-Bindungen spielen eine große Rolle in der anorganischen und organischen Chemie. Die hohen Siedepunkte der Alkohole und Carbonsäuren lassen sich beispielsweise auf solche H-Brücken zurückführen, und natürlich auch der ungewöhnlich hohe Siedepunkt des Wassers selbst. Der verwandte Schwefelwasserstoff H2S hat einen viel niedrigeren Siedepunkt als Wasser, obwohl er durch das Schwefel-Atom eine viel höhere molare Masse hat. H2S-Moleküle können keine H-Brücken bilden, daher wirken nur die relativ schwachen Keesom- und London-Kräfte zwischen den Molekülen.
Weitere Informationen zu den Wasserstoffbrücken-Bindungen finden Sie im Chemie-Lexikon.
Hydrophobe Wechselwirkungen
Die Eigenschaften von Proteinen, Nucleinsäuren, Fetten und anderer großer organischer Moleküle werden u.a. durch den sogenannten hydrophoben Effekt beeinflusst. Was versteht man darunter?
Im Chemie-Unterricht der Sek. I oder der Stufe EF erkläre ich den hydrophoben Effekt immer so: Wenn man Pentan mit Wasser mischt, entstehen zwei deutlich sichtbare Phasen, oben schwimmt das Pentan, unten befindet sich das Wasser. Beide Verbindungen vermischen sich nicht, weil die Wasser-Moleküle untereinander H-Brücken bilden. Die Wasser-Moleküle bleiben daher unter sich. Den Pentan-Molekülen bleibt gar nichts anderes übrig, als ebenfalls unter sich zu bleiben. Sie werden durch London-Kräfte zusammengehalten.
In der Qualifikationsphase der Oberstufe kann man den hydrophoben Effekt aber etwas genauer erklären. Dazu betrachten wir mal folgendes Bild:
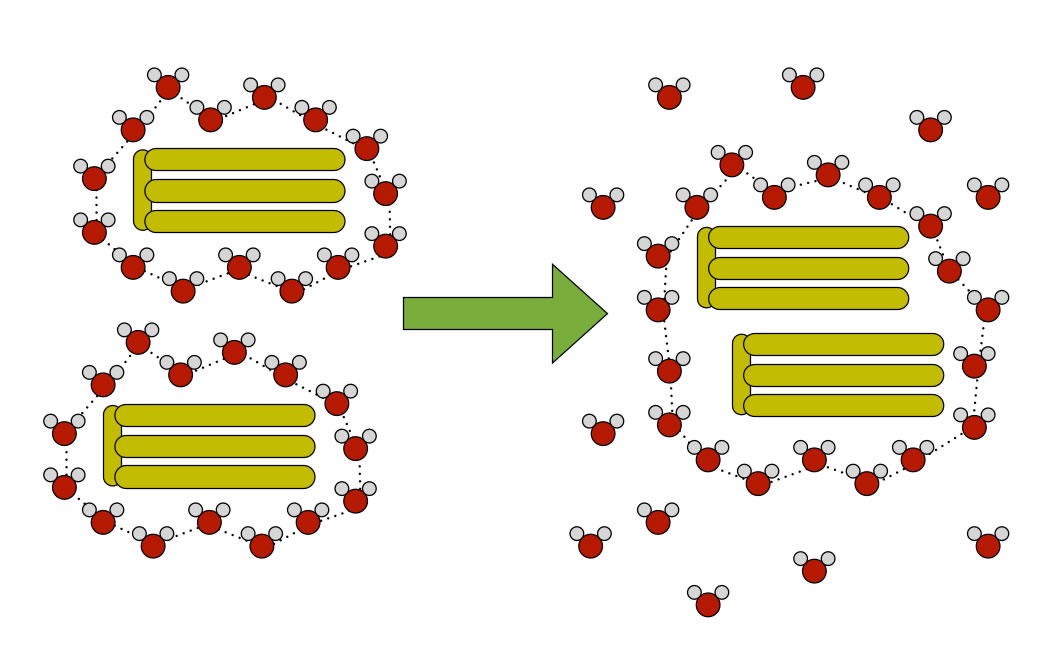
Veranschaulichung des hydrophoben Effekts
Autor: Ulrich Helmich, Lizenz: Public domain
Wir sehen hier zwei Fett-Moleküle in einer wässrigen Umgebung. Auf der linken Seite der Abbildung ist jedes Fett-Molekül von 15 Wasser-Molekülen umgeben, die untereinander durch H-Brücken locker verbunden sind. Diese Wasser-Moleküle bilden eine Art Käfig um das Fett-Molekül. Insgesamt befinden sich hier 30 Wasser-Moleküle in einem relativ geordnetem Zustand. Merken Sie schon, worauf ich hinaus will?
Kommen sich nun zwei dieser Fett-Moleküle etwas näher, bilden die Wasser-Moleküle einen größeren Käfig um die beiden Fett-Moleküle. Dieser Käfig besteht in unserem Anschauungsmodell aber nicht mehr aus 2 x 15 Wasser-Molekülen, sondern nur noch aus 19 Wasser-Molekülen. Die restlichen 11 Wasser-Moleküle sind jetzt wieder "frei" und können untereinander starke H-Brücken bilden, was energetisch sehr günstig ist.
Entropiefaktor
Auch die Zunahme der Unordnung - in der Fachsprache als Entropie bezeichnet - spielt bei dem hydrophoben Effekt eine wichtige Rolle.
Die freigesetzten Wasser-Moleküle erhöhen die Entropie des Systems. Wenn eine chemische Reaktion zu einer Erhöhung der Entropie führt, so läuft eine solche Reaktion viel schneller oder einfacher ab.
Bei Sprengungen macht man sich eine solche Entropiezunahme beispielsweise zu Nutze. Man lässt zwei Feststoffe in einer exothermen Reaktion miteinander reagieren, dabei bilden sich ein, zwei oder mehrere Gase. Gase sind grundsätzlich "unordentlicher" als Feststoffe, die Entropie nimmt bei einer solchen Reaktion also schlagartig zu.
Nicht ganz so schlagartig ist die Entropiezunahme, wenn sich Fett-Moleküle erst zu kleinen, dann zu größeren Fett-Tropfen in einer wässrigen Umgebung vereinigen. Aber dennoch ist diese Entropiezunahme eine treibende Kraft für die Tröpfchenbildung und die Nicht-Mischbarkeit von Wasser und Fett.
Atombau - Oktettregel - Ionenbindung - Elektronenpaarbindung - Metallbindung - Elektronegativität - schwache Bindungen