Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass nucleophile Substitutionen monomolekular oder bimolekular ablaufen können,
- dass man entsprechend zwischen SN1-Reaktionen und SN2-Reaktionen unterscheiden kann.
- dass die SN1-Reaktion nach einer monomolekularen Kinetik abläuft, die SN2-Reaktion nach einer bimolekularen.
- dass die SN1-Reaktion in zwei Schritten abläuft, die SN2-Reaktion in einem einzigen Schritt
- dass bei der SN1-Reaktion ein Carbenium-Ion als Zwischenprodukt gebildet wird, das von beiden Seiten vom Nucleophil angegriffen werden kann, so dass eventuell zwei Spiegelbild-Isomere gebildet werden können.
- dass es bei der SN2-Reaktion zu einer Walden-Umkehr kommen kann.
Erstes Beispiel (SN2)
Chlormethan CH3Cl reagiert mit Natronlauge NaOH bei erhöhter Temperatur zu Methanol CH3OH und Natriumchlorid NaCl:
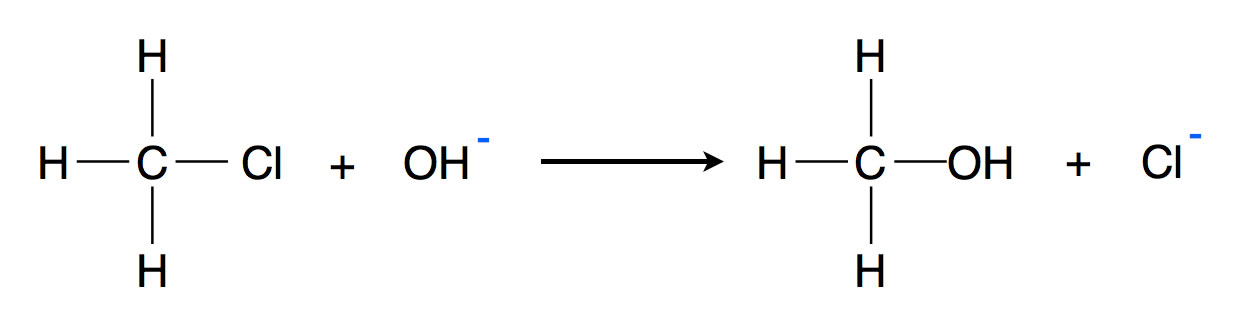
Die Reaktion von Chlormethan mit Hydroxid-Ionen zu Methanol
Autor: Ulrich Helmich 2019, Lizenz: Public domain
Untersucht man nun die Kinetik (das Geschwindigkeits-Verhalten) dieser Reaktion, so stellt man fest, dass die Reaktionsgeschwindigkeit sowohl von der Konzentration des Substrats Chlormethan wie auch von der Konzentration des Nucleophils OH- linear abhängt:
vR = k * c(CH3Cl) * c(NaOH)
Es handelt sich also um eine bimolekulare Reaktion bzw. um eine Reaktion 2. Ordnung.
Was ist der Unterschied zwischen den Begriffen "bimolekular" und "2. Ordnung" ?
Beide Bezeichnungen "bimolekular" und "2. Ordnung" sind korrekt, haben allerdings eine etwas unterschiedliche Bedeutung.
- "Bimolekular" bezieht sich auf die Tatsache, dass bei der Reaktion zwei Teilchen zusammenstoßen müssen (hier also die CH3CI-Moleküle und die OH--Ionen). Der Begriff "bimolekular" betont also den mechanistischen Aspekt und bezieht sich auf die Stoßtheorie.
- "2. Ordnung" bezieht sich auf das experimentell ermittelte Geschwindigkeitsgesetz, dass also die Reaktionsgeschwindigkeit von den Konzentrationen zweier Edukte abhängt - hier wird also der kinetische Aspekt betont.
Zweites Beispiel (SN1)
Kommen wir auf den Versuch zurück, der auf der vorherigen Seite vorgestellt wurde. Wenn wir 2-Brom-2-methylpropan und Ethanol in Anwesenheit von Silbernitrat zusammengeben, beobachten wir eine intensive Reaktion.
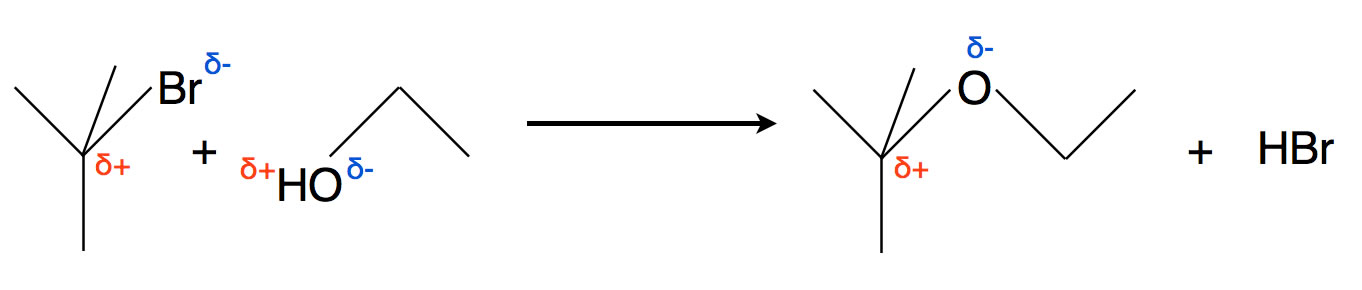
Die Reaktion des tertiären Brombutans mit Ethanol zu einem Ether und HBr
Autor: Ulrich Helmich 04/2025, Lizenz: Public domain
Aus Ethanol und 2-Brom-2-methylpropan bilden sich ein Ethylbutylether und Bromwasserstoff.
An sich könnte man hier nicht viel beobachten, da alle Verbindungen farblos sind. Aber man setzt der Lösung etwas Silbernitrat zu, und das Silbernitrat AgNO3 reagiert mit den gebildeten Bromid-Ionen zu wasserunlöslichem Silberbromid AgBr. Es bildet sich ein hellgelber Niederschlag von AgBr, den man sehr gut beobachten kann.
Untersucht man die Kinetik dieser Reaktion, so stellt man fest, dass die Reaktionsgeschwindigkeit nur von der Konzentration des Substrats 2-Brom-2-methylpropan abhängt, nicht aber von der Konzentration des neutralen Nucleophils C2H5-OH:
vR = k * c((CH3)3Br)
Es handelt sich also um eine monomolekulare Reaktion bzw. um eine Reaktion 1. Ordnung.
SN1- und SN2-Reaktionen
Wir haben eben zwei verschiedene Nucleophile Substitutionsreaktionen kennengelernt, die sich durch Gemeinsamkeiten und Unterschiede auszeichnen.
Gemeinsamkeiten:
Bei beiden Reaktionen wird eine Abgangsgruppe, ein sogenanntes Nucleofug, durch ein neues Nucleophil substituiert (ersetzt). Bei der ersten Reaktion wird das Cl-Atom durch eine OH-Gruppe ersetzt, bei der zweiten Reaktion ein Br-Atom durch eine O-C2H5-Gruppe.
Unterschiede:
Die erste Reaktion läuft mit einem bimomolekularem Mechanismus ab, bei dem zwei Teilchen zusammenstoßen müssen, und die Reaktionsgeschwindigkeit ist von den Konzentrationen beider Edukte abhängig. Man spricht hier von einer SN2-Reaktion.
Die zweite Reaktion läuft mit einem monomolekularem Mechanismus ab, bei dem offensichtlich kein Zusammenstoß erforderlich ist, und die Reaktionsgeschwindigkeit ist nur von der Konzentration des organischen Substrats abhängig. Dieser Reaktionsweg wird als SN1-Reaktion bezeichnet.
Beide Reaktionstypen wollen wir uns jetzt mal etwas näher ansehen.
Die SN1-Reaktion
Die SN1-Reaktion läuft in zwei getrennten Schritten ab. Zunächst wird die Abgangsgruppe abgespalten, dann setzt sich das neue Nucleophil an die Stelle des Nucleofugs (der Abgangsgruppe).
Schritt 1: Abspaltung des Nucleofugs
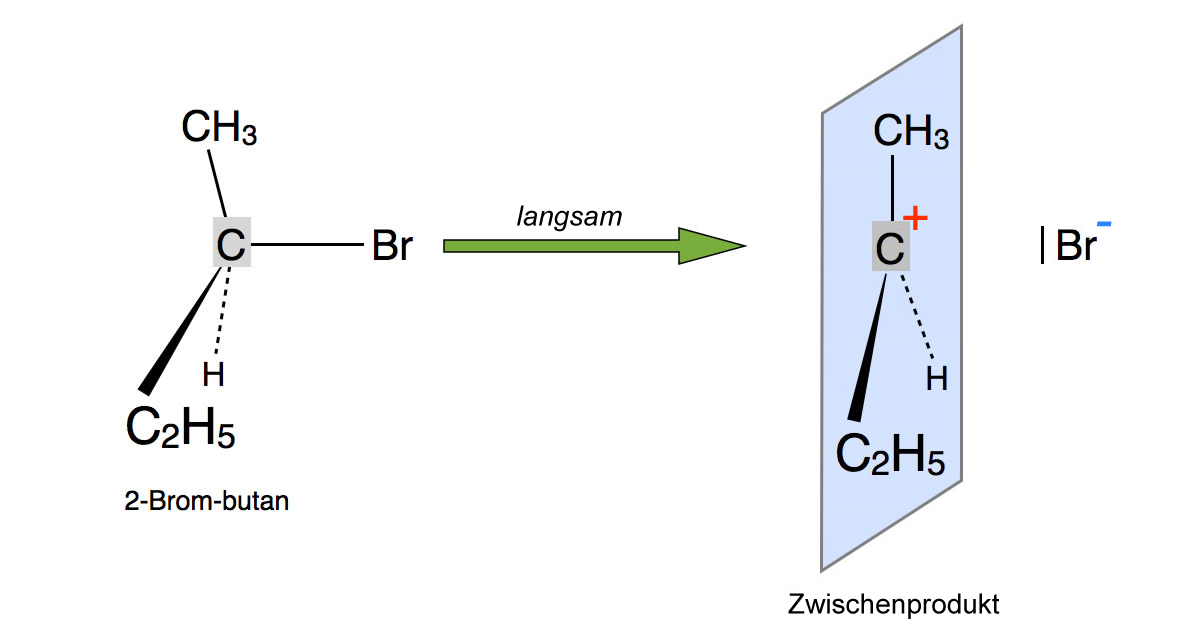
Der erste Schritt der SN1-Reaktion von 2-Brom-butan mit Iodid
Autor: Ulrich Helmich 2022, Lizenz: Public domain
In diesem Beispiel zerfällt ein2-Brombutan-Molekül heterolytisch in ein Carbenium-Ion und ein Bromid-Anion. Ein Zusammenstoß mit einem Nucleophil-Molekül ist für diesen Zerfall nicht erforderlich. Es reicht, wenn zwei Substrat-Moleküle aufgrund der Wärmebewegung zusammenstoßen.
Da dieser Reaktionsschritt mit der Spaltung der kovalenten C-Br-Bindung verbunden ist, ist seine Aktivierungsenergie recht hoch, und entsprechend langsam verläuft dieser Schritt 1.
Das Produkt dieses ersten Schrittes ist planar, was durch die blau eingezeichnete Ebene verdeutlicht werden soll. Bei dem Produkt dieses ersten Schrittes handelt es sich noch nicht um das Endprodukt, sondern um ein Zwischenprodukt.
Schritt 2
Das Zwischenprodukt ist ein planares Carbenium-Ion, ein Nucleophil kann das Carbenium-Ion daher von zwei Seiten mit der gleichen Wahrscheinlichkeit angreifen:
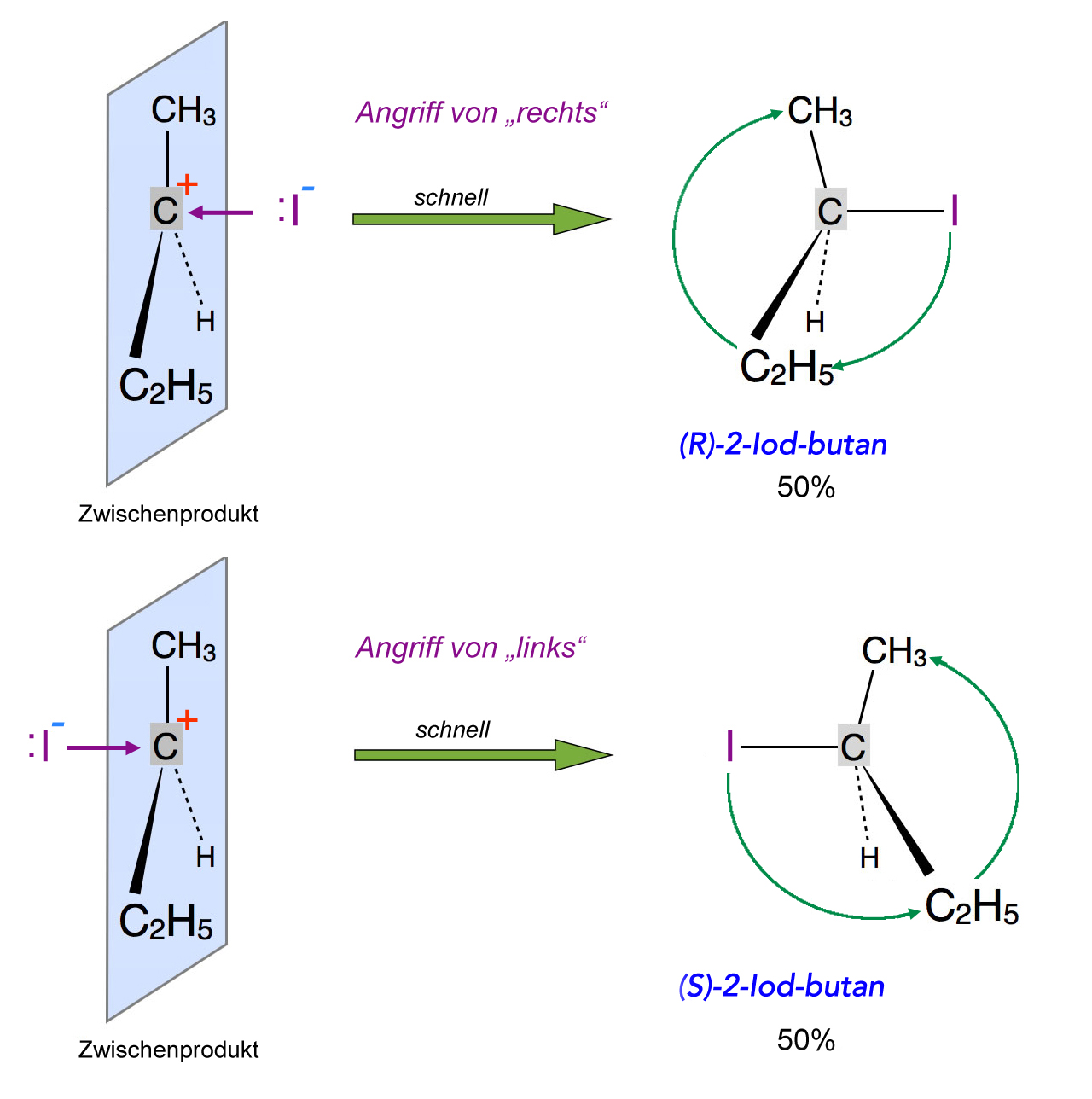
Angriff eines Nucleophils auf das Carbenium-Ion liefert ein 50:50 Racemat
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wenn das Nucleophil (hier ein Iodid-Ion) von rechts angreift, entsteht im Prinzip das gleiche Produkt wie bei einem Angriff von links. Allerdings unterscheiden sich die beiden Produkte in einem Punkt: Sie verhalten sich wie Bild und Spiegelbild. Diese spezielle Form der Isomerie bezeichnen wir als Enantiomerie oder Spiegelbild-Isomerie.
Beide Produkte sind tatsächlich unterschiedlich, das können Sie aber nur feststellen, wenn Sie beide Moleküle mit einem Modellbaukasten nachbauen. Sie werden es nicht schaffen, das (R)-2-Iodbutan-Molekül mit dem (S)-2-Iodbutan-Molekül zur Deckung zu bringen. Genau so könnten Sie versuchen, einen rechten (R)-Handschuh mit einem linken (S)-Handschuh zur Deckung zu bringen.
Da die Wahrscheinlichkeit eines Angriffs von links und rechts gleich groß ist, erhält man auch gleich viel von jeder der beiden Konfigurationen, eine solche Mischung aus 50% (R)- und 50% (S)-Produkt bezeichnet man als Racemat.
Der Schritt 2 besteht in der Bildung einer neuen kovalenten Bindung. Eine solche Bindungsbildung hat normalerweise eine recht niedrige Aktivierungsenergie und verläuft daher recht schnell. Außerdem ist die Bildung einer neuen Bindung immer exotherm, was der Reaktion durch die frei werdende Reaktionsenthalpie (Reaktionswärme) einen "weiteren Schub" gibt.
Gesamtreaktion
Der erste Schritt verläuft langsamer als der zweite. Die Geschwindigkeit der Gesamtreaktion hängt also nur von der Geschwindigkeit des ersten Schrittes ab. Daher ist der erste Schritt dieser Reaktion der geschwindigkeitsbestimmende Schritt.

Drei flüchtende Häftlinge
Autor: Ulrich Helmich / Photoshop 2025, Lizenz: Public domain
Denken Sie einfach mal an drei Häftlinge, die in einem Hollywood-Western aus der Haftanstalt flüchten, verfolgt von den Bluthunden. Die drei sind mit Stricken noch aneinander gekettet. Dann hängt die Geschwindigkeit der drei Flüchtenden von der Höchstgeschwindigkeit des langsamsten Häftlings ab.
Das schöne Gemälde oben wurde übrigens von Photoshop 2025 generiert, die verfolgenden Bluthunde hat Photoshop leider nicht hinbekommen.
Weil nun der geschwindigkeitsbestimmende Schritt der SN1-Reaktion ein monomolekularer Schritt ist, verläuft auch die Gesamtreaktion nach einer Kinetik 1. Ordnung, und daher wird dieser Typ der Nucleophilen Substitution als SN1-Reaktion bezeichnet.
Die SN2-Reaktion
Dieser Mechanismus der Nucleophilen Substitution verläuft mit einer Kinetik 2. Ordnung. Die Geschwindigkeit der Gesamtreaktion hängt sowohl von der Konzentration des Substrats R-X ab wie auch von der Konzentration der Eintrittsgruppe Y.
Das kann man nur so erklären, dass beide Teilchen, also R-X und Y, gleichzeitig aufeinander stoßen müssen, um die Reaktion in Gang zu bringen. Bei der Reaktion trifft also das Nucleophil Y auf das Substrat und drückt im selben Reaktionsschritt die Abgangsgruppe X aus dem Substrat heraus.
Dadurch kommt es zu einer sogenannten Inversion der Raumstruktur des Substrats, wie das folgende Bild zeigt:
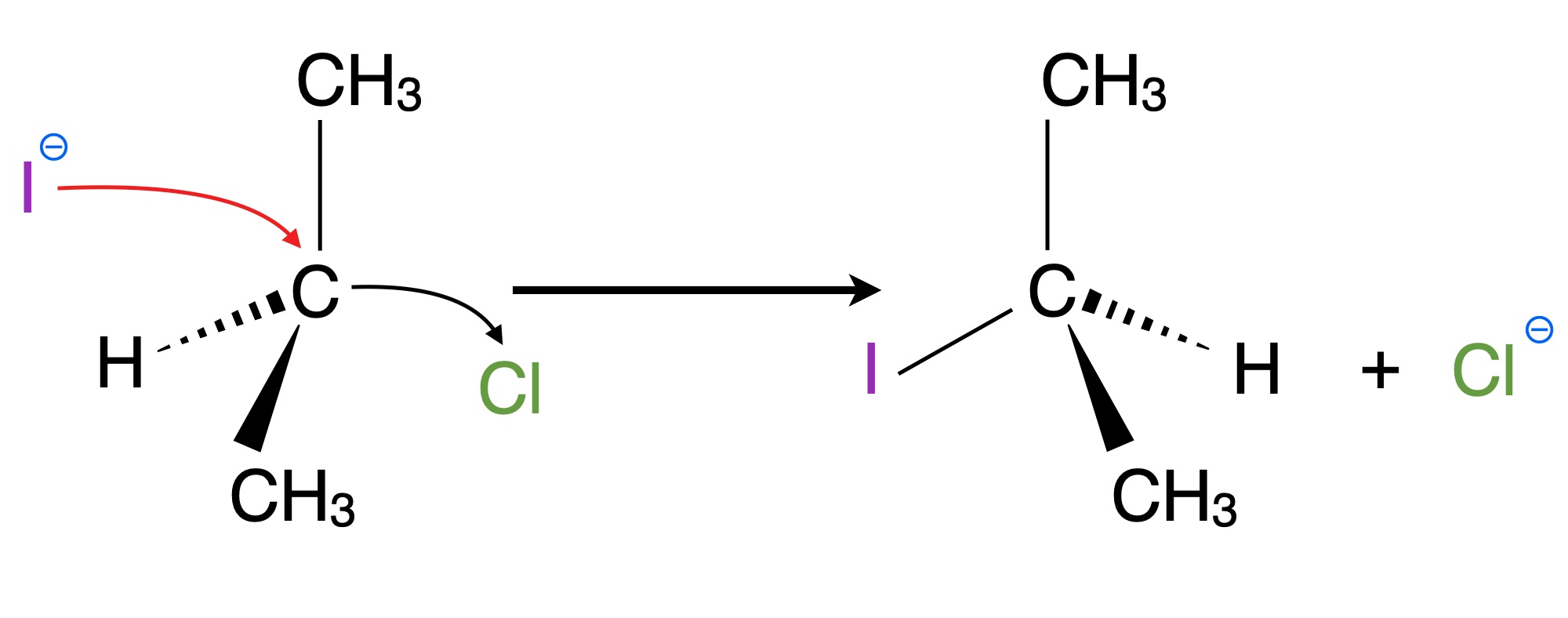
Reaktion von 2-Chlor-propan zu 2-Iod-propan
Autor: Ulrich Helmich 06/2025, Lizenz: Public domain.
Das Chlor-Atom im organischen Substrat ist in der Abbildung nach rechts oben ausgerichtet, das Iod-Atom im Produkt aber nach links oben. Auch die untere Methylgruppe und das Wasserstoff-Atom haben ihre Position spiegelbildlich verändert.
Diese Inversion der Raumstruktur ist typisch für die SN2-Reaktion. Entdeckt hat sie Paul Walden (1863-1957), darum wird sie auch Walden-Inversion oder Walden-Umkehr genannt.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
Seitenanfang -
Weiter mit Faktoren, die den Verlauf der SN beeinflussen...