Der Mechanismus nach Buddrus/Schmidt
Im Buddrus/Schmidt [2] findet man einen Hinweis auf einen möglichen Mechanismus der Reduktion mit LiAlH4. Danach könnte die Reaktion so ablaufen:
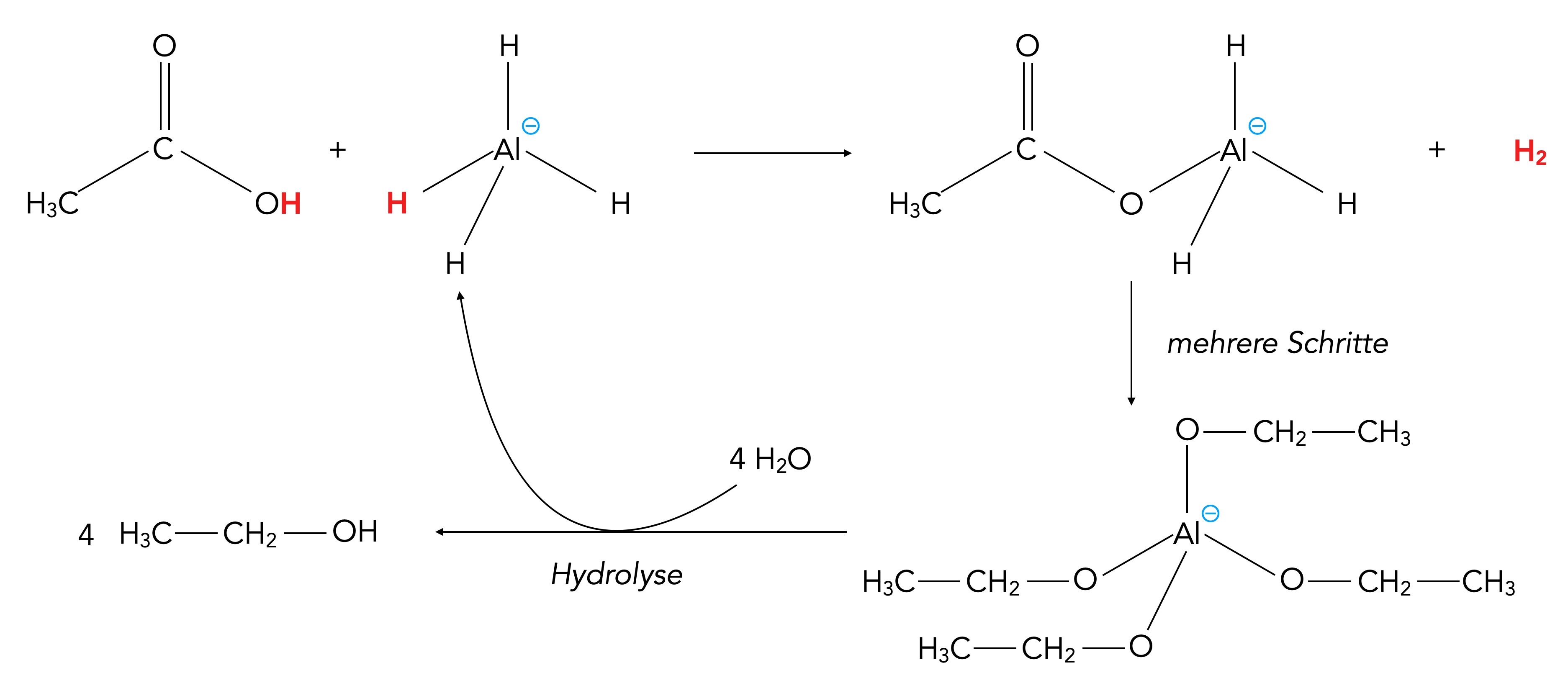
Möglicher Mechanismus der Reduktion einer Carbonsäure mit LiAlH4
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Im ersten Schritt reagiert das H-Atom der OH-Gruppe mit einem H-Atom des LiAlH4--Anions. Dabei wird ein H2-Molekül freigesetzt, und es entsteht ein R-COO-AlH3--Komplex mit einem Li+ als Gegenkation (nicht mit eingezeichnet).
In mehreren Schritten, die in [2] leider nicht näher erläutert werden, entsteht dann schließlich ein Komplex mit einem Aluminium-Atom, das von vier Alkoholat-Resten umgeben ist. Wie jetzt aber die genaue Reduktion um vier Stufen erfolgt, wird leider nicht ausgeführt.
Durch Hydrolyse dieses Komplexes entstehen dann vier Alkohol-Moleküle. In [2] ist das jetzt nicht erwähnt, aber rein rechnerisch müsste bei dieser Hydrolyse ein LiAlH4--Anion zurückgebildet werden. Eine Gesamtgleichung aufzustellen, hat hier keinen Zweck, da zu den "mehreren Schritten" die notwendigen Informationen fehlen. Selbst im Carey/Sundberg, einem weiterführenden Lehrbuch der Organischen Chemie, fehlen Hinweise zum Ablauf dieser Reduktion. Eine Internet-Recherche liefert zwar Ergebnisse, die sich teils aber widersprechen.
Der Mechanismus nach "Organic Mechanisms"
Eine Internet-Recherche führte zu dem folgenden YouTube-Video, das die Reduktion eines Benzoesäure-Ethanol-Esters mit LiAlH4 anschaulich erklärt, allerdings nach einem völlig anderen Mechanismus als in [2] dargestellt:
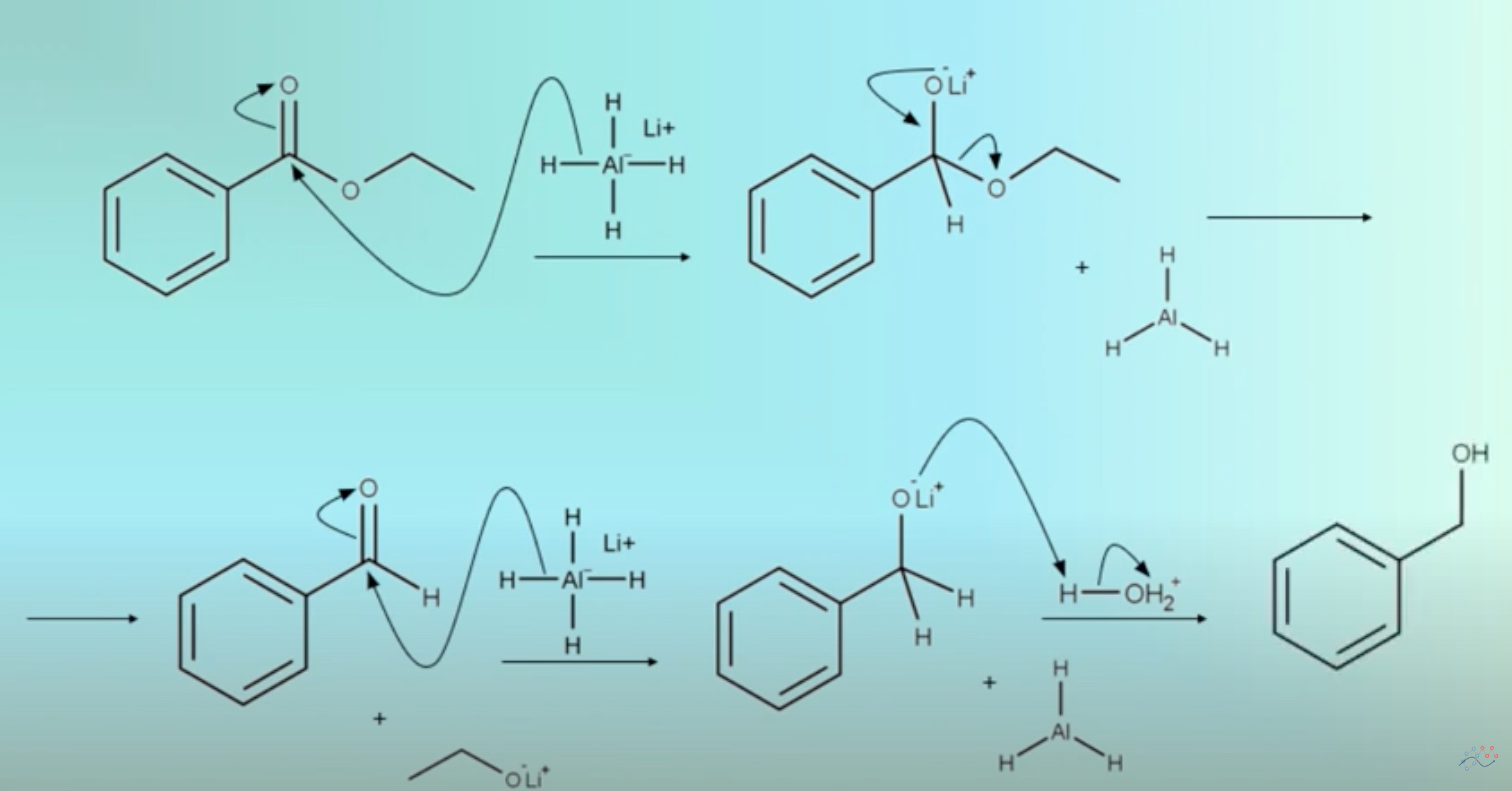
Screenshot eines YouTube-Videos zur LiAlH4-Reduktion eines Esters
Quelle: OrganicMechanismsChannel
Schauen wir uns die hier gezeigten Schritte mal im Einzelnen an:
- Im ersten Schritt greift ein Hydrid-Ion das Carboxyl-C-Atom nucleophil an, die C=O-Doppelbindung löst sich auf, und die negative Ladung des H--Ions wird von dem Carbonyl-O-Atom übernommen. Zurück bleibt AlH3.
- Im nächsten Schritt spaltet sich der Alkohol des Esters als Alkoholat-Ion ab, das mit dem Li+-Kation ein Salz bildet. Als Ergebnis entsteht ein Aldehyd - damit wäre die Carbonsäure (bzw. der Carbonsäure-Ester) schon einmal um zwei Stufen reduziert.
- Der gebildete Aldehyd wird wieder von einem Hydrid-Ion nucleophil angegriffen, es entsteht ein Alkoholat-Ion mit Li+ als Gegenkation. Zurück bleibt wieder AlH3.
- Im letzten Schritt wird eine Säure zugesetzt, und aus dem Alkoholat-Ion entsteht der fertige Alkohol.
Ich habe jetzt einmal versucht, diesen Mechanismus auf die Reduktion von Essigsäure zu Ethanol zu übertragen. Hier mein Ergebnis:

Reduktion von Essigsäure mit LiAlH4, nach dem Mechanismus aus dem YouTube-Video (siehe oben)
Autor: Ulrich Helmich 06/2024, Lizenz: Public domain
Der einzige Unterschied zu der Ester-Reduktion besteht im Schritt 2. Statt des Alkoholat-Ions wird hier ein Hydroxid-Ion abgespalten. Wir wollen jetzt einmal die Gesamtgleichung der Schritte 1 bis 4 aufstellen und diese auf Richtigkeit überprüfen.
CH3-COOH + 2 AlH4- + H3O+ → CH3-CH2-OH + 2 AlH3 + OH- + H2O
Überprüfung der Reaktionsgleichung
Die Zahl der C-Atome, H-Atome, O-Atome und Al-Atome ist auf beiden Seiten gleich:
C: 2/2, H: 15/15, O: 3/3 und Al: 2/2
Die Reaktionsgleichung kann also tatsächlich als "Gleichung" bezeichnet werden. Ob der in der Abbildung vorgestellte Mechanismus korrekt ist, kann so einfach leider nicht überprüft werden.
Der Mechanismus im Organikum
Im berühmten Organikum [8] lesen wir zu dieser Reduktion:
"... sind gewisse Metallhydride H-M in der Lage, als H-Nucleophile zu wirken und ein Wasserstoffatom mit seinen Bindungselektronen als Hydridion auf das C-Atom der Carbonylgruppe zu übertragen. Das Hydridion tritt dabei aber nicht frei auf, sondern reagiert unter konzertierter Spaltung der M-H-Bindung und Knüpfung der C-H-Bindung."
Diese Aussage passt leider nicht zu dem Schema aus dem Buddrus/Schmidt, wo im ersten Schritt H2 freigesetzt wird, was man auf den ersten Blick als Oxidation und nicht als Reduktion ansehen würde. Zu dem erwähnten YouTube-Video passt die Aussage allerdings viel besser.
Quellen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- engl. Wikipedia, Artikel "Carboxylic acid"
- Wikipedia, Artikel "Carbonsäurechloride, Darstellung"
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Chemgapedia, Artikel "Reaktion von Carbonsäuren" (nicht mehr zugänglich!)
- Carey, Sundberg: Organische Chemie, ein weiterführendes Lehrbuch. Weinheim 1995.
- Organikum, 22. Auflage, Weinheim 2004.
Seitenanfang -
Weiter mit ...