Unter dem Begriff Allosterie versteht man die Beeinflussung der Aktivität eines Enzyms durch eine Verbindung, die nicht mit dem Substrat identisch ist.
Allgemein nennt man solche Verbindungen Effektoren. Führt die Bindung des Effektors zu einer Aktivierung des Enzyms, spricht man von einem Aktivator. Hemmt der Effektor dagegen die Enzymaktivität, nennt man ihn Inhibitor.

Ein Enzym mit einem allosterischen Zentrum
Autor: Ulrich Helmich 2000, Lizenz: Public domain
Während sich das Substrat in das aktive Zentrum des Enzyms setzen kann, binden die Effektoren an ein allosterisches Zentrum im Enzym. Wenn sich der Effektor in das allosterische Zentrum setzt, verändert sich die Konformation des Proteins, was sich auch auf die Struktur der aktiven Zentrums auswirken kann:
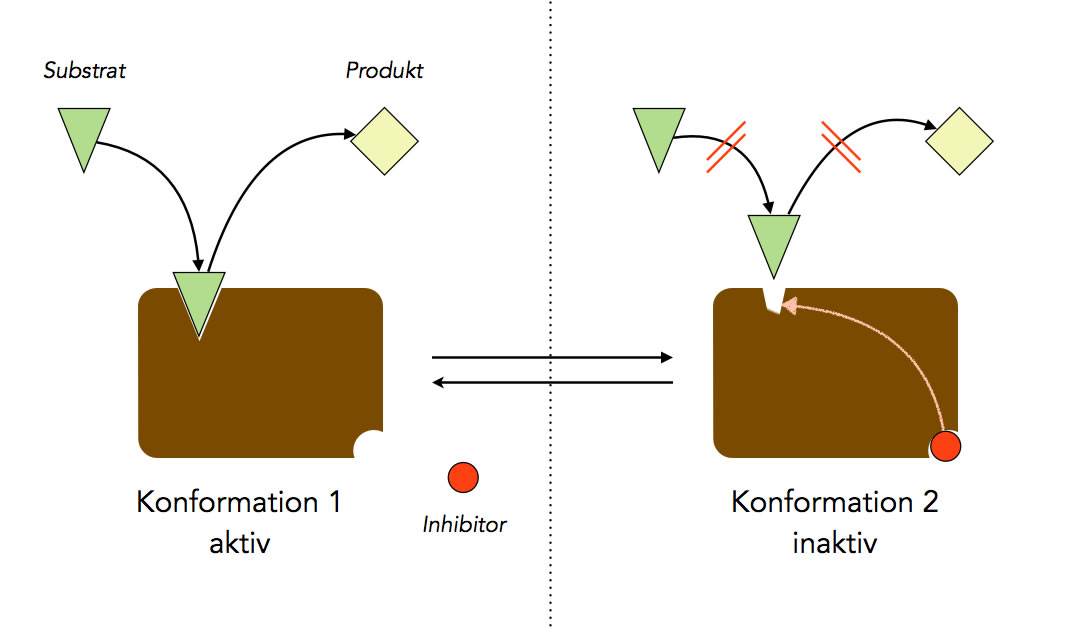
Arbeitsweise eines allosterischen Inhibitors
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir ein Beispiel für die allosterische Hemmung. Wenn sich der Inhibitor in das allosterische Zentrum setzt, verändert sich die Struktur des aktiven Zentrums derart, dass kein Substrat-Molekül mehr hineinpasst.
Eine allosterische Hemmung oder Aktivierung ist in der Regel reversibel, wie man auch in dem Bild sehen kann (Gleichgewichts-Pfeile). Wenn sich der Inhibitor also wieder aus dem allosterischen Zentrum löst, erhält das aktive Zentrum seine ursprüngliche Struktur zurück, und das Enzym kann wieder normal arbeiten.
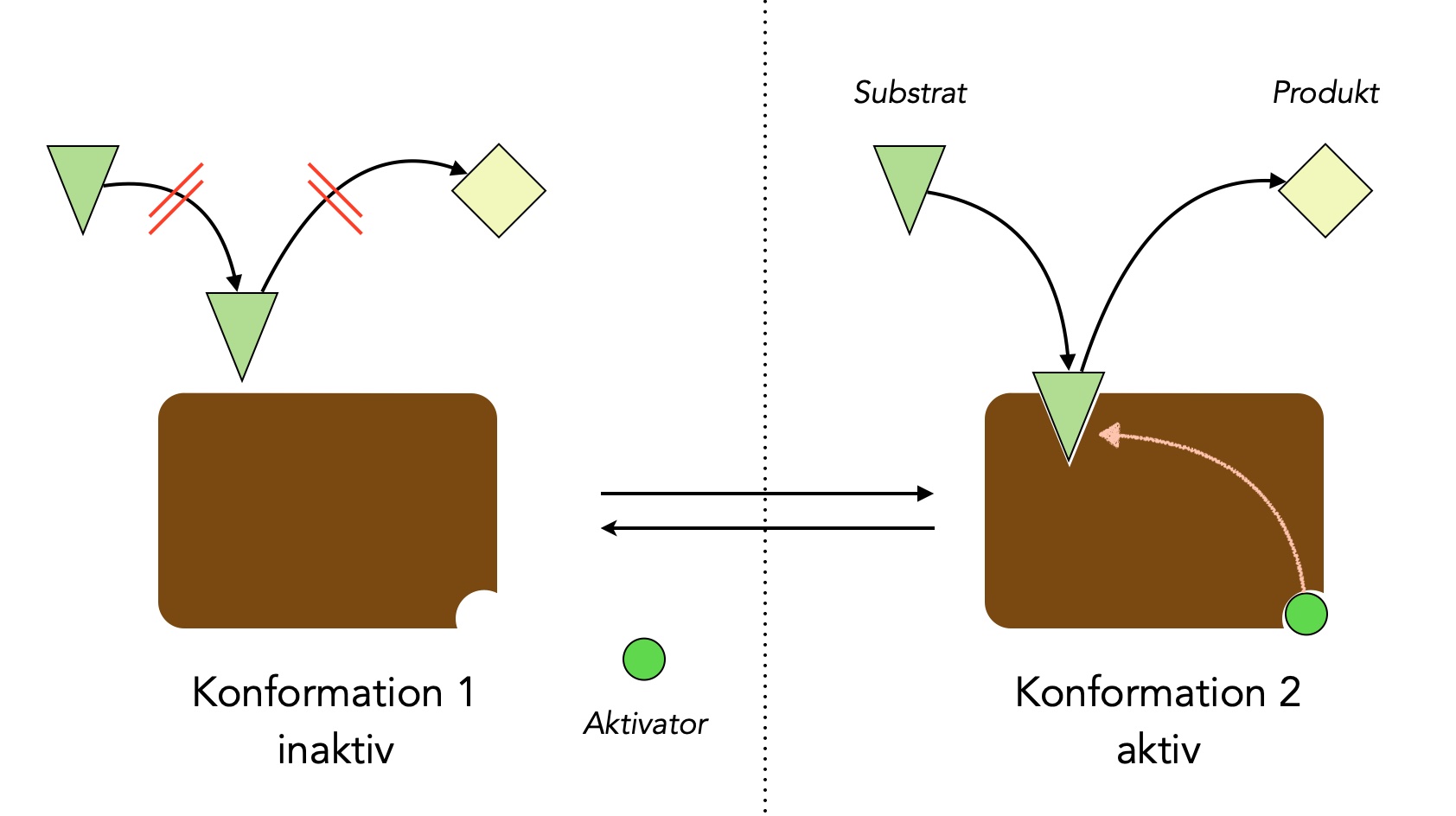
Arbeitsweise eines allosterischen Aktivators
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Bei der allosterischen Aktivierung passiert genau das Gegenteil: Wenn das allosterische Zentrum nicht besetzt ist, kann das aktive Zentrum das Substrat nicht aufnehmen. Erst wenn sich ein Aktivator-Molekül in das allosterische Zentrum gesetzt hat, verändert sich die Konformation des Enzyms so, dass das Substrat aufgenommen werden kann.
Heteroallosterie und Homoallosterie
Die bisher auf dieser Seite vorgestellten Formen der allosterischen Hemmung und Aktivierung werden in der Fachliteratur manchmal als Heteroallosterie bezeichnet, weil der Inhibitor bzw. Aktivator nicht mit dem Substrat identisch sind.
Das Gegenteil der Heteroallosterie wäre dann die Homoallosterie, hier sind Effektor und Substrat identisch.
Bei der Substratinduktion könnte eine solche Homoallosterie durchaus eine Rolle spielen. Den Begriff "Substatinduktion" kennen Sie vielleicht aus dem Schulunterricht. Erst wenn die Konzentration eines Substrats wie beispielsweise Lactose oder Glucose einen bestimmten Schwellenwert überschreitet, werden die Enzyme zum Abbau dieses Substrats aktiviert. Wenn die Aktivierung des abbauenden Enzyms dadurch geschieht, dass sich ein Substrat-Molekül in das allosterische Zentrum setzt und dadurch das bisher passive aktive Zentrum aktiviert, dann könnte man in der Tat von einer Homoallosterie sprechen.
Das bekannteste Beispiel für eine solche Homoallosterie ist das Hämoglobin-Molekül. Hämoglobin ist der rote Blutfarbstoff, der für den Transport von Sauerstoff-Molekülen zuständig ist. Das Hämoglobin-Molekül besteht aus vier Untereinheiten, jede davon kann ein O2-Molekül transportieren. Die Affinität des vollständig unbesetzten Hämoglobins für O2 ist noch relativ niedrig. Sie steigt aber, wenn sich das erste O2-Molekül an eine Untereinheit gesetzt hat. Das zweite O2-Molekül kann sich dann schon deutlich leichter anlagern, was die O2-Affinität nochmals erhöht. Mit dem dritten O2-Molekül ist die O2-Affinität noch größer, so dass sich das vierte O2-Molekül sehr leicht anlagern kann.
positive Kooperativität
Das Phänomen, dass beim Hämoglobin nachfolgende O2-Moleküle schrittweise leichter aufgenommen werden, wird auch als positive Kooperativität bezeichnet.
Auf dieser Seite wird allgemein Besprochen, wie die Aktivität eines Enzyms reguliert werden kann, neben der allosterischen Regulation werden auch noch andere Formen der Regulation aufgezeigt.