Warum müssen Tiere und Menschen überhaupt essen?
Klar, wenn wir keine Nahrung zu uns nehmen, verhungern wir und sterben schließlich. Aber warum ist das so?
Unser Körper verbraucht ständig einen hohen Betrag an Energie. Nicht nur, um die vielen Muskeln zu bewegen, wenn wir gehen, laufen, Sport treiben etc. Auch für "unauffällige" Vorgänge wie Verdauung, Herzschlag, Denken (das Gehirn ist einer der größten Energieverbraucher des Menschen) wird jede Menge Energie benötigt. Und dann natürlich die Arbeit, die in jeder einzelnen unserer 30 bis 40 Billionen Zellen ständig geleistet wird.
Der genmanipulierte Mensch der Zukunft kann ja vielleicht Photosynthese betreiben wie die Pflanzen, aber noch müssen wir die erforderliche Energie über die Zufuhr energiereicher Nährstoffe aufnehmen, was gemeinhin als "Essen" bezeichnet wird. Wenn wir tierische oder pflanzliche Nahrung zu uns nehmen, spielen vor allem drei Arten von energiereichen Nährstoffen eine Rolle:
- Kohlenhydrate
- Fette
- Eiweiße
Am energiereichsten sind die Fette. Ein Gramm Fett setzt bei der Oxidation ca. 37 bis 40 kJ (Kilojoule) frei (9 kcal, aber mit Kalorien soll man ja nicht mehr rechnen). Kohlenhydrate und Eiweiße liefern pro Gramm deutlich weniger Energie, nur ca. 17 kJ.
Energiegehalt
Der "Energiegehalt" oder "Brennwert" eines Nährstoffes wird in der Ernährungslehre grundsätzlich in kJ pro Gramm angegeben. In der Chemie versteht man unter dem Brennwert nichts anders als die Reaktionsenergie, die bei der Oxidation des Nährstoffs freigesetzt wird. Messen kann man diese Reaktionsenergie mit bestimmten Apparaturen, vor allem der Kalorimeter ist hier zu erwähnen. Wie ein solcher Kalorimeter funktioniert, ist weiter unten aufgeführt.
Der Brennwert eines Nährstoffs (also die Reaktionsenergie, die bei der Verbrennung von 1 g des Nährstoffs freigesetzt wird) wird in Kilojoule, abgekürzt kJ gemessen.
Kilowatt, Kilojoule und Kilokalorie
Die Definition des Begriffs "Joule" ist reichlich physikalisch und nicht ganz leicht zu verstehen;
1 Joule die Arbeit, die verrichtet wird, wenn die Kraft von 1 Newton über eine Strecke von 1 Meter ausgeübt wird.
Mit dieser Definition haben nicht nur viele Schüler Probleme. Etwas leichter zu verstehen ist vielleicht die folgende Erklärung:
Von 1 Kilowatt spricht man, wenn ein einer Sekunde die Energie von 1 kJ umgesetzt wird. Ein Radiator (elektrisches Heizgerät) oder ein Staubsauger beispielsweise verbrauchen 1,0 bis 1,5 Kilowatt. Das heißt, sie setzen pro Sekunde 1 bis 1,5 kJ an Energie um. Lässt man den Radiator eine Stunde laufen, weil es vielleicht sehr kalt in der Wohnung ist, so werden 1,0 bis 1,5 kWh (Kilowattstunden) aus dem Stromnetz gezogen.
Aufgabe
Wie viele Kilojoule werden umgesetzt, wenn man ein Heizgerät, das 800 Watt zieht, eine Stunde laufen lässt? Und wie viel Schwarzwälder Kirschtorte könnte man dafür essen?
Lösung
Es werden 0,8 kWh aus dem Netz gezogen. Wenn man die Stunden in Sekunden umrechnet, erhält man 2880 kWs. Eine Kilowattsekunde ist aber nichts anderes als ein Kilojoule. Also werden von dem Heizgerät 2880 kJ verbraucht.
Ein Stück Schwarzwälder Kirschtorte hat einen Energiegehalt zwischen 1000 und 1200 kJ. Der Verbrauch des Heizgeräts entspricht also nicht ganz 3 Stücken dieser Kirschtorte.
Nach diesem kleinen Ausflug in die Physik kommen wir wieder zur Ernährungslehre zurück, obwohl die obige Physik-Aufgabe ja auch schon einen leckeren Ernährungs-Anteil hatte.
Schauen wir uns nun die Definition der veralteten Energieeinheit Kilokalorie an:
1 Kilokalorie ist die Energiemenge, die man benötigt, um 1 Liter bzw. 1 kg Wasser von 14,5 ºC auf 15,5 ºC zu erwärmen.
Diese Definition ist recht leicht zu verstehen, zumal sie auch die Grundlage der Energiemessung von Nährstoffen und anderen chemischen Verbindungen ist.
Die Temperaturangabe "von 14,5 ºC auf 15,5 ºC" ist wichtig, weil "sich die zur Erwärmung von je 1 g Wasser nötigen Wärmemengen bei höheren oder niedrigeren Temperaturen etwas ändern" (Römpp Chemie Lexikon, Stichwort "Kalorie").
Mit dieser Einheit darf man eigentlich nicht mehr arbeiten, stattdessen soll man nur noch mit Joule und Kilojoule rechnen. Aber man kann die Kilokalorien sehr leicht in Kilojoule umrechnen:
1 kcal = 4,184 kJ
Für das tägliche Leben reicht es auch aus, wenn man sich den Faktor 4,2 merkt, 1 kcal = 4,2 kJ. Und wenn man gerade keinen Taschenrechner oder die Rechner-App zur Hand hat, kann man zur Not auch einfach mit 4 multiplizieren (und dann vielleicht aufrunden).
Auf dieser schönen Webseite können Sie Ihren Kalorienbedarf selbst berechnen!
Kalorimeter
Wie misst man nun den Energiegehalt eines Lebensmittels?
In ein Gerät, das den leicht zu merkenden Namen Kalorimeter trägt, gibt man eine genau abgewogene Menge des Nährstoffs, zum Beispiel 0,1 g Glucose. In einer komplett von Wasser umgebenen Kammer wird dieser Nährstoff dann verbrannt. Damit das leichter geht, ist diese Kammer mit reinem Sauerstoff gefüllt. Ein einziger Funke der elektrischen Zündung reicht, und der Nährstoff brennt. Die bei dieser vollständigen Verbrennung freigesetzte Reaktionsenergie wird in das umgebende Wasser geleitet. Und dann macht man sich die Definition der Kalorie zunutze. Man misst genau, wie stark sich das Wasser durch diese Verbrennung erwärmt. Wie diese Berechnung genau funktioniert, muss uns hier nicht weiter interessieren. Das Grundprinzip sollte jetzt jedoch klar geworden sein.
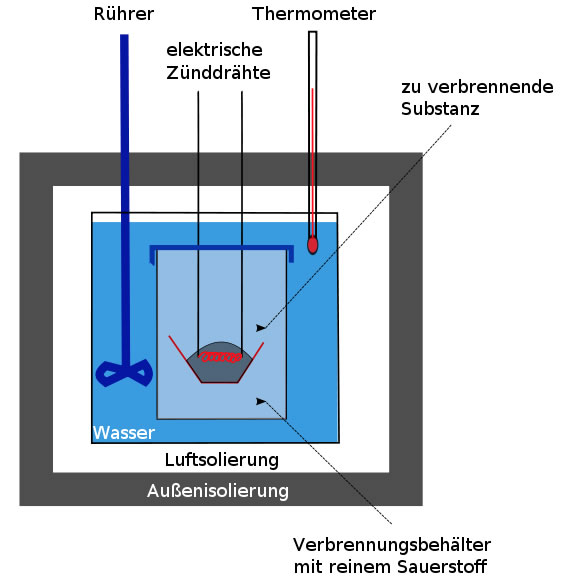
Einfache Skizze eines Bombenkalorimeters.
Eine public-domain-Zeichnung des Users Lanzi. Aus dem Wikipedia-Artikel Bombenkalorimeter.
Physikalische Brennwerte
Wenn man 1 g Kohlenhydrat in einem solchen Kalorimeter verbrennt, kann man eine Energieabgabe von genau 17,2 kJ messen. Bei 1 g Eiweiß (Protein) erhält man 23,4 kJ, und bei 1 g Fett sogar 38,9 kJ. Fett ist von den drei Nährstoffen also der energiereichste.
Physikalischer Brennwert = die Energiemenge, die bei der Verbrennung von 1 g der Verbindung freigesetzt wird.
Bei diesen Werten handelt es sich natürlich um Durchschnittswerte, die in vielen Hundert Einzelversuchen ermittelt worden sind. Die Brennwerte der verschiedenen Kohlenhydrate unterscheiden sich leicht voneinander, ebenso die Brennwerte der verschiedenen Eiweiße und Fette. Alkohol hat ebenfalls einen nicht zu vernachlässigenden Brennwert, nämlich 29,0 kJ/g.
Physiologische Brennwerte
In den Nährwerttabellen, in denen man so gerne nachschaut, ob man sich das Stück Torte noch leisten kann, sind ebenfalls Brennwerte für die Lebensmittel angegeben. Allerdings findet man hier nicht die physikalischen Brennwerte, sondern die physiologischen Brennwerte. Die physiologischen Brennwerte sind stets geringer als die physikalischen, weil bei der Verwertung der aufgenommenen Nahrung immer Verluste entstehen, teils durch die Kotbildung, teils durch die Harnbildung, teils durch die Entstehung von Wärme bei der Verdauung. Einzelheiten hierzu siehe "Stufen der Energieverwertung".
Bei Kohlenhydraten und Fetten entsprechen die physiologischen Brennwerte ungefähr den physikalischen. Die Zellen unseres Körpers verbrennen Kohlenhydrate und Fette nahezu vollständig zu Kohlendioxid und Wasser - ähnlich wie bei der Verbrennung in einem Kalorimeter.
Bei den Proteinen sieht es aber etwas anderes aus. Proteine werden nicht zu 100% zu Kohlendioxid und Wasser verbrannt, sondern bei der Oxidation der Proteine entstehen auch andere organische Verbindungen, die selbst noch einen gewissen Brennwert haben. Schuld daran ist vor allem der Stickstoff, der in den Aminosäuren der Proteine enthalten ist; Stickstoff kann nicht so leicht oxidiert werden.
Der physiologische Brennwert von Proteinen ist also geringer als der physikalische Brennwert. Im Kalorimeter werden Proteine zu 100% verbrannt, im menschlichen Körper aber nicht. Der physiologische Brennwert von Proteinen liegt daher bei 17 kJ/g, also ungefähr in der Größenordnung der Kohlenhydrate.
Physiologische Brennwerte
- Kohlenhydrate: 17,2 kJ/g
- Proteine: 17,2 kJ/g
- Fette: 37 kJ/g
Diese Werte sollte man am besten auswendig lernen, sie werden bei der Analyse von Lebensmitteln und Tagesplänen in der Schule immer wieder benötigt.
Bei dem Brennwert von Fetten muss man etwas aufpassen. In einigen Büchern wird der Brennwert von Fetten mit 38,9 kJ/g angegeben. Das ist aber anscheinend der physikalische Brennwert. Der physiologische Brennwert von Fetten liegt laut Schlieper bei 37,0 kJ/g. Demnach werden auch die Fette nicht zu 100% in unserem Körper verwertet.
Die Hölle des Gummibären
Den Brennwert von Lebensmitteln kann man sehr schön mit dem eindrucksvollen Versuch "Die Hölle des Gummibären" demonstrieren, von dem es auf YouTube jede Menge Videos gibt. Besonders gut gefallen hat mir dieses Video.
Zum Versuch: Ein schwer schmelzbares Reagenzglas wird mit Kaliumchlorat gefüllt (ca. 2 cm hoch), welches dann mit dem Brenner zum Schmelzen gebracht wird (Abzug, Schutzscheibe, kann sehr gefährlich sein!). Ist das Kaliumchlorat flüssig, wird ein Gummibärchen in das Reagenzglas gegeben.
Nach einer kurzen Verzögerung von vielleicht 1 Sekunde beginnt eine sehr heftige chemische Reaktion (siehe Video), bei der extrem viel Verbrennungswärme abgegeben wird.