Eine Redoxreaktion ist Donator-Akzeptor-Reaktion, bei der eine Oxidation und eine Reduktion zeitgleich ablaufen. Der Begriff der Redoxreaktion wird im Chemieunterricht in drei verschiedenen Stufen eingeführt:
1. Übertragung von Sauerstoff
Redoxreaktion = Übertragung von Sauerstoff
Ein bekanntes Beispiel aus dem Chemie-Unterricht der 7. oder 8. Klasse ist die Reaktion von Kupferoxid mit elementarem Wasserstoff, bei der Wasser und metallisches Kupfer entstehen. Das Kupferoxid gibt den Sauerstoff ab, wird also reduziert, und der Wasserstoff nimmt den Sauerstoff auf, wird also oxidiert. Insgesamt findet eine Übertragung von Sauerstoff statt.
Eine noch viel spektakulärere Redoxreaktion mit Sauerstoff-Übertragung, die auch technische Bedeutung hat, ist die Thermit-Reaktion. Eisenoxid wird mit Hilfe von Aluminiumpulver zu Eisen reduziert und durch die hohe Reaktionswärme gleichzeitig zum Schmelzen gebracht, was man sich beispielsweise beim Zusammenfügen von Eisenbahnschienen zu Nutze macht:
3 FeO2 + 4 Al → 3 Fe + 2 Al2O3
2. Übertragung von Wasserstoff
Redoxreaktion = Übertragung von Wasserstoff
Dieser Begriff wird gern in der organischen Chemie sowie in der Biologie und Biochemie verwendet. Ein bekanntes Beispiel ist die Oxidation eines primären Alkohols mit Kupferoxid. Ein heißes oxidiertes Kupferblech wird in den flüssigen Alkohol gehalten, dabei wird der Alkohol zum Aldehyd oxidiert und aus dem Kupferoxid entsteht wieder reines Kupfer.
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O
Bei dieser Reaktion werden zwei Wasserstoff-Atome vom Alkohol auf das Kupferoxid übertragen, genauer gesagt, auf die Oxid-Anionen des Kupferoxids:
O2- + 2 H+ → H2O
3. Übertragung von Elektronen
Betrachten wir die Oxidation von Ethanol noch mal etwas genauer, dann stoßen wir auf einen erweiterten Redox-Begriff. Sie haben es vielleicht schon bemerkt, als Sie die letzte Reaktionsgleichung angeschaut haben: Hier werden keine Wasserstoff-Atome auf die Oxid-Anionen übertragen, sondern Protonen, also Wasserstoff-Kationen.
Das folgende Schema zeigt die Vorgänge etwas genauer:
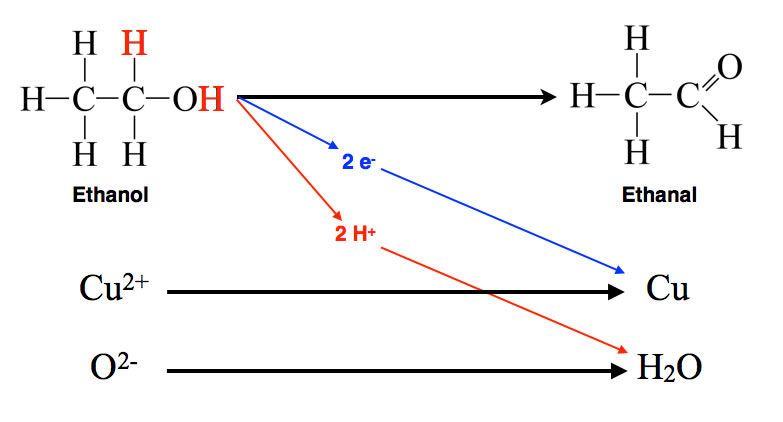
Oxidation von Ethanol durch Kupferoxid
Autor: Ulrich Helmich 2014, Lizenz: Public domain
Rein formal werden tatsächlich zwei Wasserstoff-Atome vom Ethanol auf das Kupferoxid übertragen. Bei näherer Betrachtung stimmt das allerdings nicht ganz. Jedes H-Atom wird in Form eines Elektrons und eines Protons übertragen. In der Biochemie spricht man hier auch von Reduktionsäquivalenten. Die beiden Protonen des Ethanols verbinden sich mit dem Sauerstoff-Anion des Kupferoxids, und die beiden Elektronen reduzieren die Kupfer(II)-Ionen zu metallischem Kupfer.
Ein zweites Beispiel, das Sie aus dem Schulunterricht kennen sollten, ist die Reaktion von Natrium und Chlor zu Natriumchlorid.
Bei der Bildung von Natriumchlorid (NaCl) aus den Elementen Natrium und Chlor nimmt das Chlor Elektronen auf, es wird also reduziert. Diese Elektronen werden vom Natrium "gespendet", das dabei oxidiert wird (siehe Oxidation).
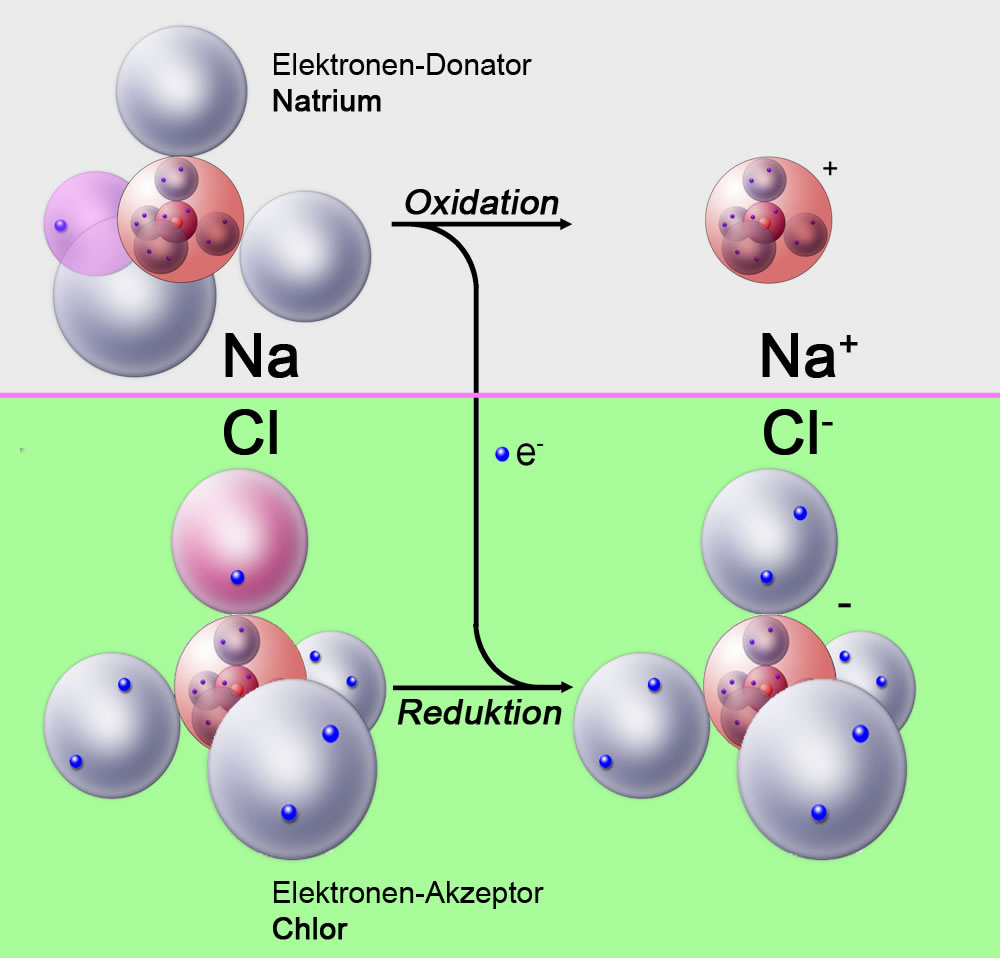
Darstellung der Reaktion von Natrium und Chlor zu Natriumchlorid nach dem Kugelwolkenmodell.
Autor: Ulrich Helmich 2014, Lizenz: Public domain
Das Natrium wirkt hier als Elektronen-Donator, während das Chlor als Elektronen-Akzeptor fungiert.
4. Zusammenfassung
Die Definition des Begriffs Redoxreaktion als Übertragung von Elektronen von einem Elektronen-Donator auf einen Elektronen-Akzeptor ist die am weitesten tragfähige Definition, die im Grunde die beiden anderen Definitionen umfasst. Alle Redoxvorgänge, auch die Übertragung von Sauerstoff oder Wasserstoff, sind Elektronenübertragungen. Für die Oxidation des Alkohols hatten wir das bereits gesehen, es werden keine H-Atome vom Alkohol auf das CuO übertragen, sondern Protonen und gleichzeitig Elektronen.
Wie sieht es nun bei der Oxidation von Magnesium aus, dem berühmten Versuch, mit dem Schüler im Anfangsunterricht für das Fach Chemie begeistert werden sollen.
Das Magnesium gibt zwei Elektronen ab, und die O2-Moleküle nehmen Elektronen auf:
Mg → Mg2+ + 2 e-
O2 + 4 e- → 2 O2-
Das ergibt dann die Gesamtgleichung
2 Mg + O2 → MgO2
Es hat also allem Anschein nach eine Übertragung von Sauerstoff stattgefunden, in Wirklichkeit steckt aber eine Elektronenübertragung hinter dieser Reaktion.