Ein Begriff aus der Elektrochemie. Unter einer Reduktion kann man folgende Vorgänge verstehen:
1. Abgabe von Sauerstoff
Reduktion = Abgabe von Sauerstoff
Ein bekanntes Beispiel aus dem Chemie-Unterricht der 7. oder 8. Klasse ist die Reaktion von Kupferoxid mit elementarem Wasserstoff, bei der Wasser und metallisches Kupfer entstehen. Dem Kupferoxid wurde durch den Wasserstoff der Sauerstoff entzogen, das Kupfer wurde reduziert (und der Wasserstoff oxidiert).
Aufnahme von Wasserstoff
Reduktion = Aufnahme von Wasserstoff
Dieser Begriff wird gern in der organischen Chemie sowie in der Biochemie verwendet. Wenn beispielsweise die Carbonylgruppe eines Ketons ein H-Atom aufnimmt und zur Hydroxygruppe wird, spricht man von einer Reduktion. Logischerweise müsste man dann auch die Addition von Wasserstoff an ein Alken als Reduktion bezeichnen.
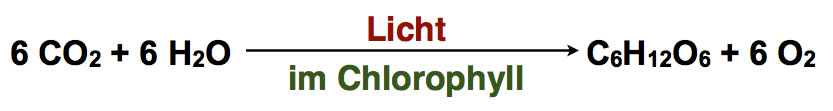
Ein für alle Pflanzen und Tiere wichtiger Reduktionsprozess ist die Photosynthese der grünen Pflanzen. Hier wird Kohlendioxid mit Hilfe von Wasserstoff zu Glucose reduziert. Der Wasserstoff wird mithilfe des Sonnenlichts aus dem Wasser freigesetzt, das die Pflanze aufnimmt.
Aufnahme von Elektronen
Reduktion = Aufnahme von Elektronen
Dieser Begriff wird meistens erst in der 8. oder 9. Klasse eingeführt, wenn man sich mit Elektrochemie beschäftigt. Die Umsetzung eines Fe3+-Salzes zu einem Fe2+-Salz oder einer Cu2+-Verbindung zu einer Cu+-Verbindung (zum Beispiel bei der FEHLING-Reaktion) kann nicht mehr mit Abgabe von Sauerstoff oder Aufnahme von Wasserstoff erklärt werden, ist aber dennoch eine Reduktion.
Bei der Bildung von Natriumchlorid (NaCl) aus den Elementen Natrium und Chlor nimmt das Chlor Elektronen auf, es wird also reduziert. Diese Elektronen werden vom Natrium "gespendet", das dabei oxidiert wird (siehe Oxidation).
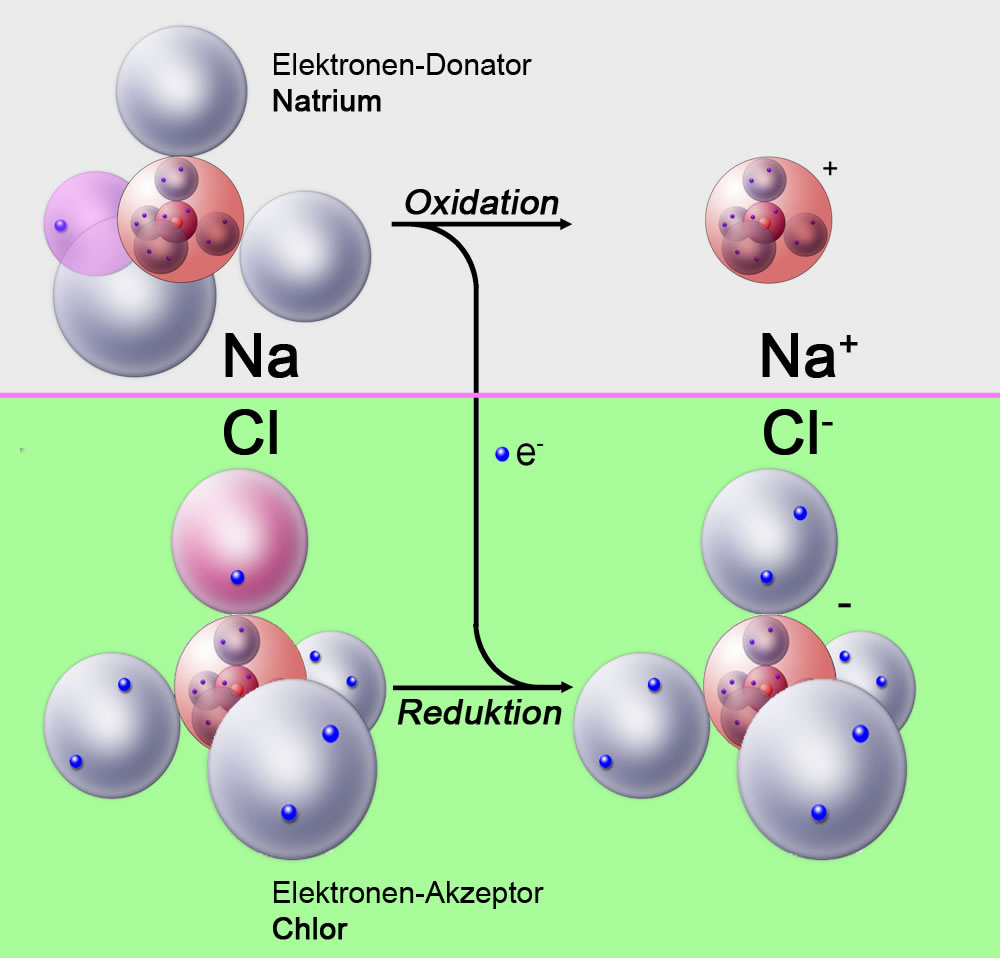
Darstellung der Reaktion von Natrium und Chlor zu Natriumchlorid nach dem Kugelwolkenmodell.
Autor: Ulrich Helmich 2014, Lizenz: Public domain