Von Ulrich Helmich, Stand: 20.10.2022
Ein einfacher Versuch
Ich beginne meinen Unterricht in der Unterrichtsreihe über Elektrochemie in der Stufe Q1 immer mit dem Eisennagel-Versuch. Er ist recht einfach durchzuführen, erlaubt aber bereits viele Einsichten in die Grundlagen der Elektrochemie.
Auf dieser Seite wird dieser zentrale Versuch beschrieben, auch die Beobachtungen sind hier zu sehen.
Kommen wir nun zur Deutung dieses Versuchs. Zunächst die einfache Deutung, wie man sie vielleicht auch schon in der Klasse 8 oder 9 besprochen hat.
Einfache Deutung (Sekundarstufe I)
Die Eisen-Atome geben zwei Elektronen an die Kupfer-Ionen ab, dabei werden die Eisen-Atome zu zweiwertig positiven Eisen-Ionen, während die zweiwertig positiven Kupfer-Ionen zu neutralen Kupfer-Atomen werden. Als Reaktionsgleichung ausgedrückt sieht das dann so aus:
$Cu^{2+}_{(aq)} + Fe_{(s)} \to Fe^{2+}_{(aq)} + Cu_{(s)}$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Es findet also eine Elektronenübertragung von den Eisen-Atomen auf die Kupfer-Ionen statt. Die Eisen-Atome geben zwei Elektronen ab, man sagt, sie werden oxidiert. Die Kupfer-Ionen nehmen die Elektronen auf, sie werden also reduziert. Die Oxidation des Eisens und die Reduktion des Kupfers laufen gleichzeitig ab, beide Reaktionen fasst man dann unter dem Begriff Redoxreaktion zusammen.
Oxidation = Abgabe von Elektronen
Reduktion = Aufnahme von Elektronen
Redoxreaktion = Übertragung von Elektronen
Wenn Sie bei dem bisher Gesagten Verständnisprobleme haben, würde ich Ihnen empfehlen, sich mal kurz auf den entsprechenden Seiten für die Sekundarstufe I umzusehen. Dort werden grundlegende Begriffe wie Oxidation, Reduktion und Redoxreaktion ausführlich erläutert, wesentlich ausführlicher zumindest als hier.
Präzisere Deutung (Sekundarstufe II)
Die Rolle der Eisen-Atome
Betrachten wir zunächst die Reaktion der Eisen-Atome. Einige Eisen-Atome in der Außenfläche des Eisennagels "lösen" sich in der Flüssigkeit auf.
Warum machen die Eisen-Atome das überhaupt, könnte man sich fragen. Um diese Frage zu klären, muss man etwas weiter ausholen. Warum löst sich ein Stück Zucker auf, wenn man es in ein Glas mit Wasser gibt? Eine wichtige Triebkraft für chemische Reaktionen ist die Zunahme der Entropie (Unordnung). Ein Stück Würfelzucker stellt einen Zustand hoher Ordnung (geringer Entropie) dar. Lösen sich die Zucker-Moleküle jedoch in Wasser, so nimmt die Unordnung zu. Ähnlich ist es mit dem Eisennagel. Der Zustand des festen Eisens Fe(s) stellt einen Zustand extrem hoher Ordnung dar. Lösen sich Eisen-Teilchen jedoch im Wasser, wo sie ungeordnet hin- und her diffundieren können, ist das ein Zustand hoher Unordnung bzw. großer Entropie. Solche entropiereichen Zustände werden in der Natur immer angestrebt; es gibt sogar einen Hauptsatz der Thermodynamik, der genau dies besagt.
Allerdings gibt es einen Preis, den die Eisen-Atome bezahlen müssen, wenn sie sich im Wasser lösen wollen: Sie müssen ihre Außenelektronen abgeben:
$Fe_{(s)}\to Fe^{2+}_{(aq)}+ 2 e^{-} $
Die so entstandenen Eisen-Ionen sind jetzt in der Lage, im Wasser eine Hydrathülle zu bilden, was im Prinzip ein exothermer Vorgang ist. Der "Preis", den die Eisen-Atome zahlen müssen, ist also in Wirklichkeit eine Investition. Durch die Bildung der Hydrathüllen wird recht viel Energie gewonnen. Neben der Entropiezunahme durch den Übergang Fe(s) --> Fe2+(aq) ist dieser Energiegewinn (Hydrationsenthalpie) die zweite Triebkraft für die Oxidation der Eisen-Atome.
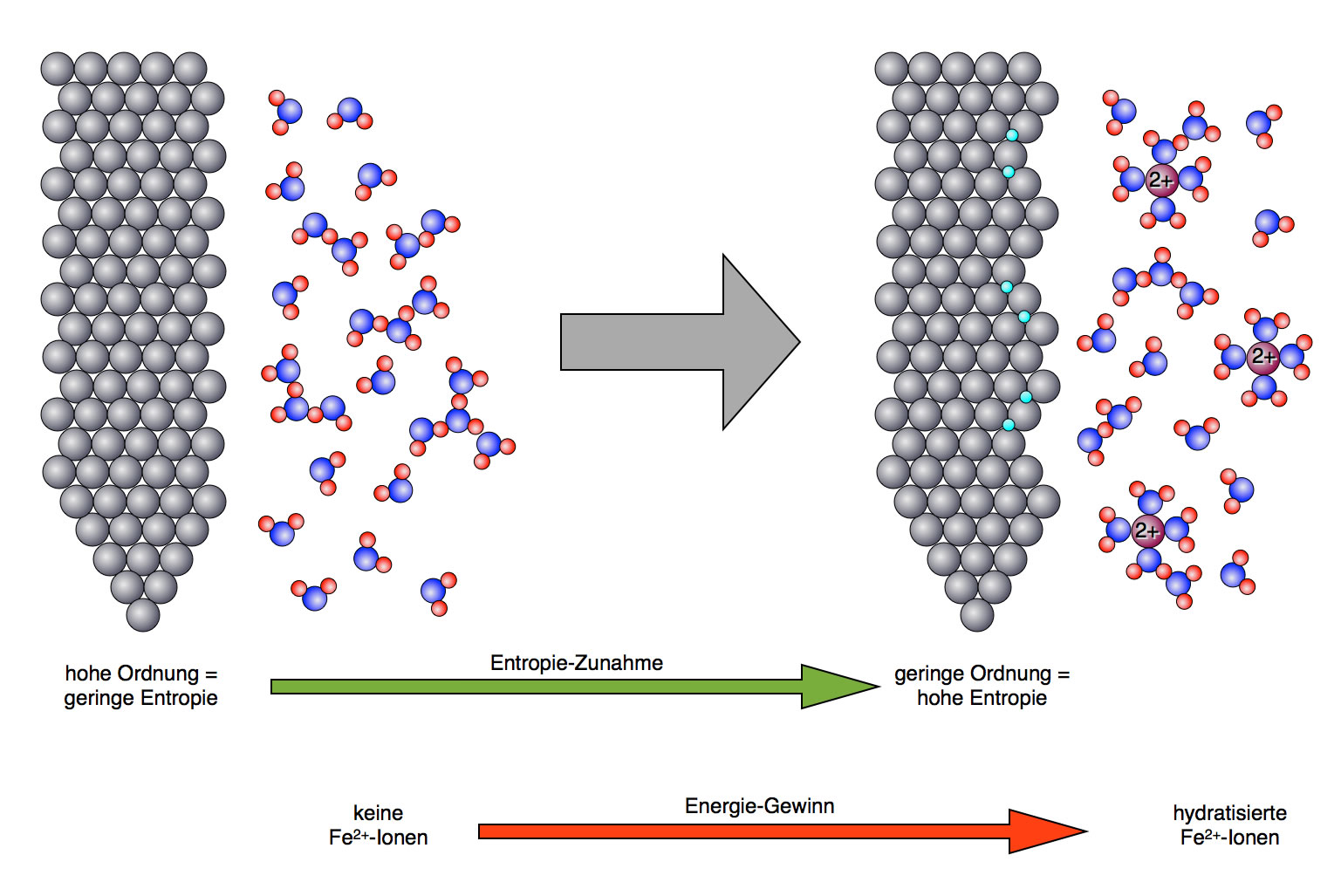
Der Eisennagel gibt Fe2+-Ionen an das Wasser ab
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Der Eisennagel gibt Fe2+-Ionen an das Wasser ab. Zwei Triebkräfte sind hierfür verantwortlich. Erstens die Zunahme der Entropie (der in Wasser gelöste Zustand ist "unordentlicher" als der Zustand der Fe-Atome im festen Metallgitter), zweitens die Hydratisierung der Fe2+-Ionen.
Merke:
Die Triebkräfte für das "Auflösen" des Eisens im Wasser sind:
a) Die Zunahme der Entropie.
b) Die exotherme Bildung von Hydrathüllen.
Die Rolle der Kupfer-Ionen
Allerdings können Eisen-Atome nur dann Elektronen abgeben, wenn Teilchen vorhanden sind, die in der Lage sind, Elektronen aufzunehmen. Solche Teilchen werden in der Chemie als Elektronen-Akzeptoren bezeichnet. Entsprechend sind die Eisen-Atome dann Elektronen-Donatoren.
Das Donator-Akzeptor-Prinzip
So etwas Ähnliches haben Sie vielleicht schon bei der Behandlung von Säure-Base-Reaktionen kennen gelernt: Wenn eine Säure Protonen abgeben will, muss eine Base in der Nähe sein, die bereit ist, diese Protonen aufzunehmen.
Säure-Base-Reaktionen und Redoxreaktionen sind zwei wichtige Beispiele für das Donator-Akzeptor-Prinzip. Im ersten Fall werden Protonen übertragen, im zweiten Fall Elektronen.
Als Elektronen-Akzeptoren treten nun die zweiwertig positiven Kupfer-Ionen auf:
$Cu^{2+}_{(aq)} + 2 e^{-} \to Cu_{(s)}$
Redoxreaktion
Wenn wir die beiden bisher behandelten Reaktionsgleichungen - die Oxidation des Eisens und die Reduktion des Kupfers - zusammenfassen, erhalten wir folgende Gleichung:
$Cu^{2+}_{(aq)} + Fe_{(s)} \rightleftharpoons Fe^{2+}_{(aq)} + Cu_{(s)}$
Im Prinzip kann die Reaktion in beide Richtungen ablaufen, es ist ja eine Gleichgewichtsreaktion. Allerdings liegt aus energetischen Gründen das chemische Gleichgewicht der Reaktion auf der rechten Seite. Das Eisen ist ein unedleres Metall als das Kupfer, gibt daher seine Elektronen leichter ab.
Zusammenfassung
Beim Eisennagel-Versuch geben die Eisen-Atome des Eisnenagels ihre Elektronen ab und werden zu Eisen-Ionen. Die Kupfer-Ionen der Kupfersulfat-Lösung nehmen diese Elektronen auf und werden zu Kupfer-Atomen. Das Kupfer bildet dann die braune Schicht auf dem Eisennagel.
Bei dieser Reaktion handelt es sich um eine Elektronenübertragungs-Reaktion, die nach dem Donator-Akzeptor-Prinzip abläuft. Eisen ist hier der Elektronen-Donator, die Kupfer-Ionen sind die Elektronen-Akzeptoren.