Von dieser Seite gibt es auch eine einfachere Version!
Ein klassischer Versuch
Die Verbrennung von Magnesium ist ein sehr beliebter und bekannter Versuch. Schauen wir uns diesen Versuch doch einmal genauer an.
Schau die zunächst diese Seite mit dem Versuch an. Die Erklärungen dazu findest du dann im folgenden Text.
Ein schöner kleiner Film auf YouTube zeigt den Versuch recht eindrucksvoll. Leider kann man das Reaktionsprodukt am Ende nicht so gut sehen, weil der Lehrer vergessen hat, die Kamera darauf zu richten.
Die Reaktionsgleichung für diesen Versuch ist recht einfach aufzuschreiben:
$2 \ Mg + O_2 \to 2 \ MgO$
Einfacher geht es fast nicht! Im Magnesiumoxid liegen die Mg-Atome als Mg2+-Kationen vor, und die O-Atome als O2--Anionen. Dass es sich bei dieser Reaktion um eine Oxidation handelt, ist ja wohl klar: Aufnahme von Sauerstoff. Und dass die Reaktion sehr exotherm verläuft, sollte auch jeder verstanden haben, der die Reaktion mal im Unterricht oder auf YouTube gesehen hat.
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Die Verbrennung von Magnesium ist eine stark exotherme Oxidationsreaktion.
Solche Versuche wir die Verbrennung von Magnesium, Eisen oder Kupfer werden - zumindest in NRW - schon im Chemieunterricht der 7. Klassen durchgeführt. In dieser Jahrgangsstufe lernt man auch den "klassischen" Oxidationsbegriff kennen:
Oxidation = Aufnahme von Sauerstoff bzw. Reaktion mit Sauerstoff.
Wir wollen jetzt aber diesen einfachen Oxidationsbegriff etwas erweitern. Dazu schauen wir uns den nächsten Versuch an.
Schau dir die Versuchsanleitung und die Beobachtungen an, die Erklärungen kommen dann auf dieser Seite.
Bei diesem Versuch entsteht zunächst noch etwas grau-weißes Magnesiumoxid.
$2 \ Mg + O_2 \to 2 \ MgO$
Nachdem der Sauerstoff im Becherglas aufgebraucht ist, reagiert das Magnesium mit dem Luftstickstoff N2 zu grau-grünem Magnesiumnitrid Mg3N2.
$3 \ Mg + N_2 \to Mg_3N_2$
Im Prinzip läuft diese Reaktion ähnlich ab wie die Reaktion zwischen Magnesium und Sauerstoff, nur dass sich das Magnesium nicht mit Sauerstoff verbindet, sondern mit Stickstoff.
Aller guten Dinge sind drei, wie man so sagt, und deshalb schauen wir uns auch noch einen dritten Versuch an. Diesmal lassen wir Eisen mit Chlor reagieren.
Die Reaktion von Magnesium mit Chlor ist für einen Schulversuch doch etwas zu gefährlich - obwohl, ich selbst habe sie auch schon ein- oder zweimal durchgeführt und es ist nichts Schlimmes dabei passiert, außer dass vielleicht mal ein Standzylinder draufgegangen ist, weil die Hitze doch zu groß war.
Schau dir die Versuchsanleitung und die Beobachtungen an, die Erklärungen kommen dann auf dieser Seite.
Diesen Versuch kann man sich sehr schön auf YouTube ansehen. Das Schöne an diesem Video ist, dass es überhaupt nicht kommentiert wird, auch keine nervige Musik ist zu hören, nur die Reaktion ist gut zu sehen.
Genau so stellt sich der Laie Chemie vor: Dicker brauner Rauch, der im Zylinder wabbert…
Die Deutung dieses Versuchs ist auf den ersten Blick auch nicht besonders schwer: Das Eisen reagiert mit dem Chlor zu Eisen(III)chlorid FeCl3.
$2 \ Fe + 3 \ Cl_2 \to 2 \ FeCl_3$
Auch diese exotherme Reaktion läuft im Prinzip nach dem gleichen Schema ab wie die Reaktion von Magnesium mit Sauerstoff und Stickstoff. Auch die Umsetzung von Blei mit Brom oder von Zink mit Iod würde nach dem gleichen Prinzip ablaufen. Hier die Reaktion von Zink mit Iod, die man auch gut im Unterricht durchführen kann:
$Zn + I_2 \to ZnI_2$
Ein neuer Oxidationsbegriff
Was haben nun all diese hier aufgeführten exothermen Reaktionen gemein? Ein Metall reagiert mit einem Nichtmetall zu einem Salz. Wenn es sich bei dem Nichtmetall um Sauerstoff handelt, sprechen wir von einer klassischen Oxidation. Das Adjektiv "klassisch" deutet es aber schon an: Neben der klassischen Oxidation mit Sauerstoff scheint es auch andere Arten der Oxidation zu geben. Und tatsächlich, alle auf dieser Seite beschriebenen chemischen Reaktionen sind Oxidationen im weiteren Sinne.
Wir müssen also den alten bzw. klassischen Oxidationsbegriff erweitern / ergänzen / verändern, so dass er auch zu den anderen hier beschriebenen Reaktionen passt.
Die Teilreaktion der Metalle
Wir verlassen nun den klassischen Oxidationsbegriff und führen mal einen völlig anderen, neuen Oxidationsbegriff ein:
Oxidation = Abgabe von Elektronen.
Das klingt auf den ersten Blick etwas eigenartig und ungewöhnlich, aber das ist ja das Schöne an der Chemie, stets passiert etwas Eigenartiges und Ungewöhnliches, das nur darauf wartet, erklärt zu werden.
Schauen wir uns jetzt doch einmal genau an, was eigentlich mit den Metall-Atomen passiert, wenn sie mit Sauerstoff, Stickstoff, Chlor, Brom oder einem anderen Nichtmetall reagieren.
$Mg \to Mg^{2+} + 2 \ e^{-}$
$Fe \to Fe^{3+} + 3 \ e^{-}$
$Zn \to Zn^{2+} + 2 \ e^{-}$
Bei den Reaktionen geben die Metall-Atome ihre Außenelektronen ab. Warum sie das machen, haben wir bereits bei der Behandlung der Themen "Atombau" und "Ionenbindung" gesehen. Die Atome "wollen" eine voll besetzte Außenschale haben (Oktettregel!). Dann befinden sie sich nämlich in einem Edelgaszustand.
Kritiker könnten nun einwenden: Moment mal, das Entfernen eines Elektrons aus der Außenhülle kostet aber ziemlich viel Energie und sollte daher nicht freiwillig ablaufen. Tatsächlich ist die Ionisierungsenergie der Atome nicht zu vernachlässigen. Reines Magnesium oder reines Eisen geben tatsächlich ihre Außenelektronen nicht einfach so ab.
Die Teilreaktion der Nichtmetalle
Auch die Nichtmetall-Atome Sauerstoff, Stickstoff, Chlor oder Brom wollen eine voll besetzte Außenschale haben und nehmen dafür "gern" Elektronen auf (und schon wieder die Oktettregel!).
Betrachten wir die entsprechenden Reaktionsgleichungen einmal näher:
$O_2 + 4 \ e^{-} \to 2 \ O^{2-}$
$N_2 + 6 \ e^{-} \to 2 \ N^{3-}$
$Cl_2 + 2 \ e^{-} \to 2 \ Cl^{-}$
$Br_2 + 2 \ e^{-} \to 2 \ Br^{-}$
Diese Aufnahme von Elektronen ist nun das genau Gegenteil der Abgabe von Elektronen. Bei der Abgabe von Elektronen musste Ionisierungsenergie aufgewandt werden (endotherm!), daher wird bei der Aufnahme von Elektronen Energie freigesetzt (exotherm!). Diese Elektronenaufnahme wird übrigens jetzt als Reduktion bezeichnet.
Reduktion = Aufnahme von Elektronen.
Reaktion von Magnesium mit Sauerstoff
Kommen wir nun auf den ersten Versuch zurück, die Reaktion von Magnesium mit Sauerstoff, die ja eine klassische Oxidation ist. Wir schreiben jetzt die Gleichungen für die Oxidation des Magnesiums und die Reduktion des Sauerstoffs untereinander:
$Mg \to Mg^{2+} + 2 \ e^{-}$
$O_2 + 4 \ e^{-} \to 2 \ O^{2-}$
Jedes Mg-Atom gibt zwei Elektronen ab, ein O2-Molekül nimmt jedoch vier Elektronen auf. Wir brauchen also jeweils zwei Mg-Atome, um den Elektronenbedarf eines O2-Moleküls zu decken. Daher multiplizieren wir die obere Reaktionsgleichung einfach mit dem Faktor 2:
$2 \ Mg \to 2 \ Mg^{2+} + 4 \ e^{-}$
$O_2 + 4 \ e^{-} \to 2 \ O^{2-}$
Jetzt passen die Elektronenzahlen der Oxidation und der Reduktion zueinander. Wir können die beiden Reaktionsgleichungen nun addieren und erhalten eine neue Gleichung:
$2 \ Mg + O_2 \to 2 \ Mg^{2+} + 2 \ O^{2-}$
Wenn man das Ganze schön säuberlich in seinem gut gepflegten Chemieheft aufschreibt, könnte das ungefähr so aussehen:
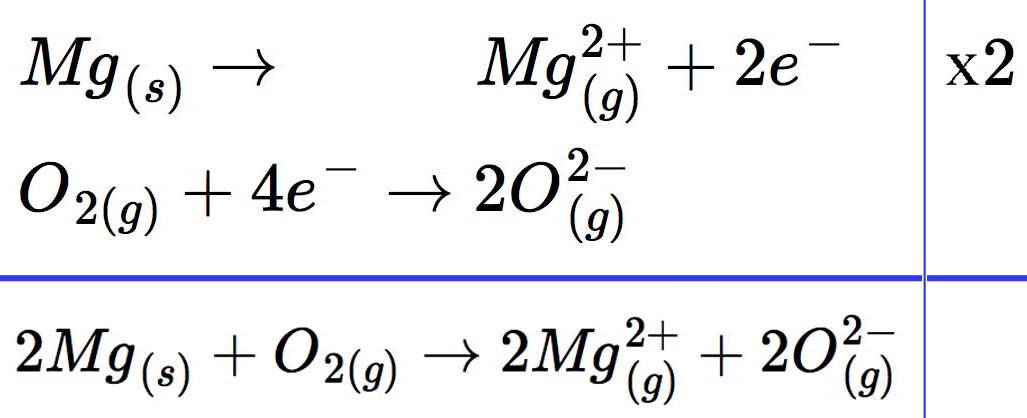
Unser Musterschüler hat hier sogar die Aggregatzustände der Atome und Ionen berücksichtigt, was ihm gleich drei Punkte mehr für seine Hausaufgabe bringt. Notwendig ist das in der Sekundarstufe 1 nach dem aktuellen Kernlehrplan NRW nicht mehr.
Vier neue Fachbegriffe
Jetzt kommen vier neue Fachbegriffe:
- Elektronendonator
- Elektronenakzeptor
- Elektronentransfer
- Redoxreaktion
Das Magnesium ist hier der Elektronendonator, weil die Mg-Atome Elektronen abgeben. Die Sauerstoff-Moleküle sind die Elektronenakzeptoren, sie nehmen die Elektronen ja auf. Und der ganze Vorgang ist ein Elektronentransfer. Elektronen werden vom Magnesium auf den Sauerstoff übertragen. Einen solchen Elektronentransfer bezeichnen wir übrigens von jetzt an als Redoxreaktion.
Redoxreaktion = Elektronentransfer von einem Elektronendonator auf einen Elektronenakzeptor.
Die anderen Redoxreaktionen
Auch die anderen hier besprochenen Reaktionen sind solche Redoxreaktionen. Betrachten wir doch einmal die Umsetzung von Magnesium mit Stickstoff. Wir schreiben diese Reaktion dabei genau so auf wie unser Musterschüler das mit der Umsetzung von Magnesium mit Sauerstoff gemacht hat:
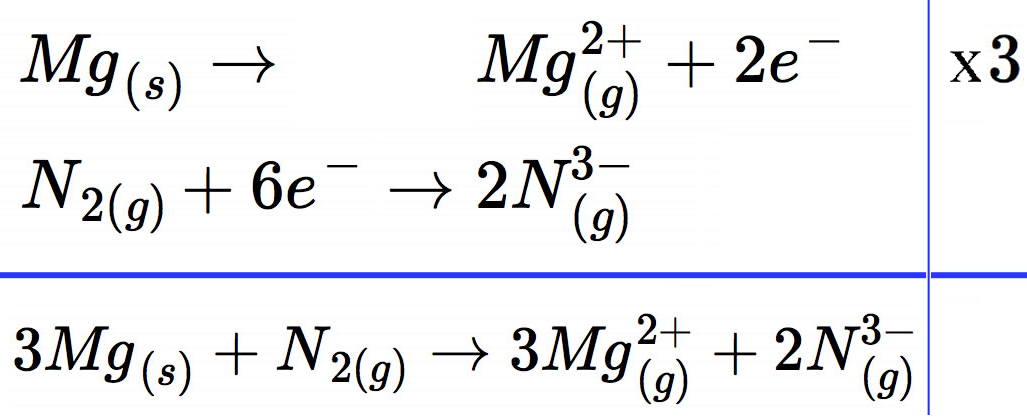
Die obere Gleichung muss mit dem Faktor 3 multipliziert werden, damit insgesamt die sechs Elektronen freigesetzt werden, die für die untere Gleichung benötigt werden. Dann kann man beide Gleichungen addieren und erhält die Gesamtreaktion. Die gasförmigen Ionen vereinigen sich dann zum festen Magnesiumnitrid Mg3N2.
Reaktion von Eisen mit Chlor
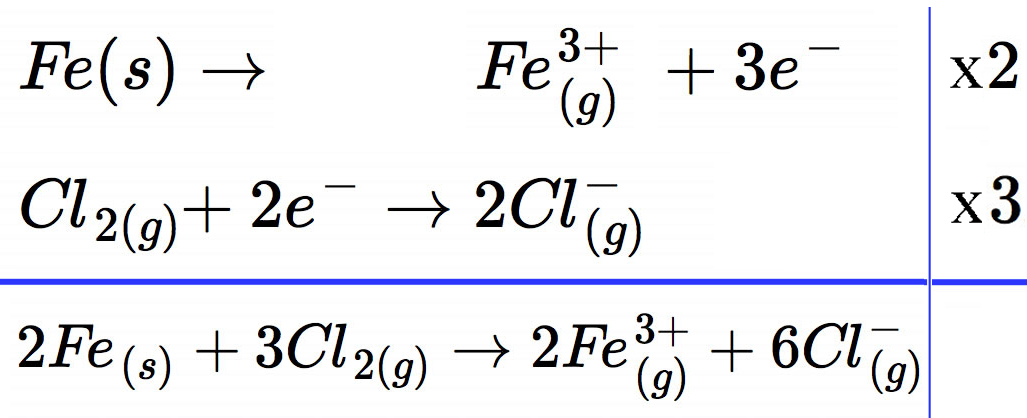
Die obere Gleichung muss mit dem Faktor 2 multipliziert werden, die zweite Gleichung mit dem Faktor 3; dann enthält jede Gleichung genau gleich viele, nämlich sechs Elektronen. Die gasförmigen Ionen vereinigen sich dann zum festen Eisen(III)chlorid FeCl3.
Redoxreaktionen
Fassen wir das ganze bisher Gesagte zu einem kurzen Merktext zusammen:
Merke:
Salzbildungsreaktionen und viele andere chemische Reaktionen sind mit der Übertragung von Elektronen verbunden. Die Elektronen werden von einem Elektronendonator auf einen Elektronenakzeptor übertragen. Die Abgabe der Elektronen wird dabei als Oxidation bezeichnet, die Aufnahme der Elektronen als Reduktion. Die Übertragung der Elektronen wird als Redoxreaktion bezeichnet. Redoxreaktionen gehorchen dem allgemeinen Donator-Akzeptor-Prinzip.
Seitenanfang -
Redoxreaktionen -
Redoxreihe der Metalle -
Elektrolysen