Dieses Wort könnte man mit "Spiegelbildlichkeit" übersetzen.
"...die Eigenschaft eines Objektes, sich von seinem Spiegelbild zu unterscheiden." [1]Ein bekanntes Beispiel aus dem Alltag sind die beiden Hände eines Menschen, die linke Hand unterscheidet sich von ihrem Spiegelbild, der rechten Hand. Dieses Beispiel ist übrigens auch für den Begriff "Chiralität" verantwortlich, denn "Hand" heißt auf griechisch "cheir".
Anwendung findet dieser Begriff in der Stereochemie. Enantiomere sind Stereoisomere, die sich wie Bild und Spiegelbild verhalten. Verantwortlich für eine solche Chiralität sind sogenannte chirale C-Atome.
Chirale C-Atome
Unter diesem Begriff versteht man Kohlenstoff-Atome, an denen vier verschiedene Substituenten sitzen. Betrachten wir dazu folgendes Bild:
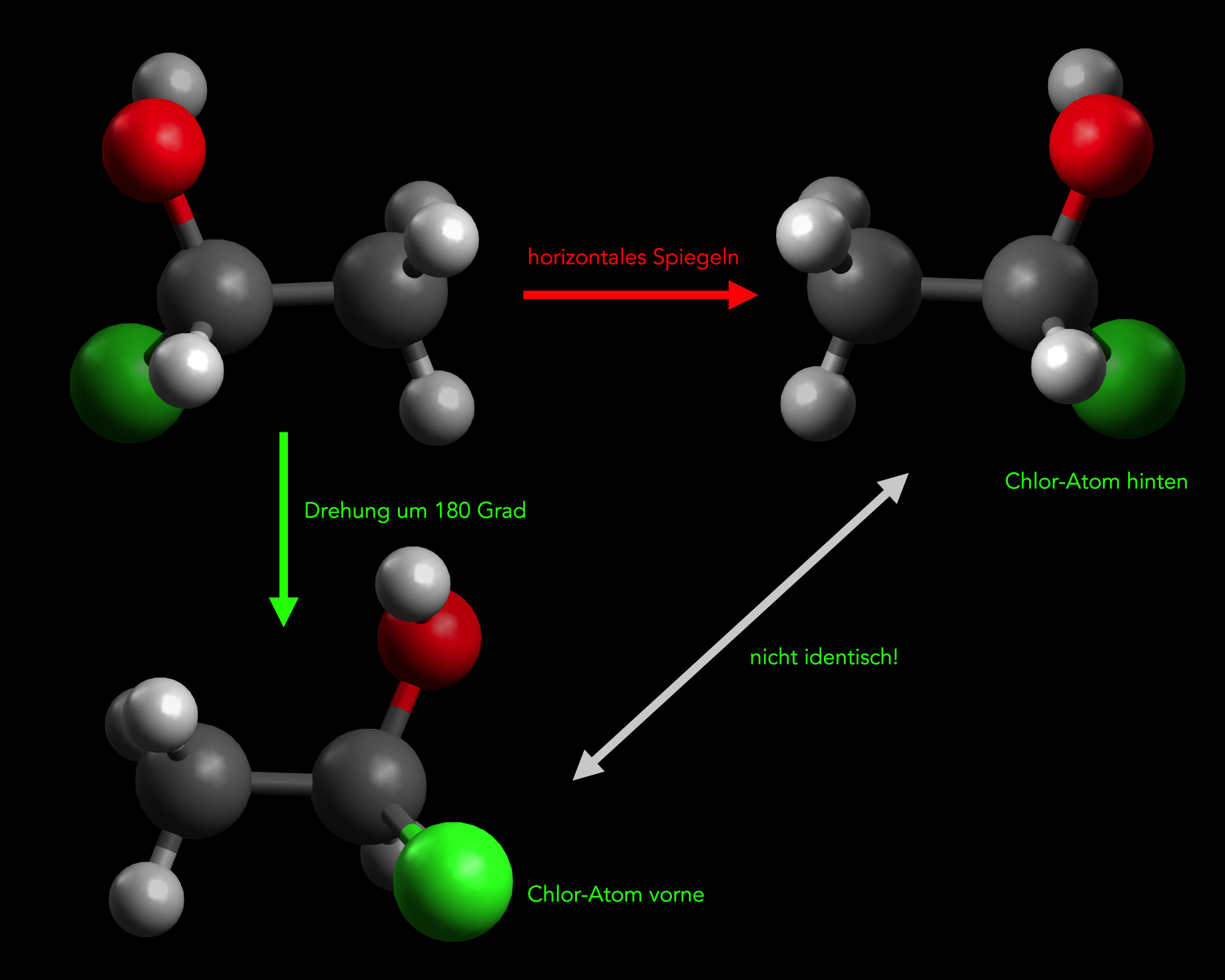
Zwei Enantiomere der Verbindung 1-Chlor-ethan-1-ol
Das links oben dargestellte Molekül der Verbindung 1-Chlor-ethan-1-ol hat ein solches chirales C-Atom, nämlich dasjenige C-Atom mit vier verschiedenen Substituenten:
- Chlor-Atom
- OH-Gruppe
- H-Atom
- Methyl-Gruppe
Ein C-Atom mit vier verschiedenen Substituenten wird als chirales C-Atom bezeichnet. Und wenn eine Verbindung solche chiralen C-Atome enthält, dann existieren auch zwei Enantiomere (Spiegelbild-Isomere) dieser Verbindung.
Die Abbildung zeigt rechts oben das Spiegelbild des linken Moleküls. Nun wird versucht, das ursprüngliche Molekül (links oben) durch Drehung um 180 Grad in das Spiegelbild zu verwandeln. Das gelingt aber nicht vollständig, wie man unten links in der Abbildung sieht. Zwar befindet sich das rot gekennzeichnete Sauerstoff-Atom nun ebenfalls oben rechts - genau wie im Spiegelbild, aber das Chlor-Atom sitzt rechts vorn und nicht rechts hinten wie beim Spiegelbild. Also unterscheiden sich die beiden Strukturen. Es ist nicht gelungen, das ursprüngliche Moleküle durch einfaches Drehen in das Spiegelbild des Moleküls umzuwandeln.
Wenn Sie mehr zur Spiegelbild-Isomerie und vor allem zur Nomenklatur der verschiedenen Stereoisomere wissen möchten, gehen Sie auf diese Lexikon-Seite.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992