Lösungen der Aufgaben
Auf dieser Seite finden Sie die Lösungen der Aufgaben zur radikalischen Chlorierung bzw. Bromierung.
Aufgaben
Aufgabe 1
Erklären Sie die Tatsache, dass bei der Bromierung von Methan auch geringe Spuren von Brom-ethan als Nebenprodukt auftreten.
Lösung:
Bei einer der Abbruchreaktionen treffen zwei Methyl-Radikale aufeinander und bilden ein Ethan-Molekül. Zwar ist die Wahrscheinlichkeit für einen solchen Zusammenstoß extrem gering, es kommt aber trotzdem ab und zu vor.
Aufgabe 2
Für diese Aufgabe benötigen Sie die beiden Tabellen mit den Bindungsdissoziationsenergie.
Berechnen Sie die Energiebilanz der Hexan-Bromierung
a) Für den Fall, dass ein primäres H-Atom substituiert wird,
b) für den Fall, dass ein sekundäres H-Atom substituiert wird.
Tipp: Auf der Seite "Bindungsdissoziationsenergie" finden Sie zwei Tabellen. Sie müssen für diese Aufgabe beide Tabellen heranziehen!
Lösung:
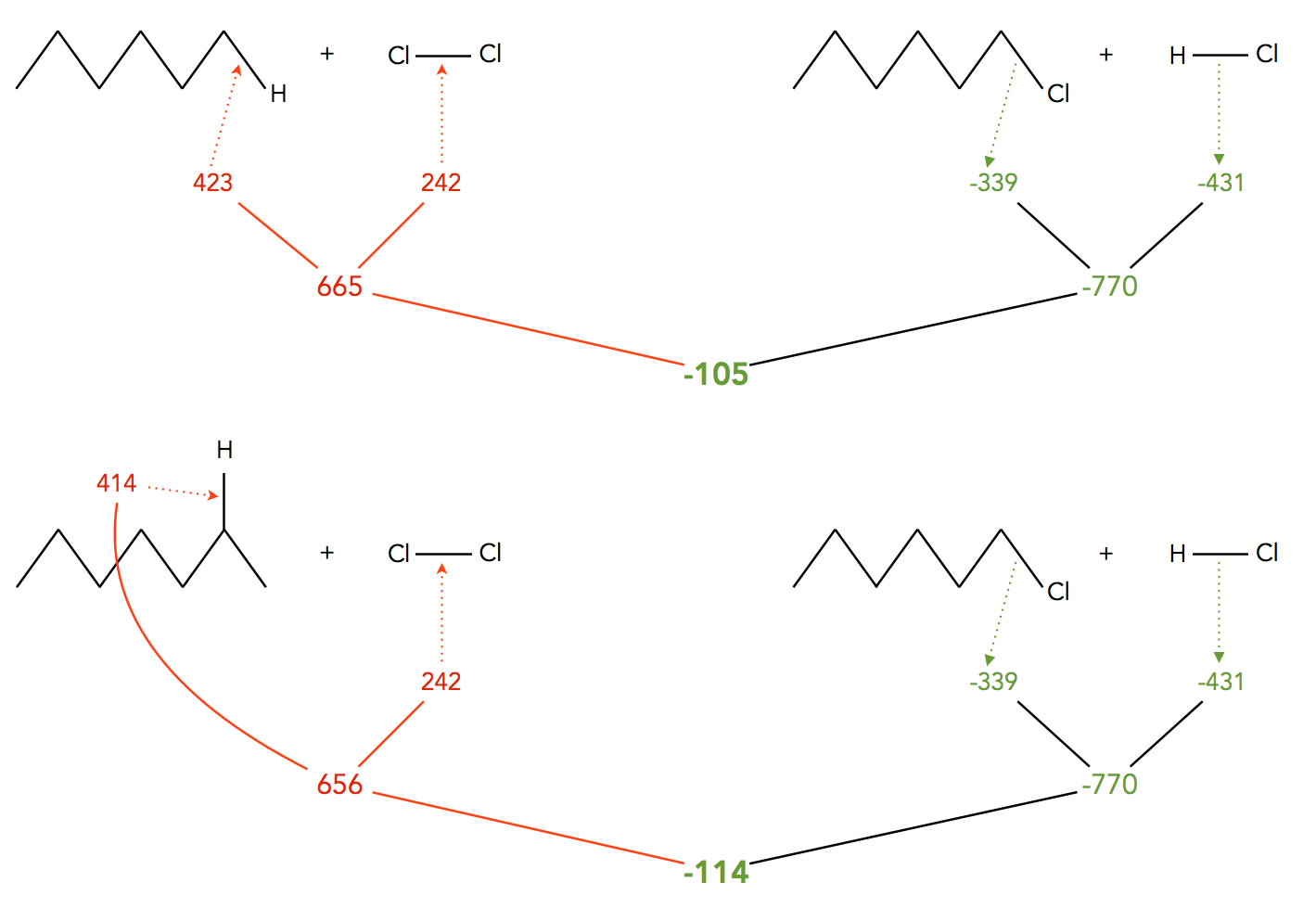
Graphik zu den Energieumsetzungen der Hexan-Chlorierung. Zahlen = kJ/mol.
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Wenn ein primäres H-Atom substituiert wird, müssen für die Trennung der C-H-Bindung 423 kJ/mol an Bindungsdissoziationsenergie aufgewandt werden (Tabelle 2, Zeile 2) auf der Lexikon-Seite "Bindungsdissoziationsenergie". Wie man aus dem Schema in der Abbildung sieht, ist die Chlorierung exotherm, die Reaktionsenthalpie beträgt -105 kJ/mol.
Wird ein sekundäres H-Atom substituiert, muss etwas weniger Bindungsdissoziationsenergie "hineingesteckt" werden, nämlich nur 414 kJ/mol. Dadurch verbessert sich die Energiebilanz auf -114 kJ/mol.
Thermodynamisch gesehen ist also die Substitution eines sekundären H-Atoms durch ein Chlor-Atom günstiger als die Substitution eines primären H-Atoms.
Aufgabe 3
Begründen Sie, wieso die Reaktionsenthalpie der Startreaktion sowie der Kettenabbruchreaktionen bei der Berechnung der Gesamtenergiebilanz keine Rolle spielen.
Lösung:
Bei der Halogenierung von Alkanen handelt es sich um Kettenreaktionen. Nachdem die Startreaktion einmal stattgefunden hat, laufen viele Tausend Kettenschritte ab. Irgendwann kann es dann zu einer der drei Kettenabbruchreaktionen kommen. Sowohl die Startreaktion wie auch die Kettenabbruchreaktionen sind rein anteilsmäßig gegenüber den eigentlichen Kettenfortpflanzungsschritten vernachlässigbar, fallen also nicht ins Gewicht bei der Aufstellung der Energiebilanz.
Aufgabe 4
Auch für diese Aufgabe benötigen Sie die beiden Tabellen mit den Bindungsdissoziationsenergie.
Die Energiebilanz für die Hexan-Bromierung hatten Sie ja bereits in Aufgabe 2 berechnet. Berechnen Sie nun bitte auch die Energiebilanz für die Fluorierung, Chlorierung und Iodierung von Hexan, unter der Annahme, dass ein sekundäres H-Atom substituiert wird.
Lösung:
Für die Spaltung der sekundären C-H-Bindung hatten wir in Aufgabe 2 bereits eine Bindungsdissoziationsenergie von 414 kJ/mol angenommen. Dieser Wert bleibt gleich, egal ob wir das Alkan fluorieren, chlorieren, bromieren oder iodieren. Entscheidend sind aber die Bindungsdissoziationsenergie des Halogenmoleküls sowie die Energiebeträge, die bei der Bildung von C-F-, C-Br- und C-I-Bindungen sowie H-F-, H-Br- und H-I-Bindungen freigesetzt werden.
Im Folgenden werden einfach nur die "nackten" Zahlen notiert:
| Reaktion | sek. C-H-Bindung | X-X-Bindung | C-X-Bindung | H-X-Bindung | Energiebilanz |
|---|---|---|---|---|---|
| Fluorierung | 414 | 159 | 489 | 567 | -483 |
| Chlorierung | 414 | 242 | 339 | 431 | -114 |
| Bromierung | 414 | 193 | 285 | 366 | -44 |
| Iodierung | 414 | 151 | 218 | 298 | +49 |
Bei der Fluorierung wird also der größte Energiebetrag freigesetzt, die Reaktionsenthalpie liegt hier bei -483 kJ/mol. Bei der Chlorierung wird schon weniger Energie freigesetzt, bei der Bromierung noch weniger. Bei der Iodierung handelt es sich schon um eine endotherme Reaktion, die Reaktionsenthalpie beträgt hier +49 kJ/mol.
Zusatzaufgabe
Begründen Sie, wieso die zweite Aktivierungsenergie niedriger ist als die erste Aktivierungsenergie! Sie sollten dazu wieder die Seite mit den Bindungsdissoziationsenergien konsultieren.
Lösung:
Die Aktivierungsenergie einer chemischen Reaktion ist notwendig, weil zu Beginn der Reaktion erst mal ein paar chemische Bindungen getrennt werden müssen.
Im ersten Kettenfortpflanzungsschritt muss eine C-H-Bindung getrennt werden. Dazu sind 439 kJ/mol notwendig, ein recht hoher Betrag.
Im zweiten Kettenfortpflanzungsschritt muss eine Cl-Cl-Bindung getrennt werden. Dazu sind aber nur 242 kJ/mol notwendig, ein relativ niedriger Betrag.
Seitenanfang -
zurück zur Seite mit den Aufgaben...