Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- Wie die Halogenierung eines Alkans Schritt für Schritt abläuft (EF),
- welche Rolle dabei Radikale spielen (EF),
- was man unter einer Startreaktion, einem Kettenfortpflanzungsschritt und einer Abbruchreaktion versteht (EF),
- wie man die Reaktionsenthalpie einer solchen Reaktion berechnet (Q1)
- wie man das Energiediagramm einer zweistufigen Reaktion deutet bzw. selbst erstellt (Q1),
- welche Rolle die Chlorierung von Methan in der Praxis spielt (EF, Q1)
Falls Sie sich für ein Chemie-Studium interessieren, finden Sie in der Abteilung "Studienvorbereitung OC" eine Seite zur Radikalischen Substitution, die ähnliche Aspekte der SR behandelt, wie sie auch im ersten oder zweiten Semester des Chemie-Studiums besprochen werden.
Die Studienvorbereitungs-Seiten sollen keine Vorlesung oder ein Hochschul-Lehrbuch ersetzen, sondern Sie darauf gezielt vorbereiten!
Eine Kettenreaktion
Die Bromierung von Hexan erfolgt in mehreren Schritten. Damit wir aber nicht ständig sechs C-Atome mit ihren zugehörigen H-Atomen zeichnen müssen, stellen wir hier den Mechanismus der Substitution an einem etwas einfacheren Beispiel vor. Wir wollen auf dieser Seite darstellen, wie Methan, das einfachste Alkan, bromiert wird.
Kettenstart
Der erste Schritt der Methan-Bromierung ist die Spaltung eines Brom-Moleküls in zwei freie Brom-Atome.
So ganz einfach ist die Spaltung eines Moleküls nicht, es muss ein recht hoher Energiebetrag aufgewendet werden. Deswegen muss man den Erlenmeyerkolben bei der Bromierung von Hexan auch auf einen Tageslichtprojektor stellen oder mit einem hellen Strahler belichten. Im Dunklen läuft die Reaktion nicht ab, zumindest nicht innerhalb einer Schulstunde. Da Blaulicht energiereicher ist als Rotlicht, läuft die Startreaktion im Blaulicht auch wesentlich schneller ab als im Rotlicht.
Hier die Startreaktion:
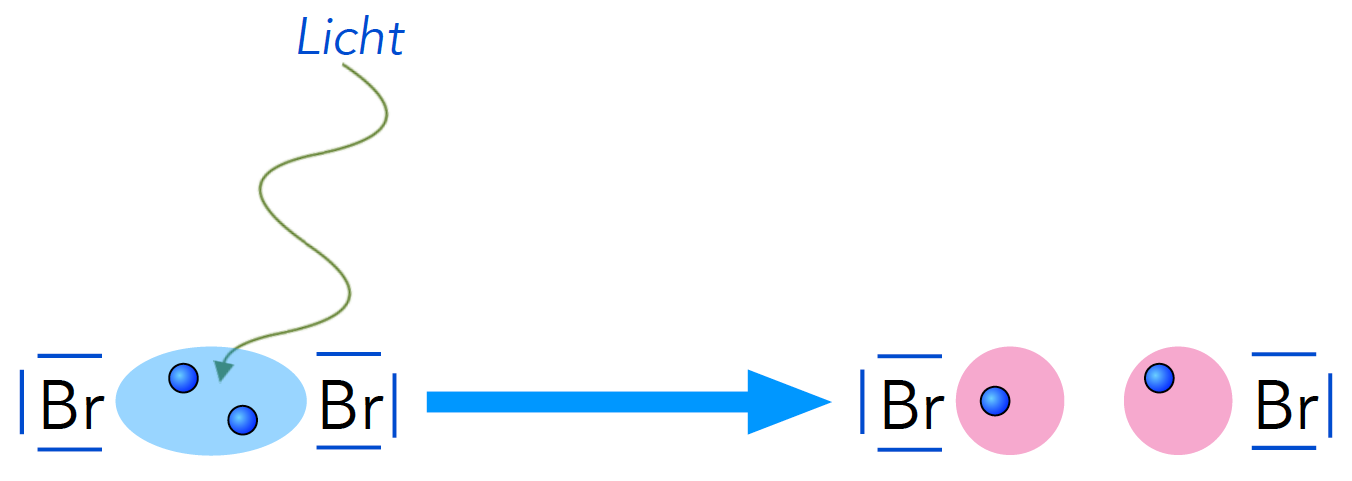
Die Photolyse des Brom-Moleküls
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Brom-Molekül wird durch energiereiches Licht homolytisch gespalten. Die Spaltung einer kovalenten Bindung durch Lichtenergie wird auch als Photolyse bezeichnet.
Durch die Homolyse entstehen zwei freie Brom-Atome. Wegen ihres ungepaarten Elektrons handelt es sich dabei um Radikale, im Folgenden werden wir also stets von Brom-Radikalen sprechen und weniger von Brom-Atomen.
Jedes Brom-Radikal besitzt drei doppelt besetzte Kugelwolken (durch die Striche gekennzeichnet) und eine Kugelwolke, die mit nur einem Elektron besetzt ist. Diese Kugelwolken werden in der obigen und in den folgenden Zeichnungen als rosafarbene Kreise dargestellt, nicht als Punkt, wie bei Lewis-Formeln normalerweise üblich.
1. Kettenfortpflanzungsschritt
Die Brom-Atome mit ihrem ungepaarten Elektron sind nun extrem reaktiv.
Eine Kugelwolke mit einem ungepaarten Elektron ist energetisch sehr ungünstig. Jede Kugelwolke strebt den Besitz von zwei Elektronen an. Daher sind Teilchen mit einer einfach besetzten Kugelwolke extrem reaktiv und werden als Radikale bezeichnet.
Auf dieser Lexikon-Seite erfahren Sie mehr über Radikale: Bildung von Radikalen, Stabilität von Radikalen etc., aber auch zum Beispiel wie Vitamine schädliche Radikale in unseren Zellen abfangen.
Wo soll das entstandene Brom-Radikal nun das fehlende Elektron her nehmen? Schauen wir uns dazu die Reaktionsgleichung des ersten Kettenfortpflanzungsschrittes näher an:

Der erste Kettenfortpflanzungsschritt
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Wenn ein Brom-Radikal mit einem Methan-Molekül zusammenstößt, kann es passieren, dass das Brom-Radikal ein H-Atom samt einem der beiden Bindungselektronen aus dem Methan-Molekül heraus reißt. Dann hat das Brom-Radikal zwar sein zweites Elektron, allerdings hat es sich dabei auch ein H-Atom "eingefangen". Aus dem Brom-Radikal ist daher zusammen mit dem abstrahierten H-Atom ein HBr-Molekül entstanden.
"Abstrahiertes H-Atom" heißt so viel wie "aus einem Molekül homolytisch herausgezogenes H-Atom". Das ist ja genau das, was das Brom-Radikal macht, es zieht aus dem Alkan ein H-Atom zusammen mit einem der beiden Bindungselektronen heraus.
Durch die Abstraktion des H-Atoms ist aus dem Methan-Molekül ein Methyl-Radikal geworden. Das Methyl-Radikal befindet sich nun selbst in einem energetisch ungünstigen Zustand, weil es eine Kugelwolke mit nur einem Elektron besitzt. Was passiert nun?
2. Kettenfortpflanzungsschritt
Stößt das Methyl-Radikal •CH3 auf ein Brom-Molekül Br2, so passiert folgendes:

Der zweite Kettenfortpflanzungsschritt
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Das Methyl-Radikal abstrahiert ein Brom-Atom aus dem Br2-Molekül und übernimmt dabei eines der beiden Bindungselektronen der Br-Br-Bindung. Aus dem Methyl-Radikal wird ein Brommethan-Molekül Br-CH3, und übrig bleibt ein neues Brom-Radikal Br•.
Kettenreaktion
Das entstandene Brom-Radikal kann nun wieder mit einem neuen Methan-Molekül reagieren und ein H-Atom abstrahieren, und damit sind wir wieder beim ersten Kettenfortpflanzungsschritt. Dort entsteht ein neues Methyl-Radikal, das dann wieder mit einem weiteren Brom-Molekül zu Brommethan und einem weiteren Brom-Radikal reagiert.
Und so geht das viele Hundert oder sogar Tausend Male weiter, man spricht hier von einer Reaktionskette oder einer Kettenreaktion.
Theoretisch könnte die Kettenreaktion so lange weiterlaufen, bis die Ausgangsstoffe aufgebraucht sind. Meistens kommt es aber schon vorher zu einem Kettenabbruch, weil zwei Radikale zusammenstoßen und sich so zu einem Molekül vereinigen.
Kettenabbruch
Ein Kettenabbruch findet immer dann statt, wenn zwei Radikale zusammenstoßen. Dafür gibt es bei der Bromierung von Methan drei Möglichkeiten:
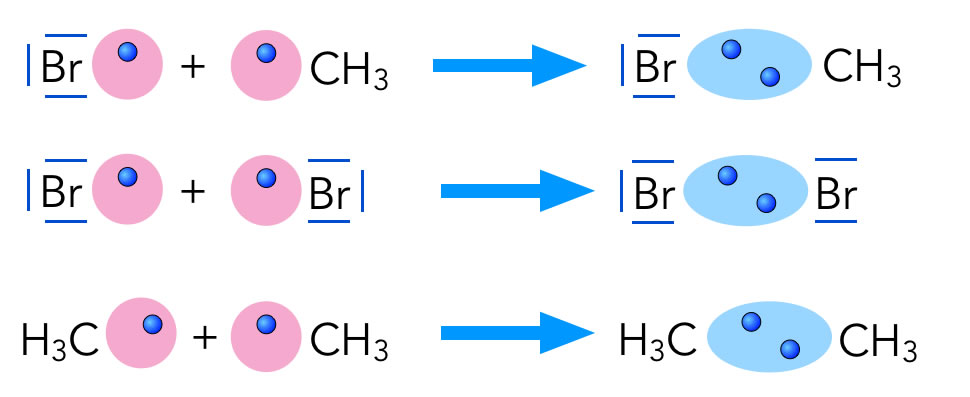
Die drei möglichen Abbruchreaktionen
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
- Ein Brom-Radikal vereinigt sich mit einem Methyl-Radikal zu einem Brommethan-Molekül.
- Zwei Brom-Radikale vereinigen sich zu einem Brom-Molekül.
- Zwei Methyl-Radikale vereinigen sich zu einem Ethan-Molekül.
Die dritte Möglichkeit ist besonders interessant. Tatsächlich kann man bei der Umsetzung von Brom mit Methan geringe Spuren von Ethan als Nebenprodukt nachweisen.
Aufgaben
Aufgabe 1
Erklären Sie die Tatsache, dass bei der Bromierung von Methan auch geringe Spuren von Brom-ethan als Nebenprodukt auftreten.
Aufgabe 2
Für diese Aufgabe benötigen Sie die beiden Tabellen mit den Bindungsdissoziationsenergie.
Berechnen Sie die Energiebilanz der Hexan-Bromierung
a) Für den Fall, dass ein primäres H-Atom substituiert wird,
b) für den Fall, dass ein sekundäres H-Atom substituiert wird.
Tipp: Auf der Seite "Bindungsdissoziationsenergie" finden Sie zwei Tabellen. Sie müssen für diese Aufgabe beide Tabellen heranziehen!
Aufgabe 3
Begründen Sie, wieso die Reaktionsenthalpie der Startreaktion sowie der Kettenabbruchreaktionen bei der Berechnung der Gesamtenergiebilanz keine Rolle spielen.
Aufgabe 4
Auch für diese Aufgabe benötigen Sie die beiden Tabellen mit den Bindungsdissoziationsenergien.
Die Energiebilanz für die Hexan-Bromierung hatten Sie ja bereits in Aufgabe 2 berechnet. Berechnen Sie nun bitte auch die Energiebilanz für die Fluorierung, Chlorierung und Iodierung von Hexan, unter der Annahme, dass ein sekundäres H-Atom substituiert wird.
Sie sollten versuchen, die Aufgaben zunächst selbst und ohne Hilfe zu lösen. Wenn Sie Ihre Lösungen dann überprüfen wollen, gehen Sie auf die Lösungsseite und vergleichen Sie mit Ihren Lösungen.
Energetische Betrachtungen Q1, Q2
Wir wollen uns nun ein Energiediagramm anschauen, das die energetischen Umsetzungen während der beiden Kettenfortpflanzungsschritte der Reaktion von Chlor mit Methan zeigt. Auf die Startreaktion und die Abbruchreaktionen können wir dabei verzichten, weil sie im Vergleich zu den Kettenfortpflanzungsschritten ja recht selten vorkommen.
Theoretische Vorüberlegungen
Bei der Kettenfortpflanzung haben wir es mit zwei Reaktionsschritten zu tun. Das Energiediagramm sollte also aus zwei einzelnen Diagrammen bestehen, eines für jede Teilreaktion. Jedes dieser beiden Diagramme hat dann einen Übergangszustand. Man sollte also eine zweigipfelige Kurve erwarten.
Energiediagramm
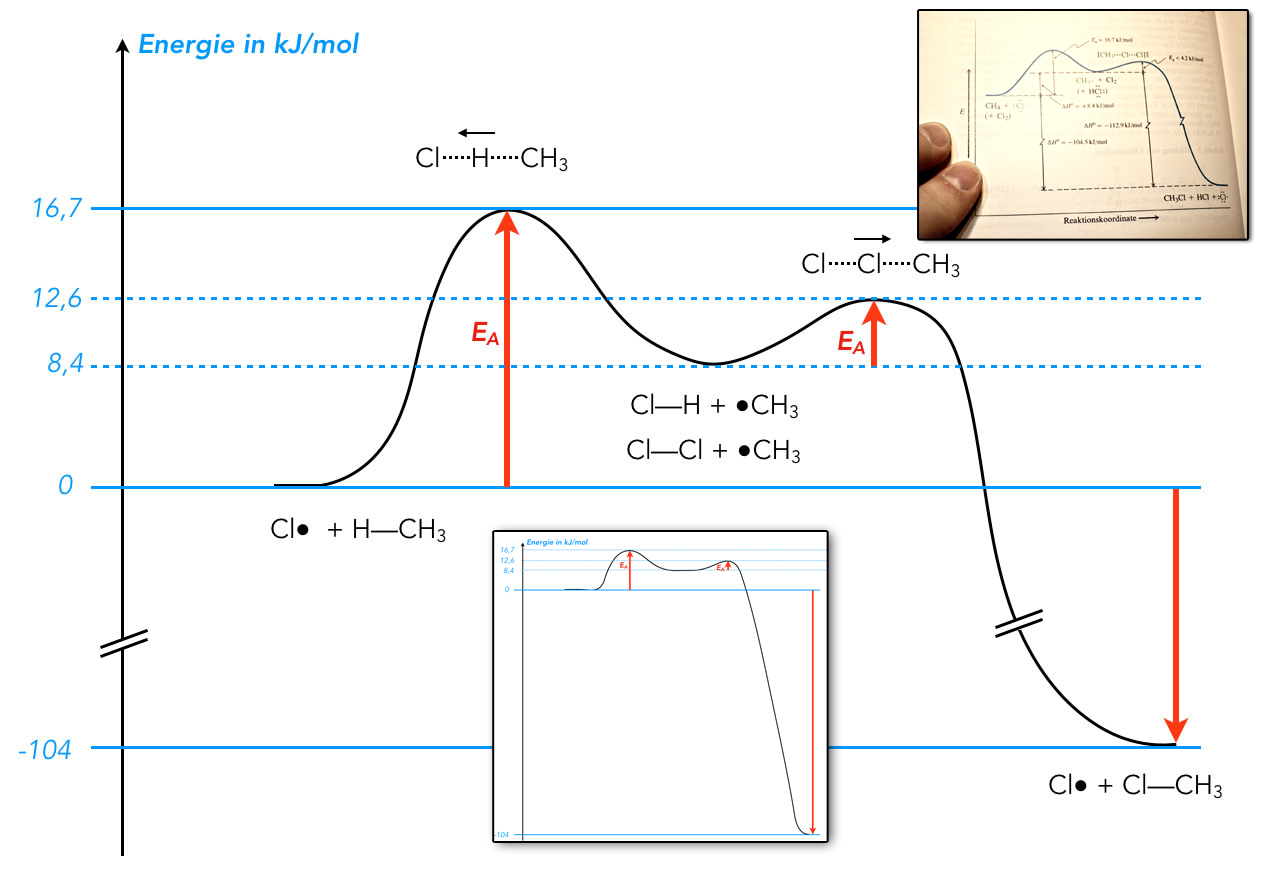
Energiediagramm der Methanchlorierung
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Die Daten für dieses Energiediagramm stammen aus dem Buch von Vollhardt und Schore [2]. So ähnlich wie in dieser Abbildung sind die Energiediagramme in den meisten Lehrbüchern dargestellt. In der Mitte des Bildes sehen Sie eine maßstabsgerechte Darstellung des Energiediagramms.
Erster Kettenfortpflanzungsschritt
Der erste Kettenfortpflanzungsschritt ist endotherm, die Reaktionsenthalpie ΔH hat einen Wert von 8,4 kJ/mol, die Aktivierungsenergie EA für diesen Schritt beträgt 16,7 kJ/mol.
Der Übergangszustand des ersten Kettenfortpflanzungsschrittes ist abgebildet: Das Chlor-Atom hat ein H-Atom des Methans schon "halb herausgezogen", halb ist das H-Atom noch mit dem Methan-Molekül verbunden. Diese "halben Bindungen" werden durch die gestrichelten Linien angedeutet, und der kleine Pfeil über dem Übergangskomplex soll andeuten, dass das H-Atom zum Cl-Atom gezogen wird.
Zwischenprodukt
Im Tal zwischen den beiden Übergangszuständen befinden sich jetzt die Zwischenprodukte der zweischrittigen Reaktion. Wenn der erste Kettenfortpflanzungsschritt beendet ist, haben wir Chlorwasserstoff HCl sowie ein Methyl-Radikal vorliegen. Gleichzeitig sind aber auch noch jede Menge Chlor-Moleküle vorhanden, die wir ebenfalls berücksichtigen müssen. Denn im nächsten Kettenfortpflanzungsschritt reagiert ja das Methyl-Radikal mit einem dieser Chlor-Moleküle.
Zweiter Kettenfortpflanzungsschritt
Der Übergangszustand des zweiten Kettenfortpflanzungsschrittes sieht ähnlich aus wie der Übergangszustand des ersten Kettenfortpflanzungsschrittes. Aber der Übergangskomplex besteht jetzt aus einem Chlor-Molekül und einem Methyl-Radikal. Dabei hat das Methyl-Radikal das eine Chlor-Atom schon halb aus dem Chlor-Molekül abstrahiert, was wieder durch den kleinen Pfeil angedeutet wird.
Als Endprodukt des zweiten Kettenfortpflanzungsschrittes haben wir dann Chlormethan sowie ein neues Chlor-Radikal. Die Reaktionsenthalpie der gesamten Reaktion ist mit -104 kJ/mol recht hoch.
Zusatzaufgabe (Aufgabe 5)
Begründen Sie, wieso die zweite Aktivierungsenergie niedriger ist als die erste Aktivierungsenergie! Sie sollten dazu wieder die Seite mit den Bindungsdissoziationsenergien konsultieren.
Chlorierung von Methan in der Praxis
Die Chlorierung von Methan spielt eine große Rolle in der Schulpraxis, weil es eine einfache Reaktion ist, die man Schüler(innen) gut an der Tafel erklären kann.
Im Labor spielt die Chlorierung von Methan dagegen keine Rolle, die Reaktion ist recht aufwendig durchzuführen und auch viel zu gefährlich. Außerdem erhält man kein reines Chlormethan, sondern ein Gemisch verschiedener Produkte. Die Chlorierung bleibt ja nicht auf der Stufe des Chlormethans stehen, sondern das gebildete Chlormethan kann ebenfalls mit Chlor in einer radikalischen Substitution reagieren, zu Dichlormethan. Im nächsten Schritt entsteht dann Trichlormethan, und wenn dieses weiter mit Chlor reagiert, erhält man schließlich Tetrachlormethan.
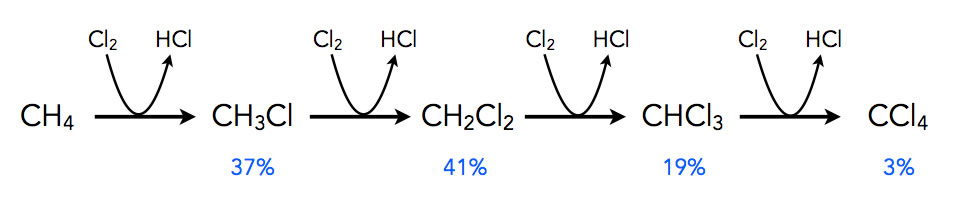
Produktverhältnisse bei der Chlorierung von Methan
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Die obige Abbildung zeigt die Produktverhältnisse bei der Chlorierung von Methan bei 400 Grad Celsius und einem Edukt-Verhältnis von 1:1 [4].
Methanchlorierung in der Industrie
Aufgabe 6
- Chlormethan: -23.8 ºC
- Dichlormethan: 40 ºC
- Trichlormethan: 61 ºC
- Tetrachlormethan: 76,7 ºC
Die Auflistung zeigt die Siedepunkte der vier verschiedenen Chlormethane.
Erläutern Sie, warum es bei der industriellen Methanchlorierung nicht so schlimm ist, wenn ein Gemisch aus verschiedenen Chlormethanen entsteht.
Abiturienten im Fach Chemie oder Leute, die eine Chemie-Klausur schreiben, sollten versuchen, diese Aufgabe zunächst einmal selbst zu lösen, bevor sie sich den Lösungsvorschlag ansehen.
Lösungsvorschlag:
Bei der industriellen Methanchlorierung ist es nicht so schlimm, wenn ein Produktgemisch aus verschiedenen Chlormethanen entsteht. Die Siedepunkte der verschiedenen Chlorierungsprodukte unterscheiden sich stark voneinander, so dass man die einzelnen Produkte durch Destillation leicht voneinander trennen kann.
Jedes der oben genannten Produkte, vom Chlormethan bis zum Tetrachlormethan, ist ein wichtiger Ausgangsstoff für weitere Synthesen oder kann als Lösemittel für chemische Prozesse verwendet und daher auch gut verkauft werden.
Außerdem ist die Chlorierung von Methan und anderen Alkanen relativ leicht durchzuführen, im Gegensatz zur Fluorierung, die höchst gefährlich ist (und teuer). Chlor ist ein relativ preiswerter Ausgangsstoff, das Gas kann leicht aus der Elektrolyse von Natriumchlorid gewonnen werden (was bei Fluor oder Brom nicht der Fall ist).
Von den ersten drei Produkten wurden im Jahre 2002 allein in Westeuropa mehr als 500.000 Tonnen hergestellt. Tetrachlorkohlenstoff soll wegen seiner Umweltgefährlichkeit und Gesundheitsgefährlichkeit (wahrscheinlich Krebs erregend) nicht mehr verwendet werden und spielt daher keine so große Rolle mehr in der industriellen Herstellung [4].
Falls Sie sich für ein Chemie-Studium interessieren, finden Sie in der Abteilung "Studienvorbereitung OC" eine Seite zur Radikalischen Substitution, die ähnliche Aspekte der SR behandelt, wie sie auch im ersten oder zweiten Semester des Chemie-Studiums besprochen werden.
Die Studienvorbereitungs-Seiten sollen keine Vorlesung oder ein Hochschul-Lehrbuch ersetzen, sondern Sie darauf gezielt vorbereiten!
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- C. SCHMUCK, Basisbuch Organische Chemie, Hallbergmoos 2018.