Die Bindungdissoziationssenergie (auch Bindungsenergie, Dissoziationsenergie oder Bindungsenthalpie genannt) ist der Energiebetrag, der aufgebracht werden muss, um die beiden Atome einer kovalenten chemischen Bindung homolytisch in zwei Radikale zu trennen.
Die Größe der Bindungsenergie einer kovalenten Bindung hängt von mehreren Faktoren ab, zum Beispiel der Bindungslänge, der Elektronegativität der beiden Atome und natürlich davon, ob es sich um eine Einfach-, eine Doppel- oder sogar um eine Dreifachbindung handelt.
- Je kürzer die Bindung, desto höher die Bindungsenergie.
- Je größer der EN-Unterschied, desto polarer die kovalente Bindung und desto höher die Bindungsenergie.
- Je mehr Einzelbindungen, desto größer die Bindungsenergie (d.h. eine Doppelbindung lässt sich schwerer spalten als eine Einfachbindung).
Bindungsenergien bekannter kovalenter Bindungen
Die Folgende Tabelle entsammt dem Wikipedia-Artikel zur Bindungsenergie.
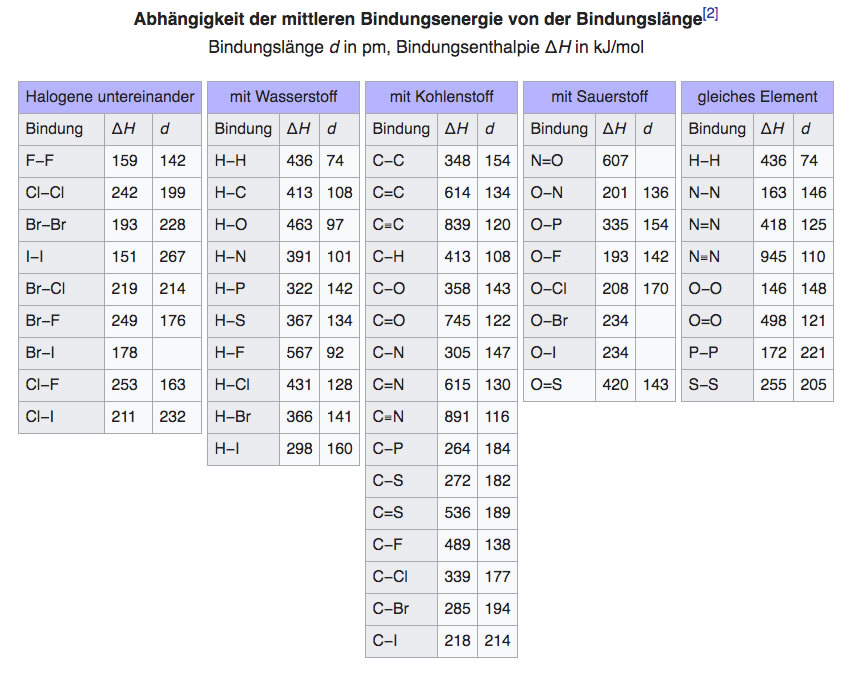
Tabelle 1: Die Bindungsenergien einiger ausgewählter Bindungen.
Quelle: Wikipedia, Artikel "Bindungsenergie"
Rechnen mit Bindungsenergien, ein Beispiel
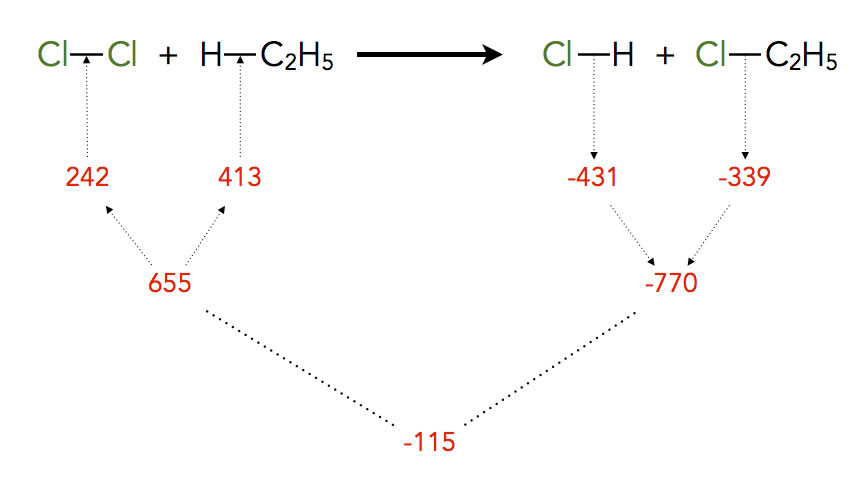
Betrachten wir einmal die Reaktion von Chlor mit Ethan:
Es müssen zwei Bindungen gespalten werden, laut Tabelle kostet das 655 kJ/mol. Auf der anderenSeite entstehen auch zwei neue Bindungen, dabei werden 770 kJ/mol freigesetzt. Weil diese Beträge freigesetzt werden (exotherme Reaktion), bekommen sie ein Minuszeichen.
Addiert man nun die aufgewandte Energie und die freigesetzte Energie, so kommt man auf die Reaktionsenthalpie von -115 kJ/mol.
Anmerkung:
In der Wikipedia-Tabelle wird bei den C-H-Bindungen nicht unterschieden, ob es sich um ein primäres, ein sekundäres oder ein tertiäres C-Atom handelt. Hier ist die Tabelle in der englischen Wikipedia wesentlich genauer:
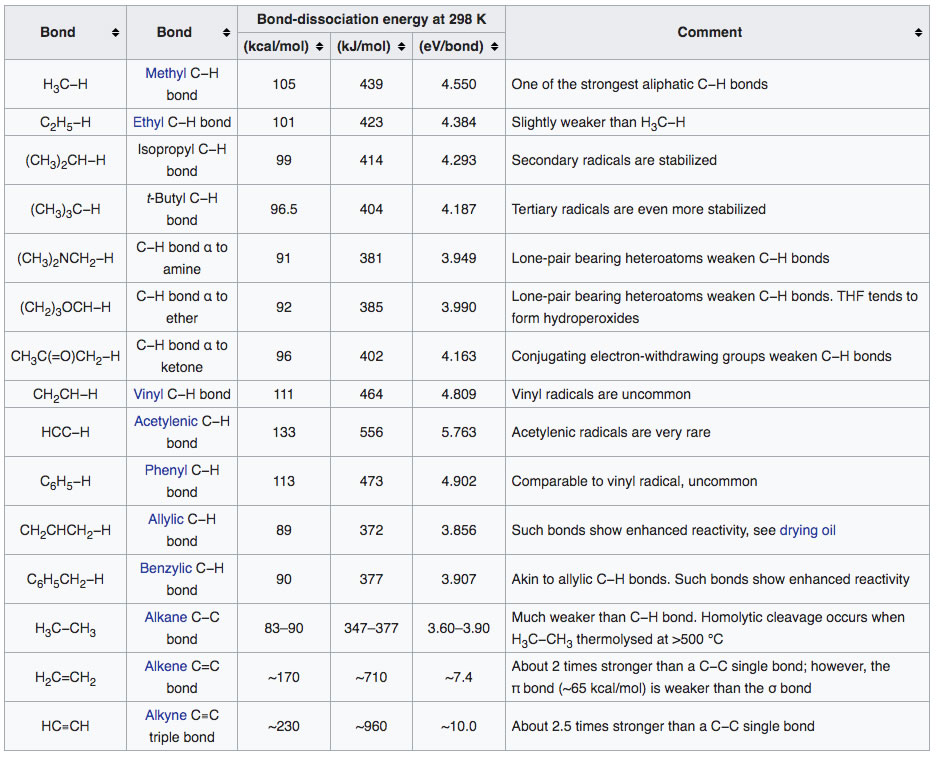
Tabelle 2: Bindungsdissoziationsenergien für organische Verbindungen
Quelle: Englische Wikipedia, Artikel "Bond dissociation energy".
Legen wir diese Tabelle zu Grunde, dann müssten wir für die Spaltung der C-H-Bindung im Ethen 423 kJ/mol einsetzen und nicht 413 kJ/mol.