Beispiel Benzol-Molekül
Das wohl bekannteste Beispiel für Mesomerie ist das Benzol-Molekül.
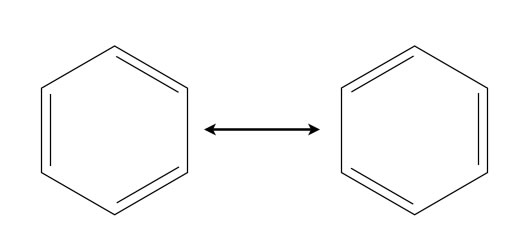
Die beiden Grenzstrukturen des Benzols
Rein formal gesehen ist das Benzol nicht anderes als ein Cyclohexatrien, also ein Ring ("cyclo") aus sechs C-Atomen ("hexa" = 6) mit drei konjugierten C=C-Doppelbindungen ("trien" = drei Doppelbindungen").
In jedem guten Schulbuch findet sich nun folgende Abbildung, mit der der Begriff der Mesomerieenergie erklärt wird:
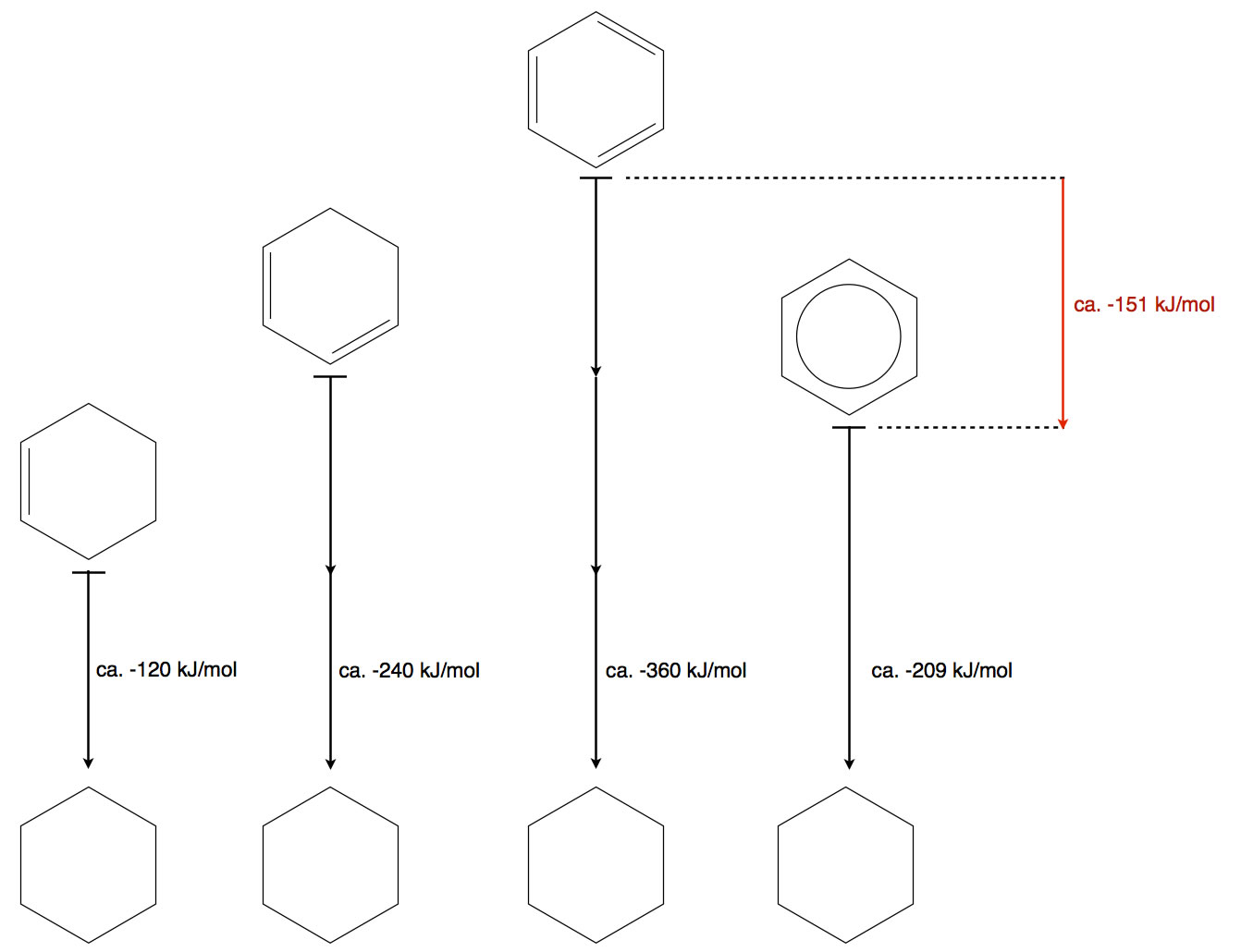
Die Hydrierung von Cyclohexen, Cyclohexadien, Cyclohexatrien und Benzol
Autor: Ulrich Helmich 12/2019, Lizenz: Public domain.
Hydriert man Cyclohexen (addiert man also Wasserstoff an die Doppelbindung), wird eine Reaktionsenthalpie von ca. -120 kJ/mol freigesetzt. Das liegt daran, dass zwei neue C-H-Bindungen entstehen. Immer dann, wenn eine Bindung gespalten wird, muss Energie aufgewendet werden (Bindungsdissoziationsenergie oder kurz Bindungsenergie), und logischerweise wird bei der Bildung einer neuen Bindung Energie freigesetzt.
Wenn man Cyclohexadien hydriert, werden ca. -240 kJ/mol Energie freigesetzt, also das Doppelte des Energiebetrags, der bei der Cyclohexen-Hydrierung gewonnen wurde. Das ist ja auch logisch: Zwei C=C-Doppelbindungen setzen bei der Hydrierung doppelt so viel Energie frei wie eine C=C-Doppelbindung.
Die Verbindung Cyclohexatrien, wenn es sie denn gäbe, würde bei der Hydrierung folglich -360 kJ/mol freisetzen. Bei der Hydrierung von Benzol, das formal ja ein Cyclohexatrien ist, werden allerdings nur -209 kJ/mol freigesetzt. Das sind 151 kJ/mol weniger als eigentlich erwartet.
Betrachtet man nun die Abbildung 1, so kann man die Darstellung folgendermaßen interpretieren: Je weiter eine Strukturformel in der Zeichnung oben steht, desto höher ist ihre Energie. Die Energie von Cyclohexen ist also größer als die Energie von Cyclohexan. Der Energieunterschied beträgt 120 kJ/mol. Cyclohexadien hat eine um 120 kJ/mol höhere Energie als Cyclohexen, und Benzol müsste eigentlich eine um 120 kJ/mol höhere Energie haben als Cyclohexadien. Hat es aber nicht! Im Gegenteil, Benzol ist sogar energieärmer als Cyclohexadien.
"Energieärmer" ist aber in der Chemie immer gleichbedeutend mit "stabiler". Das Benzol-Molekül ist also stabiler als das Cyclohexadien-Molekül und viel stabiler als das fiktive Cyclohexatrien-Molekül. Woran das liegt? Natürlich an der Fähigkeit des Benzol-Moleküls zur Mesomerie. Entsprechend heißt der Energieunterschied zwischen der Energie, die das Benzol eigentlich haben sollte und der Energie, die es tatsächlich hat, Mesomerieenergie. Benzol hat also eine Mesomerieenergie von -151 kJ/mol.
Grundsätzlich kann man wohl sagen: Je mehr Grenzstrukturen ein Molekül hat, desto größer ist auch seine Mesomerieenergie und damit seine Stabilität.